- 2021-05-14 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
硫元素相关高考题
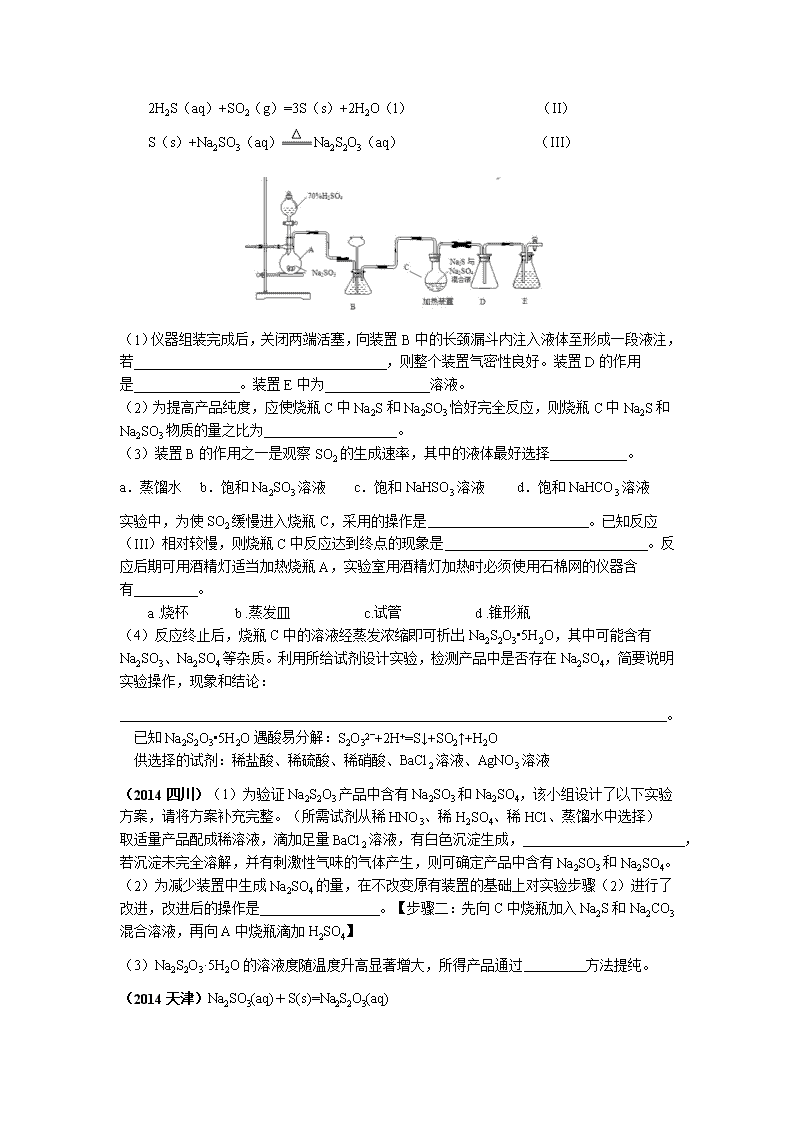
期中复习一(以硫为主、实验操作) 1、(2014 重庆)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中 SO2 最大使用量为 0.25g·L-1。某兴趣小组用以下装置,收集某葡萄酒中 SO2,并对其含量进行测定。 (1)仪器 A 的名称是 ,A 的作用 ,水通入 A 的进口为 。 (2)B 中加入 300.00mL 葡萄酒和适量盐酸,加热使 SO2 全部逸出并与 C 中 H2O2 完全反应, 其化学方程式为 。 (3)除去 C 中过量的 H2O2,然后用 0.0900mol·L-1NaOH 标准溶液进行滴定,滴定前排气泡时, 应选上图中的 ;若滴定终点时溶液的 pH=8.8,则选择的指示剂为 ; 若用 50mL 滴定管进行实验,当滴定管中的液面在刻度“ 10”处,则管内液体的体积 。 (填序号)(①=10mL,②=40mL,③<10mL,④>40mL) (4)滴定至终点时,消耗 NaOH 溶液 25.00mL,该葡萄酒中 SO2 含量为 g·L-1 (5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: 。 (2014 北京)(3)将气体 a(SO2、CO2)通入测碳装置中,采用重量法测定碳的含量。 ①气体 a 通过 B 和 C 的目的是 。 ②计算钢样中碳的质量分数,应测量的数据是 。 (2015 四川)(2)用 0.2000mol/L NaOH 溶液滴定该盐酸,终点时消耗 NaOH 溶液 25.00 mL。 滴定前,下列操作的正确顺序是_________(填字母编号)。 a. 盛装 0.2000mol/L NaOH 溶液 b.用 0.2000mol/L NaOH 溶液润洗 c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面 2、(2014 山东)工业上常利用含硫废水生产 Na2S2O3•5H2O,实验室可用如下装置(略去部 分加持仪器)模拟生成过程。 烧瓶 C 中发生反应如下: Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I) 2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II) S(s)+Na2SO3(aq) Na2S2O3(aq) (III) (1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液注, 若 ,则整个装置气密性良好。装置 D 的作用 是 。装置 E 中为 溶液。 (2)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3 恰好完全反应,则烧瓶 C 中 Na2S 和 Na2SO3 物质的量之比为 。 (3)装置 B 的作用之一是观察 SO2 的生成速率,其中的液体最好选择 。 a.蒸馏水 b.饱和 Na2SO3 溶液 c.饱和 NaHSO3 溶液 d.饱和 NaHCO3 溶液 实验中,为使 SO2 缓慢进入烧瓶 C,采用的操作是 。已知反应(III) 相对较慢,则烧瓶 C 中反应达到终点的现象是 。反应后期 可用酒精灯适当加热烧瓶 A,实验室用酒精灯加热时必须使用石棉网的仪器含有 。 a .烧杯 b .蒸发皿 c.试管 d .锥形瓶 (4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩即可析出 Na2S2O3•5H2O,其中可能含有 Na2SO3、Na2SO4 等杂质。利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说明 实验操作,现象和结论: 。 已知 Na2S2O3•5H2O 遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O 供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2 溶液、AgNO3 溶液 (2014 四川)(1)为验证 Na2S2O3 产品中含有 Na2SO3 和 Na2SO4,该小组设计了以下实验 方案,请将方案补充完整。(所需试剂从稀 HNO3、稀 H2SO4、稀 HCl、蒸馏水中选择) 取适量产品配成稀溶液,滴加足量 BaCl2 溶液,有白色沉淀生成, , 若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有 Na2SO3 和 Na2SO4。 (2)为减少装置中生成 Na2SO4 的量,在不改变原有装置的基础上对实验步骤(2)进行了 改进,改进后的操作是 。【步骤二:先向 C 中烧瓶加入 Na2S 和 Na2CO3 混合溶液,再向 A 中烧瓶滴加 H2SO4】 (3)Na2S2O3·5H2O 的溶液度随温度升高显著增大,所得产品通过 方法提纯。 (2014 天津)Na2SO3(aq)+S(s)=Na2S2O3(aq) (1)硫粉在反应前用乙醇润湿的目的是__________________________。 (2)产品中除了有未反应的 Na2SO3 外,最可能存在的无机杂质是______________。检验是否 存在该杂质的方法是____________________________。 (3)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: __________________________________________________。 (4)测定产品纯度 准确称取 Wg 产品,用适量蒸馏水溶解,以淀粉作指示剂,用 0.1000 mol·L-1 碘的标准溶液 滴定。反应原理为 2S2O32-+I2===S4O62-+2I- 滴定至终点时,溶液颜色的变化:________________________________。 (5)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 __________mL。产品的纯度为______________(设 Na2S2O3·5H2O 相对分 子质量为 M )。 (6)Na2S2O3 还原性较强,在溶液中易被 Cl2 氧化成 SO42-,常用作脱氯剂, 该反应的离子方程式为_____________________________________。 (2012 福建)(4)证明 NaHSO3 溶液中 HSO3-的电离程度大于水解程度,可采用的实验方 法是 。(填序号)。 a.测定溶液的 pH b.加入 Ba(OH)2 溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测 (5)检验 Na2S2O5 晶体在空气中已被氧化的实验方案是 。(已 知 Na2S2O5 溶于水即生成 NaHSO3) 3、(2015 安徽)某研究小组将纯净的 SO2 气体通入 0.1mol•L‾1 的 Ba(NO3)2 溶液中,得到了 BaSO4 沉淀,为探究上述溶液中何种微粒能氧化通入的 SO2,该小组突出了如下假设: 假设一:溶液中的 NO3 - 假设二:溶液中溶解的 O2 (1)验证假设一 该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象 实验步骤 实验现象 结论 实验 1:在盛有不含 O2 的 25ml0.1mol/LBaCl2 溶液的烧 杯中,缓慢通入纯净的 SO2 气体 假设一成立 实验 2:在盛有不含 O2 的 25ml0.1mol/LBa(NO3)2 溶 液的烧杯中,缓慢通入纯净的 SO2 气体 (2)为深入研究该反应,该小组还测得上述两个实验中溶液的 pH 随通入 SO2 体积的变化曲线 入下图: 实验 1 中溶液 pH 变小的原因是 ; 实验 2 中溶液 pH 小于实验 1 的原因是(用离子方程式表 示) 。 (3)验证假设二 请设计实验验证假设二,写出实验步骤,预期现象和结论。 实验步骤 实验现象 结论 假设二成立 (4)若假设二成立,请预测:在相同条件下,分别通入足量的 O2 和 KNO3,氧化相同的 H2SO3 溶液(溶液体积变化忽略不计),充分反映后两溶液的 pH 前者_______(填大于或小 于)后者,理由是 4、(2016 北京)以 Na2SO3 溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和 盐溶液间反应的多样性。 实验 试剂 现象 滴管 试管 0.2mol·L−1 Na2SO3 溶液 饱和 Ag2SO4 溶液 Ⅰ.产生白色沉淀 0.2 mol·L−1 CuSO4 溶液 Ⅱ.溶液变绿,继续滴加 产生棕黄色沉淀 0.1 mol·L−1 Al2(SO4)3 溶液 Ⅲ.开始无明显变化,继 续滴加产生白色沉淀 (1)经检验,现象Ⅰ中的白色沉淀是 Ag2SO3。用离子方程式解释现象Ⅰ:____________。 (2)经检验,现象Ⅱ的棕黄色沉淀中不含 SO42−,含有 Cu+、Cu2+和 SO32−。 已知:Cu+ 稀硫酸 Cu +Cu2+,Cu2+ I CuI↓(白色)+I2。 ①用稀硫酸证实沉淀中含有 Cu+的实验现象是 。 ②通过下列实验证实,沉淀中含有 Cu2+和 SO32−。 a.白色沉淀 A 是 BaSO4,试剂 1 是 。 b.证实沉淀中含有 Cu2+和 SO32−的理由是 。 (3)已知:Al2(SO4)3 在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无 SO42−,该白 色沉淀既能溶于强酸,又能溶于强碱,还可使酸性 KMnO4 溶液褪色。 ①推测沉淀中含有亚硫酸根和________。 ②对于沉淀中亚硫酸根的存在形式提出假设:i.被 Al(OH)3 所吸附;ii.存在于铝的碱式盐中。 对假设 ii 设计了对比实验,证实了假设 ii 成立。 a.将对比实验方案补充完整。 步骤二:(按上图形式呈现)。 能证明假设二成立的实验结果为 。 (4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。 复习一答案 1(1)冷凝管,冷凝回流,b (2)SO2+H2O2=H2SO4 (3)③;酚酞;④(4)0.24 (5)原因:盐酸的挥发; 改进措施:用不挥发的强酸如硫酸代替盐酸 (14 北京)(1)排除 SO2 对 CO2 测定的干 扰(2)吸收 CO2 前后吸收瓶的质量 (15 四川)dbaec 2、(1)液柱高度保持不变;防止倒吸; NaOH(2)2:1 (3)c 控制滴加硫酸的速度 溶液变澄 清(或混浊消失);a、d (4)取少量产品溶于足量稀盐酸,静置, 取上层清液(或过滤,取滤液),滴加 BaCl2 溶液,若出现沉淀则说明含有 Na2SO4 杂质。 (2014 四川)(1)过滤,用蒸馏水洗涤沉 淀,向沉淀中加入足量稀 HCl (2)先向 A 中烧瓶滴加浓 H2SO4,产生 的气体将装置中空气排尽后,再向 C 中烧瓶 加入 Na2S 和 Na2CO3 混合溶液。 (3)重结晶 (2014 天津) (1)使硫粉易于分散到溶液中 (2)Na2SO4 取少量产品溶于过量盐酸,过 滤,向滤液中加 BaCl2 溶液,若有白色沉淀, 则产品中含有 Na2SO4 (3)S2O32-+2H+===S↓+SO2↑+H2O (4)由无色变蓝色 (5)18.10 3.62×10-3M/W×100% (6)S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ (2012 福建)(4)a、e (5)取少量 Na2S2O5 晶体于试管中,加适 量水溶解,滴加足量盐酸,振荡,再滴入氯 化钡溶液,有白色沉淀生成 3(1)无明显现象、有白色沉淀生成 (2)SO2 溶于水后生成 H2SO3; 3SO2+2NO3 -+2H2O=3SO42-+4H++2NO (3) 实验步骤 实验现象 结论 实验 1:作为参考实验 假设二 成立 实验 3:将纯净的 SO2 气 体通入未经脱 O2 处理的 25mL0.1mol/L 的 BaCl2 溶液中 有白色沉 淀生成 (4)小于,反应的离子方程式表明,足量的 O2 和 NO3 -分别氧化相同的 H2SO3,生成的 H+的物质的量前者多余后者 4(1)2Ag++SO32— = Ag2SO3↓ (2)①有红色固体生成; ②a.盐酸、BaCl2 溶液。 b.沉淀 A 是 BaSO4,由 SO32- 氧化得来;SO32- 是被 Cu2+与 KI 溶液反应生成的 I2 氧化。 (3)①Al3+、OH- ②a. b. V1 明显大于 V2 (4)亚硫酸盐的溶解性、氧化还原性、在 水溶液中的酸碱性;两种盐溶液中阴、阳离 子的性质和反应条件查看更多