- 2021-05-13 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考总复习 物质的组成分类
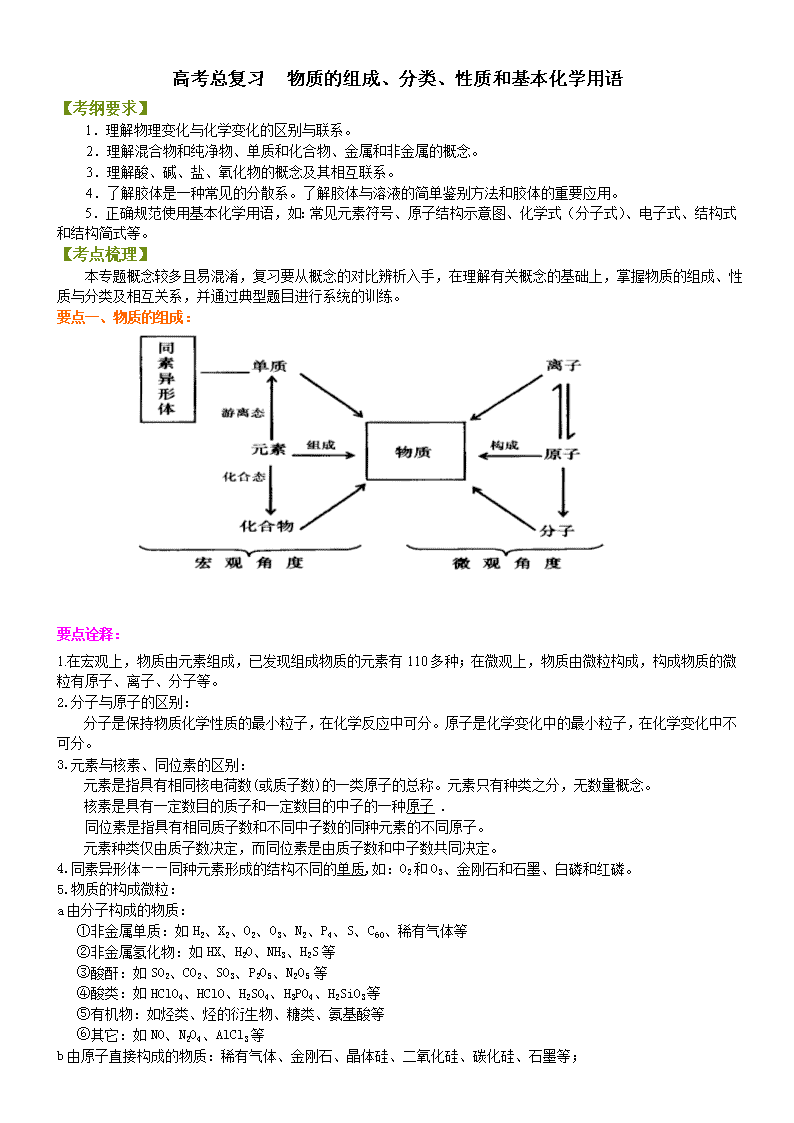
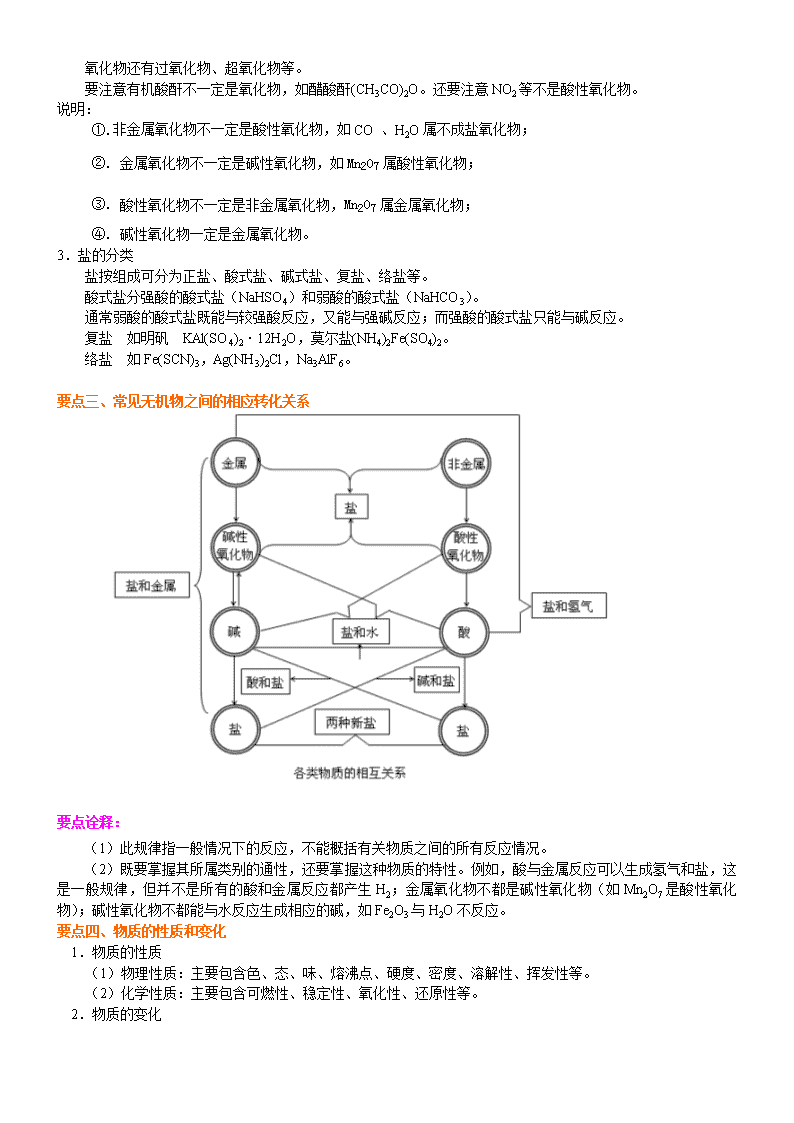
高考总复习 物质的组成、分类、性质和基本化学用语 【考纲要求】 1.理解物理变化与化学变化的区别与联系。 2.理解混合物和纯净物、单质和化合物、金属和非金属的概念。 3.理解酸、碱、盐、氧化物的概念及其相互联系。 4.了解胶体是一种常见的分散系。了解胶体与溶液的简单鉴别方法和胶体的重要应用。 5.正确规范使用基本化学用语,如:常见元素符号、原子结构示意图、化学式(分子式)、电子式、结构式 和结构简式等。 【考点梳理】 本专题概念较多且易混淆,复习要从概念的对比辨析入手,在理解有关概念的基础上,掌握物质的组成、性 质与分类及相互关系,并通过典型题目进行系统的训练。 要点一、物质的组成: 要点诠释: 1.在宏观上,物质由元素组成,已发现组成物质的元素有 110 多种;在微观上,物质由微粒构成,构成物质的微 粒有原子、离子、分子等。 2.分子与原子的区别: 分子是保持物质化学性质的最小粒子,在化学反应中可分。原子是化学变化中的最小粒子,在化学变化中不 可分。 3.元素与核素、同位素的区别: 元素是指具有相同核电荷数(或质子数)的一类原子的总称。元素只有种类之分,无数量概念。 核素是具有一定数目的质子和一定数目的中子的一种原子 . 同位素是指具有相同质子数和不同中子数的同种元素的不同原子。 元素种类仅由质子数决定,而同位素是由质子数和中子数共同决定。 4.同素异形体——同种元素形成的结构不同的单质,如:O2 和 O3、金刚石和石墨、白磷和红磷。 5.物质的构成微粒: a 由分子构成的物质: ①非金属单质:如 H2、X2、O2、O3、N2、P4、S、C60、稀有气体等 ②非金属氢化物:如 HX、H2O、NH3、H2S 等 ③酸酐:如 SO2、CO2、SO3、P2O5、N2O5 等 ④酸类:如 HClO4、HClO、H2SO4、H3PO4、H2SiO3 等 ⑤有机物:如烃类、烃的衍生物、糖类、氨基酸等 ⑥其它:如 NO、N2O4、AlCl3 等 b 由原子直接构成的物质:稀有气体、金刚石、晶体硅、二氧化硅、碳化硅、石墨等; c 由阴阳离子构成的物质:绝大多数盐、强碱、低价金属氧化物。 d 由阳离子和自由电子构成的物质:金属单质 要点二、物质的分类: 1.分类的主要原则 (1)每次分类必须按同一个标准进行,不要犯分类重叠或分类过宽的错误,尤其是在连续分类的过程中, 如不遵守这一规则,将会使分类陷于极度的混乱之中。 (2)分类的子项应当互不相容。把母项分为若干个子项,各子项必须是全异关系,不允许出现交叉或从属 关系,如果两个子项之间不是全异关系,就会出现一些事物既属于这个子项又属于那个子项的现象,这样的分类, 会引起混乱。 (3)各子项之和必须等于母项。 2.根据组成和性质对物质的分类(树状分类法) 要点诠释: 1.混合物与纯净物的区别 混合物由不同种物质组成,它没有固定的组成,没有固定的熔、沸点。由同种元素构成的物质不一定是纯净 物,例如:同素异形体,如由 O2 和 O3 组成的混合物,由白磷、红磷组成的混合物。具有相同组成的物质(如最 简式、分子式相同)也不一定是纯净物。因此,不能仅由化学式来判断是否是纯净物,要充分考虑其结构,要考 虑同素异形体或同分异构体。 2.氧化物分类的依据 氧化物有不同的分类方法。从组成元素分,分为金属氧化物,如 CuO、Al2O3;非金属氧化物,如 CO、CO2。 按氧化物的性质,通常分酸性氧化物、碱性氧化物和两性氧化物。 凡是只能与碱反应生成盐和水的氧化物为酸性氧化物,即酸酐。多数非金属氧化物、金属高价态氧化物(如 Mn2O7、CrO3)都属于酸性氧化物。 凡是只能与酸反应生成盐和水的氧化物称为碱性氧化物。碱性氧化物一定是金属氧化物。 既能与酸反应,又能与碱反应生成盐和水的氧化物称为两性氧化物,如 Al2O3 等。 金属单质(Na、Cu、Fe 等) 非金属单质(S、N2、Cl2 等)单质 酸性氧化物(SO2、CO2 等) 碱性氧化物(Na2O、MgO、K2O 等) 两性氧化物(Al2O3 等) 不成盐氧化物(CO、NO 等) 氧化物 含氧酸(HNO3、H2SO4 等) 无氧酸(HCl、HI 等)按酸根 一元酸(HCl、HNO3 等) 二元酸(H2SO4、H2CO3 等) 多元酸(H3PO4 等) 按电离出的 H+数 酸 强碱(NaOH、KOH 等) 弱碱 [NH3·H2O、Fe(OH)3 等]按强弱 一元碱(NaOH、KOH 等) 二元碱 [Ba(OH)2、Ca(OH)2 等] 多元碱 [Fe(OH)3 等] 按电离出的 OH-数 碱 正盐(Na2CO3、Na2SO4 等) 酸式盐(NaHCO3、NaHSO4 等) 碱式盐 [Cu2(OH)2CO3 等] 盐 无 机 化 合 物 有机物(见有机部分) 化 合 物 纯 净 物 溶液(NaCl 溶液、KNO3 溶液等) 悬浊液(泥水混合物)、乳浊液(油水混合物) 胶体[Fe(OH)3 胶体、AgI 胶体等] 混合物 物 质 氧化物还有过氧化物、超氧化物等。 要注意有机酸酐不一定是氧化物,如醋酸酐(CH3CO)2O。还要注意 NO2 等不是酸性氧化物。 说明: ①.非金属氧化物不一定是酸性氧化物,如 CO 、H2O 属不成盐氧化物; ②. 金属氧化物不一定是碱性氧化物,如 Mn2O7 属酸性氧化物; ③. 酸性氧化物不一定是非金属氧化物,Mn2O7 属金属氧化物; ④. 碱性氧化物一定是金属氧化物。 3.盐的分类 盐按组成可分为正盐、酸式盐、碱式盐、复盐、络盐等。 酸式盐分强酸的酸式盐(NaHSO4)和弱酸的酸式盐(NaHCO3)。 通常弱酸的酸式盐既能与较强酸反应,又能与强碱反应;而强酸的酸式盐只能与碱反应。 复盐 如明矾 KAl(SO4)2·12H2O,莫尔盐(NH4)2Fe(SO4)2。 络盐 如 Fe(SCN)3,Ag(NH3)2Cl,Na3AlF6。 要点三、常见无机物之间的相应转化关系 要点诠释: (1)此规律指一般情况下的反应,不能概括有关物质之间的所有反应情况。 (2)既要掌握其所属类别的通性,还要掌握这种物质的特性。例如,酸与金属反应可以生成氢气和盐,这 是一般规律,但并不是所有的酸和金属反应都产生 H2;金属氧化物不都是碱性氧化物(如 Mn2O7 是酸性氧化 物);碱性氧化物不都能与水反应生成相应的碱,如 Fe2O3 与 H2O 不反应。 要点四、物质的性质和变化 1.物质的性质 (1)物理性质:主要包含色、态、味、熔沸点、硬度、密度、溶解性、挥发性等。 (2)化学性质:主要包含可燃性、稳定性、氧化性、还原性等。 2.物质的变化 变化 比较 物理变化 化学变化 特征 没有新物质生成 有新物质生成 实质 构成物质的粒子间隔发生变化 物质的组成、结构发生变化,有旧键断裂、新键生成。 关系 化学变化中一定伴随着物理变化同时发生,但物理变化过程不一定有化学变化 三馏 ①蒸馏 ②分馏 干馏 四色 焰色反应 ①显色反应 ②颜色反应 ③指示剂变色反应 七解 ①溶解 ②潮解 ①分解 ②电解 ③水解 ④裂解 ⑤降解 二十一化 ①熔化 ②汽化 ③液化 ④酸化 ①氢化 ②氧化 ③水化 ④风化 ⑤炭化 ⑥钝化 ⑦催化 ⑧皂化 ⑨歧化 ⑩卤化 ⑾硝化 ⑿酯化 ⒀裂化 ⒁(油脂)硬化 ⒂磺化 ⒃硫化 ⒄老化 3.基本化学用语:(限于篇幅,只列出复习要点,请读者自己落实) (1).元素符号(熟记各主族元素、0 族元素符号名称) (2).原子、离子结构示意图(前 20 号元素元素离子、原子结构示意图) (3).电子式: ①原子和单质:Na、Mg、Al、Cl、O、N、C、Cl2、N2、H2 ②阳离子:Na+、Mg2+、Al3+、H3O+、NH4+ ③阴离子:Cl-、O2-、S2-、OH-、O22-、NH2- ④离子化合物的电子式:NaCl、K2S、NaOH、Na2O2、NH4Cl、Ca(OH)2、MgCl2 ⑤共价化合物的电子式:HCl、H2O、NH3、CH4、H2O2、CO2、CS2、CH3OH、CCl4、CH3Cl、C2H4、C2H2 ⑥有机官能团的电子式:羟基、甲基、氨基、醛基 ⑦用电子式表示物质的形成过程:离子化合物、共价化合物的形成过程。 (4).化学式、分子式 (5).结构式、结构简式、实验式(最简式) (6).化学方程式、离子方程式 (7).电离方程式 : NH3·H2O、CH3COOH、H2O、Al(OH)3、NaHCO3、NaHSO4。 (8).热化学方程式 (9). 电极方程式:①铜锌原电池(H2SO4 作电解质溶液);②钢铁的析氢腐蚀;③钢铁的吸氧腐蚀;④铅蓄 电池;⑤氢氧燃料电池。 完成下表,填写化学用语: 名称 乙醇 乙烯 分子式 C2H6O C2H4 化学式 C2H6O C2H4 化 学 用 语 最简式 C2H6O CH2 结构式 结构简式 CH3CH2OH CH2= CH2 电子式 【典型例题】 类型一:物质的组成 【例 1】某物质经分析知道它仅含一种元素,则该物质不可能是 A.混合物 B.化合物 C.纯净物 D.单质 【思路点拨】同素异形体是由同种元素组成的不同单质。 【答案】B 【解析】仅含一种元素的物质,可能是单质,是单质必为纯净物;也可能是混合物,比如金刚石、石墨混合在一 起。 【总结升华】考查物质的组成、分类的基本概念。 举一反三: 【变式 1】下列各组物质均由分子组成的是 A.金刚石、氨气、氧气 B.二氧化碳、二氧化硅、二氧化硫 C.空气、冰、碘蒸气 D.液氯、液氨、熔化的食盐 【答案】C 【解析】本题考查的是典型物质的微观组成。A 中的金刚石是由原子构成的单质,B 中的二氧化硅是由原子构成 的共价化合物,D 中的食盐是由离子构成的离子化合物。 【变式 2】由两种原子组成的纯净物 ( ) A. 一定是化合物 B. 可能是化合物或单质 C. 一定是单质 D. 一定是同素异形体 【答案】B 【解析】由元素与同位素的概念可知,题目所给两种原子可为同一种元素,也可为不同种元素。本题主要考查学 生对物质的组成、同素异形体、同分异构体、混合物和纯净物、单质和化合物等概念的理解 类型二:化学物质的分类 【例 2】(2016 北京八中)分类是重要的科学研究方法,下列物质分类不正确的是 ∙∙∙∙∙∙∙( ) A. 电解质:明矾、一水合氨、硫酸钡 B. 酸性氧化物:CO2、SO2、NO2、SiO2 C. 混合物:铝热剂、矿泉水、水玻璃、漂白粉 D. 同素异形体:C60、C70、金刚石 【思路点拨】A 项,电解质是水溶液中或熔融状态下能导电的化合物;B 项,酸性氧 化物:能与水作用生成相应 价态的酸,或与碱作用生成盐和水,或与碱性氧化物反应生成盐的氧化物;C 项,混合物是不同物质组成的物质; D 项,依据同素异形体概念是同种元素组成的不同单质分析判断。 【解析】A 项,明矾和硫酸钡是盐,一水合氨是碱,均属于电解质,故 A 正确; B 项,CO2、SO2、SiO2 属于 酸性氧化物:NO2 为不成盐氧化物,故 B 错误;C 项, 铝热剂是铝和金属氧化物的混合物、矿泉水是电解质的 水溶液属于混合物、水玻璃是硅酸钠的水溶液属于混合物、漂白粉主要成分为氯化钙和次氯酸钙,属于混合物, 故 C 正确;D 项,C60、C70、金刚石都是碳元素组成的纯净物属于单质,结构不同,物理性质不同属于同素异形 体,故 D 正确;故选 B。 【总结升华】本题考查了化学概念和物质分类的分析判断,掌握实质是解题关键,题目较简单。 举一反三: 【高清课堂:物质的组成、分类、性质和基本化学用语 例 4】 【变式 1】非金属氧化物采用不同的分类方法可分为不同的类别,从某种意义将 N2O5、SO3、CO2、Cl2O7 等归为 一类。则下列氧化物与它们属于同一类的是( ) A.CO B.NO2 C.SO2 D.NO 【答案】C 【变式 2】下列有关物质分类或归类正确的一组是( ) ①液氨、液氯、干冰、碘化银均为化合物 ②氢氟酸、盐酸、水玻璃、氨水均为混合物 ③明矾、小苏打、醋酸、次氯酸均为电解质 ④碘酒、牛奶、豆浆、漂粉精均为胶体 ⑤Na2O2、Na2CO3、NaHCO3、Na2SiO3 均为钠盐 A.①和② B.②和③ C.③和④ D.②③⑤ 【答案】B 【变式 3】用如图表示的一些物质或概念间的从属关系中不正确的是( ) X Y Z A 氧化物 化合物 纯净物 B 电解质 离子化合物 化合物 C 胶体 分散系 混合物 D 碱性氧化物 金属氧化物 氧化物 【答案】B 【例 3】下列说法正确的是 A.酸酐不一定是氧化物 B.酸性氧化物一定不和酸反应 C.能和水反应生成酸的氧化物必为酸性氧化物 D.不能和酸反应的氧化物一定能和碱反应 【思路点拨】酸性氧化物必须含两种元素。酸性氧化物是能与碱反应生成盐和水的氧化物,酸性氧化物包括一些 非金属氧化物和高价的金属氧化物,如三氧化铬 CrO3、七氧化二锰 Mn2O7 等。 简单含氧酸脱水生成的酸性氧化 物称为酸酐,如硫酸脱水生成的三氧化硫称硫酐;两分子乙酸 分子间脱水生成乙酸酐。 【答案】A 【解析】乙酸酐 不是氧化物,所以 A 正确。酸性氧化物 SiO2 可以和 HF 反应,所以 B 错。NO2 和水反 应生成 HNO3,但 NO2 不是酸性氧化物,所以 C 错。CO、NO 等不成盐氧化物与酸、与碱均不反应,所以 D 错。 【总结升华】本题考查对氧化物概念的深刻理解,注意解题时采用反证法以及事物的一般性和特殊性的关系。 举一反三: 【变式】下列关于氧化物的各项叙述正确的是( ) ①酸性氧化物肯定是非金属氧化物 ②非金属氧化物肯定是酸性氧化物 ③碱性氧化物肯定是金属氧化物 ④ 金属氧化物都是碱性氧化物 ⑤酸性氧化物均可与水反应生成相应的酸 ⑥与水反应生成酸的氧化物不一定是酸 酐,与水反应生成碱的氧化物不一定是碱性氧化物 ⑦不能跟酸反应的氧化物一定能跟碱反应 A.①②③④ B.⑤⑥⑦ C.②③⑥⑦ D.③⑥ 【答案】D 类型三:物质的性质和变化 【例 4】下列变化一定属于化学变化的是________。 ①导电 ②爆炸 ③缓慢氧化 ④品红褪色 ⑤无水硫酸铜变蓝 ⑥工业制氧气 ⑦白磷转化为红磷 ⑧久 置浓硝酸变黄 ⑨煤干馏 ⑩从煤焦油中提取苯和苯的同系物 ⑾溴水中滴入 CCl4,振荡后褪色 ⑿制肥皂后 期加入氯化钠得肥皂 ⒀加热氯化铵固体,在试管上部又出现白色晶体 ⒁纯碱晶体风化 ⒂渗析 ⒃明矾净水 ⒄硬水软化 ⒅生物固氮⒆电镀 【思路点拨】凡是有新物质生成的变化均是化学变化,从物质结构角度化学变化中有旧的化学键断裂同时有新的 化学键生成。 【答案】③⑤⑦⑧⑨⒀⒁⒃⒄⒅⒆ 【解析】①导电分为自由电子导电和自由离子导电,前者是物理变化,后者是化学变化;②爆炸有轮胎爆炸、黑 火药爆炸等类型,前者属于物理变化,后者因瞬间化学反应产生大量气体,体积迅速膨胀而引起爆炸,属于化学 变化;③缓慢氧化也属于化学变化;④SO2 使品红褪色属于化学变化、活性炭吸附使品红褪色属于物理变化;⑤ 无水硫酸铜吸水变蓝,生成新的纯净物 CuSO4·5H2O,是化学变化;⑥工业制氧是分离液态空气法;⑦白磷转化 为红磷,有结构改变的同素异形体的转化,是化学变化;⑧久置硝酸变黄是因为硝酸分解出 NO2 所致;⑨煤干馏, 是隔绝空气加强热使之分解的过程,是化学变化;⑩提取苯及其同系物是利用沸点不同分馏,是物理变化;⑾溴 水中滴入 CCl4,振荡后褪色原理为萃取,是物理变化;⑿制肥皂后期加入氯化钠得肥皂是盐析,是溶解度降低所 致,是物理变化;⒀加热氯化铵固体,在试管上部又出现白色晶体,是氯化铵固体受热分解成氨气和氯化氢,在 试管上部遇冷又反应生成氯化铵固体,属于化学变化;⒁风化是结晶水合物自然失去结晶水的过程,是化学变化; ⒂渗析是由于微粒半径有差异利用半透膜分离,是物理变化;⒃明矾净水是由于铝离子水解生成的氢氧化铝胶体 吸附悬浮颗粒,铝离子水解是化学变化;⒄⒅⒆硬水软化、生物固氮、电镀都是化学变化。 【总结升华】本题考查物质的化学变化,考纲要求是理解层次。 举一反三: 【变式 1】下列说法正确的是( )。 ①有化学键破坏的变化一定属于化学变化 ②发生了颜色变化的一定是化学变化 ③有气泡产生或固体析出 的变化一定是化学变化 ④用糯米、酒曲和水酿制成甜酒,一定是化学变化 ⑤用鸡蛋壳膜和蒸馏水除去淀粉胶 体中的食盐不涉及化学变化 A.①②③④ B.④⑤ C.①③⑤ D.全部 【答案】B 【变式 2】下列家庭小实验中不涉及化学变化的是( ) A.用熟苹果催熟青香蕉 B.用少量食醋除去水壶中的水垢 C.用糯米、酒曲和水制成甜酒酿 D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 【答案】D 【解析】A 项熟苹果释放出乙烯,乙烯催熟青香蕉的过程有新物质生成;B 项,有 Mg(OH) 2+2CH3COOH→ (CH3COO)2Mg+2H2O、CaCO3+2CH3COOH→(CH3COO)2Ca+H2O+CO2↑反应发生;C 项,酿酒过程主要涉及淀粉→ 麦芽糖→葡萄糖→乙醇的转化;D 项,利用渗析的方法可将胶体和溶液进行分离,属于物理分离方法。 【变式 3】(2015 重庆高考)中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( ) A.用胆矾炼铜 B.用铁矿石炼铁 C.烧结粘土制陶瓷 D.打磨磁石制指南针 【解析】A.胆矾的化学式为 CuSO4·5H2O,由 CuSO4·5H2O→Cu,有新物质生成,属于化学反应,故 A 正 确;B.Fe2O3→Fe,有新物质生成,属于化学反应,故 B 正确;C.制陶瓷的原料是粘土,发生化学变化生 成硅酸盐产品,故 C 正确;D.打磨磁石制指南针,只是改变物质的外形,没有新物质生成,不涉及化学反 应,故 D 错误。故选 D。 类型四:各类物质间的相互关系一-无机反应规律 【例 5】下列反应能一步完成的是 A.Fe2O3 Fe(OH)3 B.CuO Cu(OH)2 C.CaCO3 Ca(OH)2 D.Na2CO3 NaOH 【思路点拨】要酸碱盐的溶解性入手分析,难溶碱对应的碱性氧化物不能与水反应。 【答案】D 【解析】Fe2O3 、CuO 与水都不反应;CaCO3 难溶,不与碱反应;Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH 【总结升华】要注意复习巩固初中化学有关酸碱盐氧化物之间的相互关系。 举一反三: 【变式 1】请选择尽可能多的途径制备 NaCl: 【答案】请参考以下七种方法: ①金属+非金属:2Na+Cl2=2NaCl ②酸+碱:HCl+NaOH=NaCl+H2O ③盐+盐:Na2CO3+CaCl2=2NaCl+CaCO3↓ ④酸+盐:Na2CO3+2HCl=2NaCl+H2O+CO2↑ ⑤碱+盐:2NaOH+MgCl2=Mg(OH)2↓+2NaCl ⑥碱性氧化物+酸:Na2O+2HCl=2NaCl+H2O ⑦金属+酸:2Na+2HCl=2NaCl+H2↑ 上述练习主要是针对无机反应规律的,在书写时注意思维有序,注意建立对立统一规律的意识。 【变式 2】写出 5 个有 CO2 生成,且符合下列要求的化学方程式: (1)一种盐分解________ ; (2)一种金属氧化物跟单质反应________ ; (3)一种非金属氧化物跟单质反应________ ; (4)两种氧化物反应________ ; (5)一种盐跟一种酸反应________ 。 【答案】(1)CaCO3 CaO+CO2↑ (2)2CuO+C 2Cu+CO2↑ (3)2CO+O2 2CO2 (4)CuO+CO Cu+CO2 (5)CaCO3+2HCl==CaCl2+H2O+CO2↑(其他正确答案也可) 类型五:化学用语 【例 6】(2016 四川广安)下列关于化学用语的表示正确的是 A.过氧化钠的电子式: B.质子数为 35、中子数为 45 的溴原子 C.硫离子的结构示意图: 高温 高温 高温 △ 80 35 Br 2 8 6+16 D.间二甲苯的结构简式: 【思路点拨】离子化合物的电子式应标电荷。元素符号的左下角代表质子数,左上角代表质量数。 【答案】B 【解析】过氧化钠的电子式应为 ;硫离子的最外层应为 8 个电子;间二甲苯的两个甲基应 处于间位。 【总结升华】化学用语不规范是造成失分的常见现象,要重视化学用语的复习,准确使用各种化学用语。 举一反三: 【变式 1】下列化学用语正确的是( ) A.钙离子的电子式 Ca2+ B.甲基的电子式 C.原子核内有 8 个中子的碳原子 14C D.乙烷的分子式 CH3CH3 【答案】A 【变式 2】下列化学用语正确的是( ) A.硫的原子结构示意图: B.顺-2-丁烯的结构简式: C.乙酸的实验式:C2H4O2 D.原子核内有 8 个中子的氧原子: 【答案】B 【巩固练习】 一、选择题:(每题只有一个选项符合题意) 1.(2015 海南高考)化学与生活密切相关。下列应用中利用了物质氧化性的是 A.明矾净化水 B.纯碱去油污 C.食醋除水垢 D.漂白粉漂白织物 2. (2016 四川高考)化学与生产和生活密切相关,下列过程中没有发生化学变化的是( ) A.氯气作水的杀菌消毒剂 B.硅胶作袋装食品的干燥剂 C.二氧化硫作纸浆的漂白剂 D.肥皂水作蚊虫叮咬处的清洗剂 3. 对于下列反应的反应类型的判断,不正确的是 ( ) A.CO2+H2O=H2CO3 化合反应 B.Cu(OH)2ΔCuO+H2O 分解反应 C.Fe2O3+3CO 高温 2Fe+3CO2 置换反应 D.NaCl+AgNO3=AgCl↓+NaNO3 复分解反应 4.下列叙述中正确的是 A.酸酐一定是酸性氧化物 B.碱性氧化物一定是金属氧化物 C.金属氧化物一定是碱性氧化物 D.非金属氧化物一定是酸性氧化物 5. (2016•东城二模)下列生活中常见的过程或现象不属于化学变化的是 18 8 O C H H H +16 2 8 8 A.天然气燃烧 B.自然界中丁达尔效应 C.蛋白质受热凝固 D.食醋除水垢 6. 下列各组物质按酸、碱、盐分类次序排列正确的是 ( ) A.硫酸、纯碱、石膏 B.氢氟酸、熟石灰、明矾 C.原硅酸、石英、小苏打 D.高锰酸、烧碱、尿素 7.物质分类的依据通常有组成和性质,下列物质分类中,只考虑组成的是 ( ) A. Na2SO4 是钠盐、硫酸盐、正盐 B. HNO3 是一元酸、强酸、挥发性酸 C. Mg(OH)2 是二元碱、难溶性碱、中强碱 D. Al2O3 是两性氧化物、金属氧化物、最高价氧化物 8.下列叙述正确的是( ) A.含有共价键的化合物不一定是共价化合物 B.混合物中的元素一定是以化合态的形式存在 C.金属氧化物一定是碱性氧化物 D.由一种元素组成的物质一定是纯净物 9.(2015 江苏模拟) 下列有关化学用语表达不正确的是 ( ) A.二氧化碳的结构式:O=C=O B.S2-的离子结构示意图: C.氯化氢分子的电子式: D.R2+离子核外有 a 个电子,b 个中子,R 原子表示为: R 10.下列说法正确的是( ) A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 B.氯气、硫酸钡和水分别属于非电解质、强电解质和弱电解质 C.Mg、Al、Cu 可以分别用置换法、直接加热法和电解法冶炼得到 D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 11.下表关于物质分类的正确组合 2 2 ++ + ba a H [:Cl:]+ − +16 2 8 8 12.下列有关说法中正确的是 A.16O、17O、18O 属于同位素 B.N60 和 N2 互为同系物 C.O2 和 O3、H2 和 D2、H O 和 H O 都互为同素异形体 D.CH2O2、C2H4O2、C3H6O2、C4H8O2 互为同系物,乙二醇、丙三醇、苯甲醇也互为同系物 13.下列各组物质分类正确的是( )。 酸 碱 盐 氧化物 A 硫酸 纯碱 石膏 铁红 B 氢硫酸 烧碱 纯碱 生石灰 C 碳酸 熟石膏 小苏打 二氧化碳 D 二氧化碳 苛性钾 食盐 石灰石 14.(2015 四川南通模拟)下列物质分类正确的是 A.SO2、SiO2、CO 均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体 C.烧碱、冰醋酸、四氯化碳均为电解质 D.福尔马林、水玻璃、氨水均为混合物 15.下列变化一定属于化学变化的是( ) ①导电 ②爆炸 ③缓慢氧化 ④SO2 使品红褪色 ⑤无水硫酸铜由白变蓝 ⑥工业制 O2 ⑦白磷转化为红 磷 ⑧久置的浓硝酸变黄 A.②③④⑦⑧ B.③④⑤⑦⑧ C.②③⑥⑦ D.④⑤⑦⑧ 16.(2016•海淀一模)下在 2015 年 9 月 3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进 行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后 的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( ) A.“彩雾”是一种混合物 B.上述过程中有物理变化 C.燃料燃烧产生的热量促使拉烟剂气化 D.“彩雾”的形成与焰色反应的原理相同 18 2 16 2 分类 组合 碱 酸 盐 碱性氧化物 酸性氧化物 A Na2CO3 H2SO4 NaHCO3 SiO2 CO2 B NaOH HCl NaCl Na2O CO C NaOH CH3COOH MgCl2 Na2O2 SO2 D KOH HNO3 CaCO3 CaO SO3 17.下列说法正确的是 ( ) A.明矾净水过程中不涉及化学变化 B.由同种元素组成的物质一定是纯净物 C.风化、石油分馏和碘的升华都是物理变化 D.在化学反应中,反应前后原子种类、数目和质量一定不变 18. 化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是 ( ) A.用食醋除去水壶内的水垢:CaCO3+2H+ = Ca2++CO2↑+H2O B.纯碱溶液呈碱性的原因是:CO32—+2H2O H2CO3+2OH— C. 钢铁发生吸氧腐蚀的正极反应式:O 2+ 4e- +2H2O =4OH— D.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)= 2H2O(1);△H = -571.6 KJ·mol-1 二、填空题: 19.从铁、盐酸、氧气、水、硝酸银溶液 5 种物质中选出 1 种或 2 种为反应物,按下列反应类型各写 1 个化学方 程式。 (1)化合反应________________。 (2)分解反应________________。 (3)置换反应(有气体放出)________________。 (4)复分解反应________________。 【参考答案与解析】 一、选择题: 1. D 【解析】A.明矾净水是明矾电离产生的 Al3+发生水解产生了 Al(OH)3 胶体的吸附作用,与物质的氧化性无关, 故 A 错误; B.纯碱去油污是利用纯碱水解显碱性,油脂在碱性条件下发生水解反应产生可溶性的物质,与物质的氧化 性无关,故 B 错误; C.食醋除水垢,是利用醋酸的酸性比碳酸强,与物质的氧化性无关,故 C 错误 ; D.漂白粉的有效成分是 Ca(ClO)2,该物质与水发生反应产生 HClO,有强的氧化性,可以将织物的色素氧化 为无色物质,故 D 正确。故选 D。 2. B 【解析】A 项,Cl2+H2O HClO+HCl,生成的 HClO 具有强氧化性,可对水进行杀菌消毒;B 项,硅胶仅起到 吸水干燥的作用,不涉及化学变化;C 项,SO2 可对纸浆进行漂白,这个过程涉及化学变化;D 项,被蚊虫叮咬 会产生蚁酸 HCOOH,肥皂水显碱性,涂抹肥皂水发生酸碱中和,可清洗叮咬处。故选 B。 3. C 【解析】紧扣四种基本反应类型的概念,可作出选择。但 C 选项是一个容易出错的选项,因为它貌似一个置换 反应。 4. B 【解析】酸酐是含氧酸失水后的产物。如:乙酸的酸酐为(CH3CO)2O,可见酸酐不一是氧化物;碱性氧化物和金 属氧化物,非金属氧化物和酸性氧化物是不同分类原则指导下的不同分类,它们可能相容、相交、相对。如:在 金属氧化物中,Al2O3 是两性氧化物,Mn2O7(HMnO4 的酸酐) 为酸性氧化物,可见金属氧化物不一定是碱性氧化 物,非金属氧化物中,CO、NO 等属不成盐氧化物。 本题是在物质分类本质理解透彻基础上再加实例验证的分析、对比、判断试题。 5. B 【解析】A 项,天然气主要成分为甲烷,甲烷燃烧生成了二氧化碳和水,反应的方程式是:CH4+2O2 CO2+2H2O,有新物质生成,属于化学变化,故 A 错误;B 项,丁达尔效应为胶体独有的性质,指光照射胶体, 在垂直光的传播方向有一条光亮的通路,没有新物质生成,属于物理变化,故 B 正确;C 项,蛋白质受热凝固属 于蛋白质变性,性质不同于原物质,有新物质生成,属于化学变化,故 C 错误;D 项,食醋中的醋酸能和水垢 中的碳酸钙反应生成醋酸钙、水和二氧化碳,属于化学变化,故 D 错误。故选 B。 6. B 【解析】A 纯碱不是碱是盐;C、石英是二氧化硅属于氧化物;D、尿素属于有机物。本题考查酸、碱、盐的定 义及其对定义的理解。 7. A 【解析】A 项都是根据其组成而划分的,;B 项根据组成分为一元酸,而依据不同性质可分为强酸和挥发性酸; C 中的难溶性碱、中强碱是根据其不同性质划分的;D Al2O3 依据不同性质可分别属于两性氧化物、最高价氧化 物。 8.A 【解析】NH4Cl 含有共价键,但是离子化合物,故 A 正确;由同素异形体组成的混合物,元素以游离态存在, 故 B 不正确;Al2O3、Mn2O7 都是金属氧化物,但 Al2O3 是两性氧化物,Mn2O7 是酸性氧化物,故 C 不正确;由 同素异形体如:O2 和 O3、金刚石和石墨等组成物质是混合物,D 不正确。 9. C 【解析】氯化氢为共价化合物,其电子式不应标电荷,应为 。 10.D 【解析】纯碱属于盐,A 项错;氯气是单质,不属于非电解质,B 错;Mg、Al 都是活泼金属,应用电解熔融 MgCl2、熔融 Al2O3 方法获得,而 Cu 一般用还原法制得,C 项错。 11.D 12A 13. B 【解析】纯碱属于盐类物质,熟石膏属于盐类物质,二氧化碳属于酸性氧化物,石灰石属于碳酸盐。 14. D 【解析】A.CO 不属于酸性氧化物;B.氯化铁溶液不是胶体;C.四氯化碳不是电解质;D.福尔马林、水玻 璃、氨水均为混合物。 15. B 【解析】③缓慢氧化是物质发生了氧化反应。④SO2 使品红褪色,是品红与 SO2 气体发生反应生成了一种新物 质。⑤无水硫酸铜由白变蓝是其结合水生成了蓝矾。⑦白磷转化为红磷,红磷是一种新单质。⑧浓硝酸久置分解 出 NO2,NO2 又溶解在 HNO3 中,使得硝酸变黄。以上变化都有新物质生成,属于化学变化。 16. D 【解析】A 项,由于“彩雾”中包括水蒸气和气化后的彩色拉烟剂,所以“彩雾”是混合物;B 项,由于“彩雾”形成 过程是高温气体中的水蒸气与气化后的拉烟剂遇冷凝结形成的,所以是物理变化;C 项,飞机燃料燃烧产热使得 拉烟剂气化,所以 C 正确;D 项,“彩雾”的形成过程显色是拉烟剂的原因,与焰色反应无关,所以 D 错误。故 选 D。 17.D →点燃 H :Cl: 18.C 二、填空题: 19.(1)3Fe+2O2 Fe3O4 (2)2H2O 2H2↑+O2↑ (3)Fe+2HCl==FeCl2+H2↑ (4)AgNO3+HCl==AgCl↓+HNO3 【解析】Fe 与 O2 反应生成 Fe3O4 是化合反应;水分解生成 H2 和 O2 属于分解反应;Fe 与盐酸的反应为置换反应; AgNO3 与盐酸的反应属于复分解反应。 点燃 通电查看更多