- 2021-05-13 发布 |
- 37.5 KB |
- 3页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学选修三典型晶体结构的特点分析
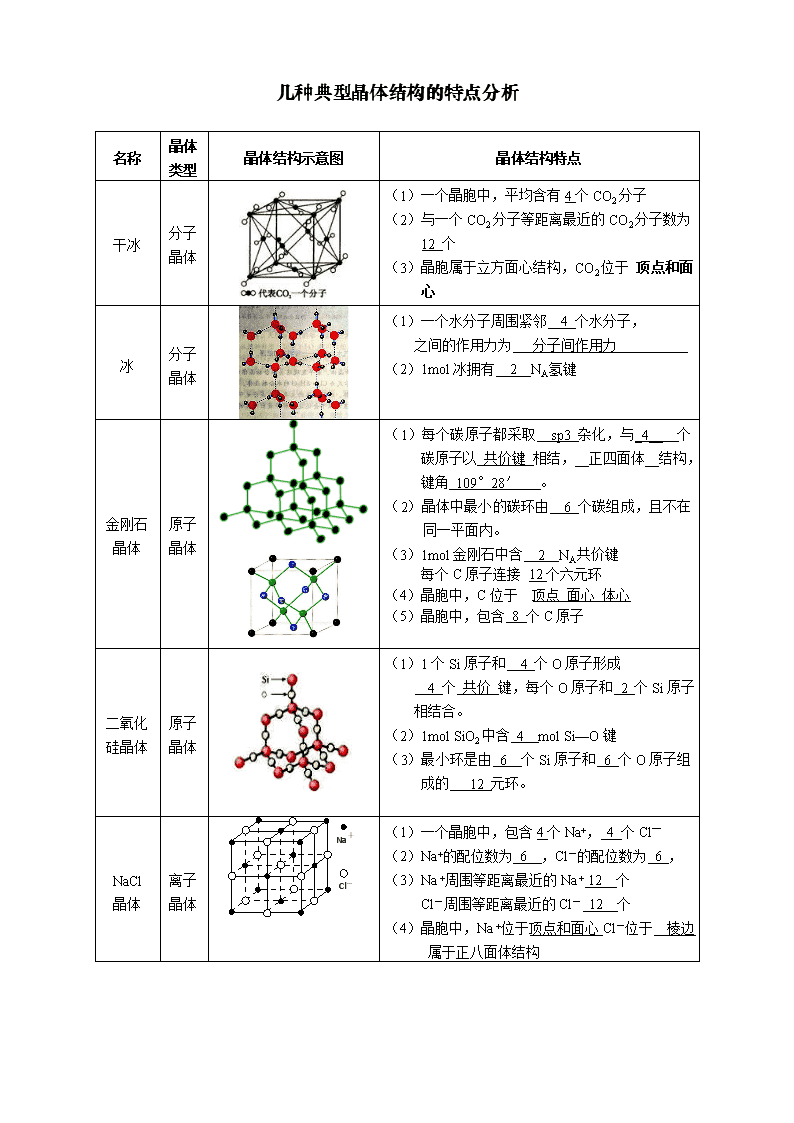
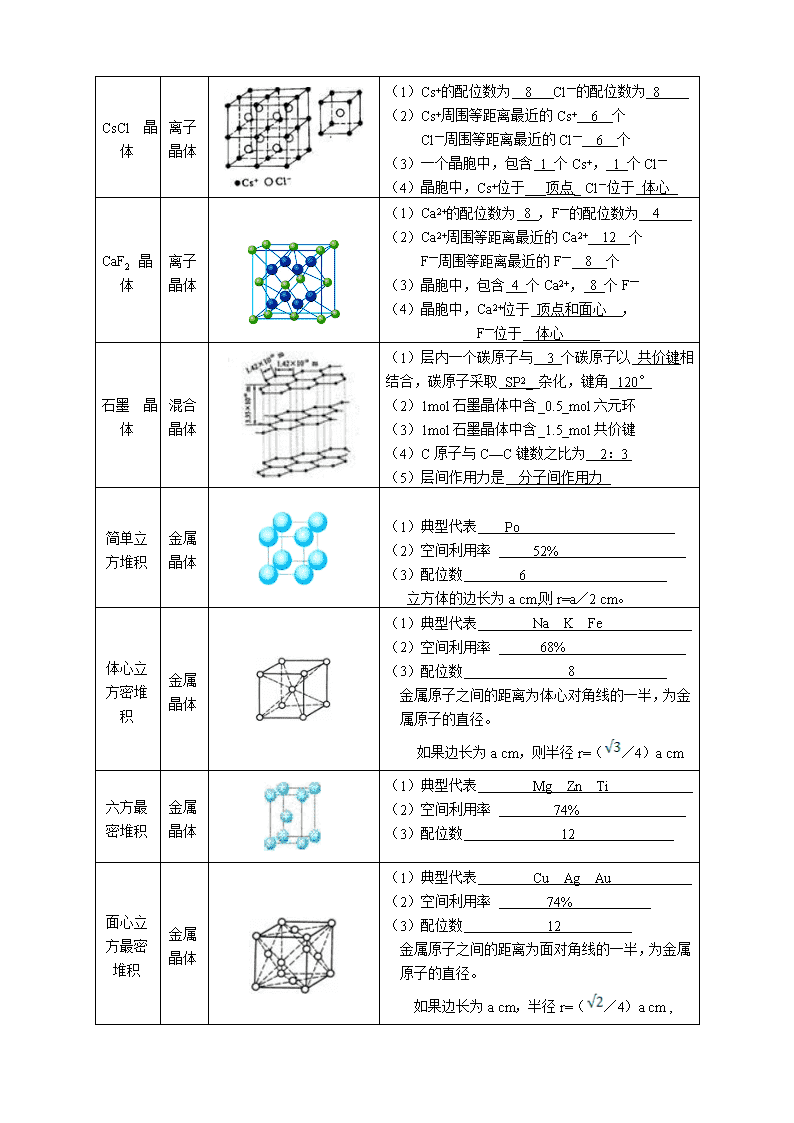
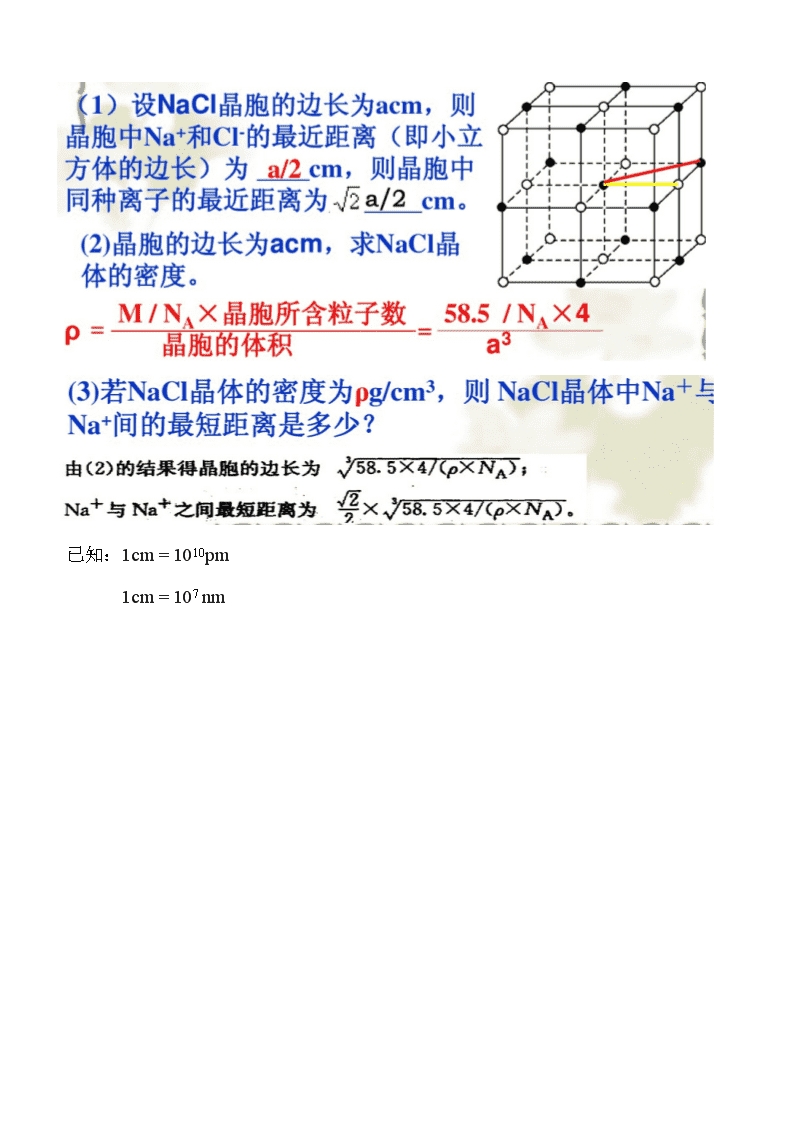
几种典型晶体结构的特点分析 名称 晶体类型 晶体结构示意图 晶体结构特点 干冰 分子晶体 (1)一个晶胞中,平均含有4个CO2分子 (2)与一个CO2分子等距离最近的CO2分子数为 12 个 (3)晶胞属于立方面心结构,CO2位于 顶点和面心 冰 分子晶体 (1)一个水分子周围紧邻 4 个水分子, 之间的作用力为 分子间作用力 (2)1mol冰拥有 2 NA氢键 金刚石 晶体 原子晶体 (1)每个碳原子都采取 sp3 杂化,与_4__ 个碳原子以 共价键 相结,__正四面体__结构,键角 109°28′ 。 (2)晶体中最小的碳环由 6 个碳组成,且不在同一平面内。 (3)1mol金刚石中含 2 NA共价键 每个C原子连接 12个六元环 (4)晶胞中,C位于 顶点 面心 体心 (5)晶胞中,包含 8 个C原子 二氧化硅晶体 原子晶体 (1)1个Si原子和 4 个O原子形成 4 个 共价 键,每个O原子和 2 个Si原子相结合。 (2)1mol SiO2中含 4 mol Si—O键 (3)最小环是由 6 个Si原子和 6 个O原子组成的 12 元环。 NaCl 晶体 离子晶体 Na+ Cl- (1)一个晶胞中,包含4个Na+, 4 个Cl— (2)Na+的配位数为 6 ,Cl-的配位数为 6 , (3)Na +周围等距离最近的Na + 12 个 Cl-周围等距离最近的Cl- 12 个 (4)晶胞中,Na +位于顶点和面心Cl-位于 棱边 属于正八面体结构 CsCl 晶体 离子晶体 (1)Cs+的配位数为 8 Cl—的配位数为 8 (2)Cs+周围等距离最近的Cs+ 6 个 Cl—周围等距离最近的Cl— 6 个 (3)一个晶胞中,包含 1 个Cs+, 1 个Cl— (4)晶胞中,Cs+位于___顶点_ Cl-位于 体心 CaF2 晶体 离子晶体 (1)Ca2+的配位数为 8 ,F—的配位数为 4 (2)Ca2+周围等距离最近的Ca2+ 12 个 F—周围等距离最近的F— 8 个 (3)晶胞中,包含 4 个Ca2+, 8 个F— (4)晶胞中,Ca2+位于 顶点和面心__, F—位于__体心_____ 石墨 晶体 混合晶体 (1)层内一个碳原子与 3 个碳原子以 共价键相结合,碳原子采取 SP2_ 杂化,键角 120° (2)1mol石墨晶体中含_0.5_mol六元环 (3)1mol石墨晶体中含_1.5_mol共价键 (4)C原子与C—C键数之比为 2:3 (5)层间作用力是 分子间作用力 简单立方堆积 金属晶体 (1)典型代表 Po (2)空间利用率 52% (3)配位数 6 立方体的边长为a cm,则r=a/2 cm。 体心立方密堆积 金属晶体 (1)典型代表 Na K Fe (2)空间利用率 68% (3)配位数 8 金属原子之间的距离为体心对角线的一半,为金属原子的直径。 如果边长为a cm,则半径r=(/4)a cm 六方最密堆积 金属晶体 (1)典型代表 Mg Zn Ti (2)空间利用率 74% (3)配位数 12 面心立方最密堆积 金属晶体 (1)典型代表 Cu Ag Au (2)空间利用率 74% (3)配位数 12 金属原子之间的距离为面对角线的一半,为金属原子的直径。 如果边长为a cm,半径r=(/4)a cm , 已知:1cm = 1010pm 1cm = 107 nm查看更多