- 2021-05-13 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2014高考专题三 水溶液中的电离平衡 难溶电解质的溶解平衡
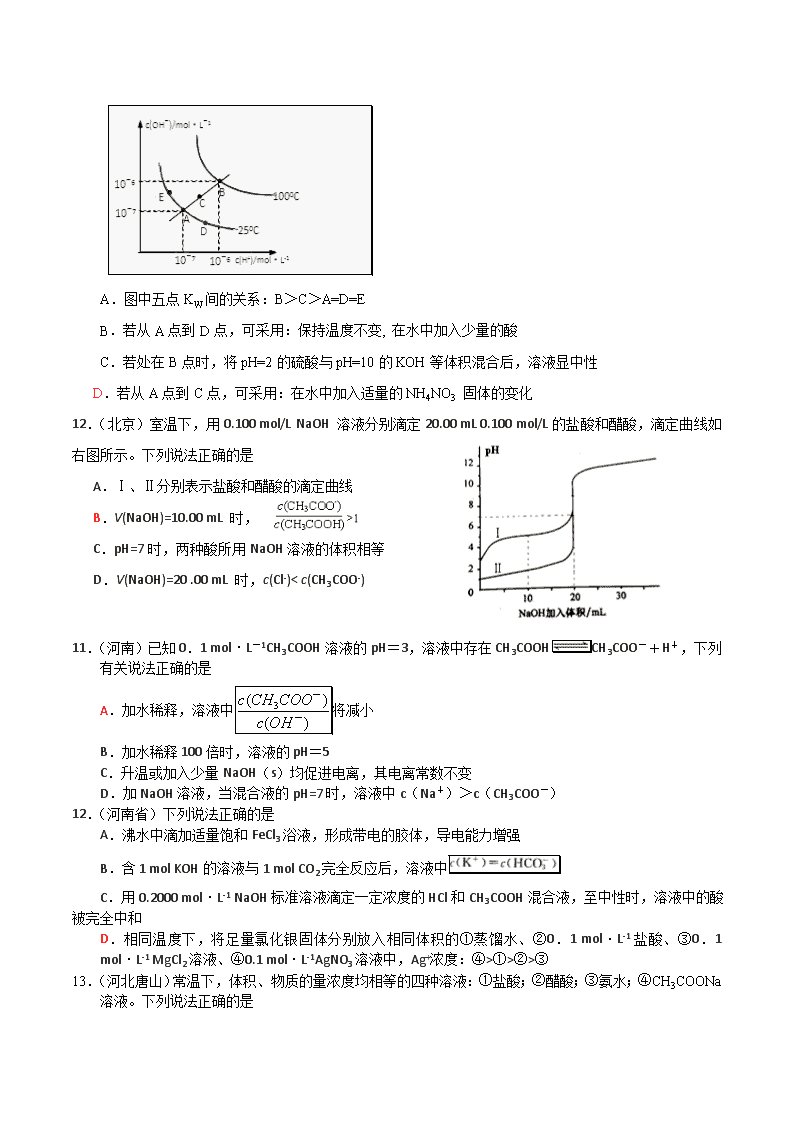
2013年全国高考模拟题分类汇总 专题三:水溶液中的电离平衡 难溶电解质的溶解平衡 5.(天津)归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下) ① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。 ② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。 ③在Na2CO3和NaHCO3溶液中均存在下列关系 c(Na+)+c(H+)=c(OH-)+c(HCO3 )+2c(CO32-) ④ 反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0 ⑤ 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw ⑥ 反应A(g)2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能 为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是 A.①②③⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤ 6. (天津)一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据 物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp/25℃ 8.0×10-16 2.2×10-20 4.0×10-38 完全沉淀时的PH值 ≥9.6 ≥6.4 3~4 对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是 A. 向该溶液中加少量铁粉不能观察到红色固体析出 B. 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 C. 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 D. 向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液 28、(衡水中学))工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为: 已知: (1)步骤①中存在平衡:2Cr O42—(黄色)+2H+Cr2O72—(橙色)+H2O (2)步骤③生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)Cr3+(aq)+3OH 一(aq) (3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1 时可视作该离子不存在下列有关说法中,正确的是( ) A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大 B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+Cr2O72—(橙色)+H2O 达到平衡状态 C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。 D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽 13、(衡水中学)从下列事实所得出的结论或给出的解释正确的是 实验事实 结论或解释 A 将40 g NaOH溶于1 L蒸馏水中 该溶液的物质的量浓度为1mol﹒L-1 B 0.1 mol/L CH3COOH溶液在稀释过程中 将变小 C 酸H2X为弱酸 常温下,盐NaHX溶液pH一定大于7 D 在溶液的稀释过程中 离子浓度:有的可能增大,有的可能减小,有的可能不变 23、(衡水中学)下列各溶液中,有关成分的物质的量浓度关系正确的是 ( ) A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合: c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) D.pH相等的(NH4)2SO4、 (NH4)2Fe (SO4)2、NH4Cl溶液: c(NH4Cl)<c[(NH4)2Fe (SO4)2]< c[(NH4)2SO4] 11、(衡水中学)将pH=3的盐酸a L 分别与下列三种溶液混合后,混合液均呈中性; ①的氨水 ②的氨水cL ③的的溶液 其中a、b、c、d的关系正确的是 A. B. C. D. 18、(衡水中学)水的电离平衡曲线如图所示,下列说法不正确的是 ( ) A.图中五点KW间的关系:B>C>A=D=E B.若从A点到D点,可采用:保持温度不变, 在水中加入少量的酸 C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 D.若从A点到C点,可采用:在水中加入适量的NH4NO3 固体的变化 12.(北京)室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如右图所示。下列说法正确的是 A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 B.V(NaOH)=10.00 mL 时, C.pH=7时,两种酸所用NaOH溶液的体积相等 D.V(NaOH)=20 .00 mL 时,c(Cl-)< c(CH3COO-) 11.(河南)已知0.1 mol·L-1CH3COOH溶液的pH=3,溶液中存在CH3COOHCH3COO-+H+,下列有关说法正确的是 A.加水稀释,溶液中将减小 B.加水稀释100倍时,溶液的pH=5 C.升温或加入少量NaOH(s)均促进电离,其电离常数不变 D.加NaOH溶液,当混合液的pH=7时,溶液中c(Na+)>c(CH3COO-) 12.(河南省)下列说法正确的是 A.沸水中滴加适量饱和FeCl3浴液,形成带电的胶体,导电能力增强 B.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中 C.用0.2000 mol·L-1 NaOH标准溶液滴定一定浓度的HCl和CH3COOH混合液,至中性时,溶液中的酸 被完全中和 D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1 MgCl2溶液、④0.1 mol·L-1AgNO3溶液中,Ag+浓度:④>①>②>③ 13.(河北唐山)常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是 A.将①与②分别稀释相同倍数后溶液的pH:①>② B.③与④中已电离的水分子的数目相等 C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O) D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)查看更多