- 2021-05-13 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东高考中山实验高中高考模拟试题理综化学部分
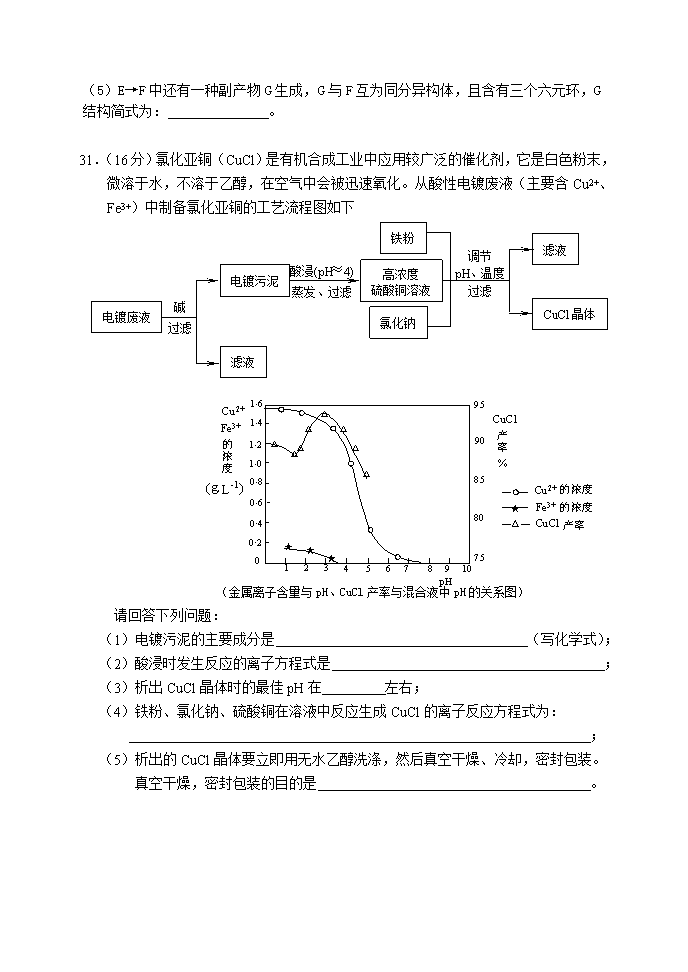
广东高考中山实验高中高考模拟试题理综化学部分 7.下列说法正确的是 A.保存硝酸银溶液用棕色细口试剂瓶,钠保存在盛有煤油的无色广口试剂瓶中 B.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 C.用玻璃棒蘸取待测液,点在湿润的pH试纸上测定其pH D.检验某溶液里是否含有Fe2+时,可先滴加新制的氯水,再滴加KSCN溶液 8.下列化学用语和描述均正确的是 A.结构示意图为 的阴离子都不能破坏水的电离平衡 B.结构简式为CH2CH2的分子可发生加成反应 C.日本核爆炸产生的13153I和12753I互为同素异形体 D.电子式分别为和的两种化合物均为常见的氧化剂 9.下列离子方程式表达正确的是 A.鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+=CO2↑+H2O B.四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+=2Fe3++Fe2++4H2O C.将氨气通入硫酸溶液中:NH3 + H+ = NH4+ D.向碳酸氢铵溶液中加入足量的NaOH溶液:NH4+ +OH-= NH3·H2O 10.A、B、C、D、E、F为原子序数依次增大的短周期元素,其中A与E同主族,B与F同主族,E与F同周期,已知常温下A、E单质的状态不同,D原子的核电荷数是B原子最外层电子数的2倍,F单质是一种重要的半导体材料。下列说法正确的是 A.原子半径由大到小的顺序是: B.由A、C、D三种元素组成的化合物中可能含有离子键 C.F、C、B元素最高价氧化物对应的水化物的酸性依次增强 D.F与D形成的化合物质地坚硬,既不与酸反应也不与碱反应 11.下列关于有机物的叙述正确的是 A.石油液化气、汽油和石蜡的主要成分都是碳氢化合物 B.1,2-二氯乙烷在NaOH水溶液中发生消去反应得到乙炔 C.由CH2=CHCOOCH3合成的聚合物为 D.能与NaOH溶液反应且分子式为C2H402的有机物一定是羧酸 12.设NA为阿伏加德罗常数。下列说法中正确的是 A.1molNH4+中含有10NA个质子 B.t℃时,1LpH=6的纯水中,含1×10-6 NA个OH- C.78gNa2O2中含阴离子的数目为2 NA D.向FeI2溶液中通入适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为1 NA 22.镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。 其中一种镁电池的反应原理为: 下列说法正确的是 A.放电时,Mo3S4发生氧化反应 B.放电时,正极反应式:Mo3S4+2xe-→Mo3S42x- C.充电时,Mg2+向阴极迁移 D.充电时,阳极反应式:xMg2++2xe-→xMg 23.关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是 A.取等体积的两种溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸少 D.两种酸溶液中c(CH3COO-)=c(Cl-) 30.(16分)吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如下: (1)化合物A的分子式是 ,1molA最多能与 H2发生反应 (2)反应类型:B→C (3)D中含氧官能团有: (写名称)。 (4)化合物E能发生的反应类型是 A、加成反应 B、酯化反应 C、水解反应 D、加聚反应 (5)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六元环,G 结构简式为: 。w ww.k s5u. co m 31.(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下 电镀废液 电镀污泥 高浓度 硫酸铜溶液 氯化钠 铁粉 滤液 CuCl晶体 滤液 碱 过滤 酸浸(pH≈4) 蒸发、过滤 调节 pH、温度 过滤 pH (金属离子含量与pH、CuCl产率与混合液中pH的关系图) 请回答下列问题: (1)电镀污泥的主要成分是 (写化学式); (2)酸浸时发生反应的离子方程式是 ; (3)析出CuCl晶体时的最佳pH在 左右; (4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为: ; (5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。 32.甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。 (1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应: CH4(g)+H2O(g)CO(g)+3H2(g)……Ⅰ, CH4的转化率与温度、压强的关系如右图。 ①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。 ②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 _。 ③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。 (2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) ……Ⅱ。 ④该反应的△H 0,△S 0(填“<”、“>”或“=”)。 ⑤若容器容积不变,下列措施可增加甲醇产率的是 。 A.升高温度 B.将CH3OH(g)从体系中分离 C.再充入1mol CO和3mol H2 D.充入He,使体系总压强增大 33.(16分)已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。 限选的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。 (一)初步探究 取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。 (1)①写出产生无色气泡的离子方程式 ②上述实验可以得到的初步结论是 。 (二)进一步探究 (2)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。 实验操作 预期现象和结论 7.A 8. D.9.C.10. B 11.A. 12. B.22.BC.23.AD. 30.(16分 答案:C9H10O2,(3分)4mol(3分),取代反应(2分),羧基,羰基,醚键(3分) AB(2分) (3分) 31. (1)Cu(OH)2 Fe(OH)3 (3 分) (2)Cu(OH)2+2H+= Cu2++2H2O(3分) (3)3(3分)(4)2Cu2++2Cl―+ Fe=2CuCl↓+ Fe2+ (3分) (5)加快乙醇和水的蒸发,防止CuCl被空气氧化 (4分) 32(1)①0.0030mol·L-1·min-1(3分,单位1分) ②<(3分) 2.25×10-4(2分) ③减小(2分) (2)④< <(各2分共4分) ⑤BC(2分) 33. (16分) (1)①略(2分) ②该混合物中肯定含有NH4HCO3(2分),肯定不含CuSO4(2分)。 (2) 实验操作 预期现象和结论 取少许溶液B于试管中,滴入少量Ba(NO3)2溶液。(2分) 如果产生白色沉淀,说明原固体混合物中含有K2SO4;(1分)如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,而含有NaCl或NH4Cl。(1分) 若固体混合物不含K2SO4,取少量原固体混合物于试管底部,将试管套入试管夹,充分加热试管。(2分) 如果试管底部有固体残留,说明混合物中含有NaCl;(2分)如果试管底部无固体残留,说明混合物中含有NH4Cl;(2分) (其它合理答案同样给分)查看更多