- 2021-05-13 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考真题——化学海南卷解析版
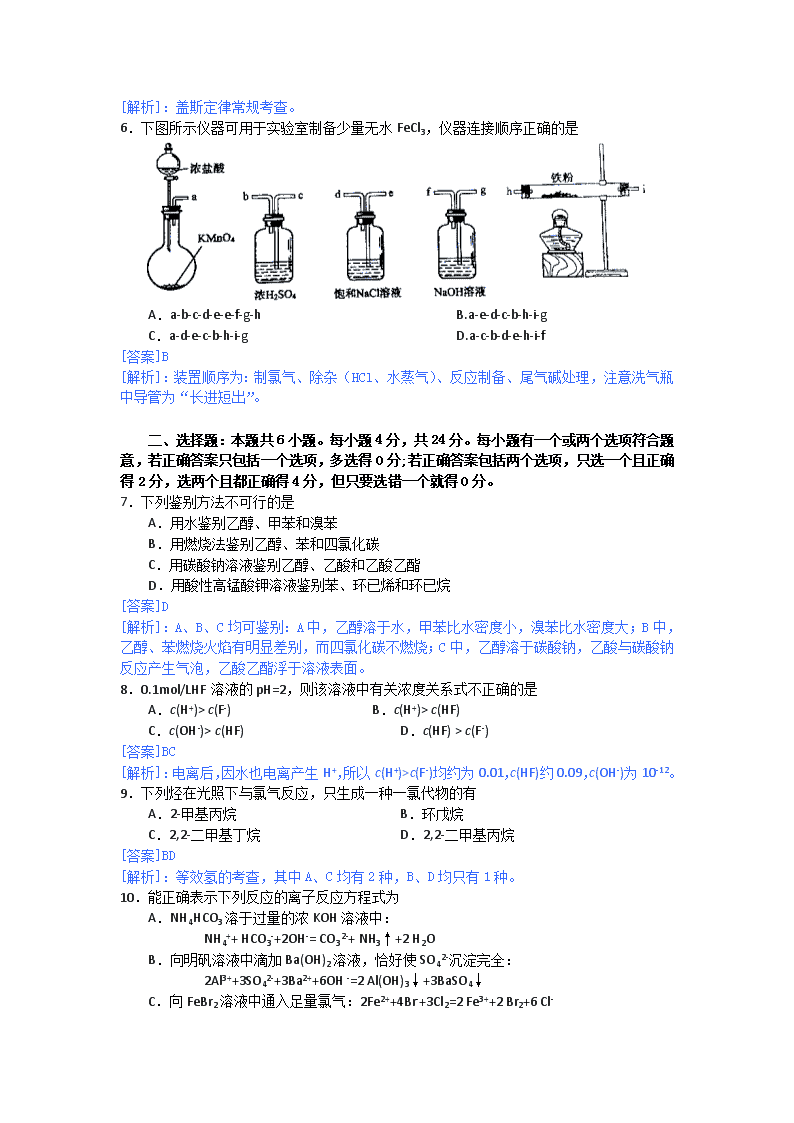
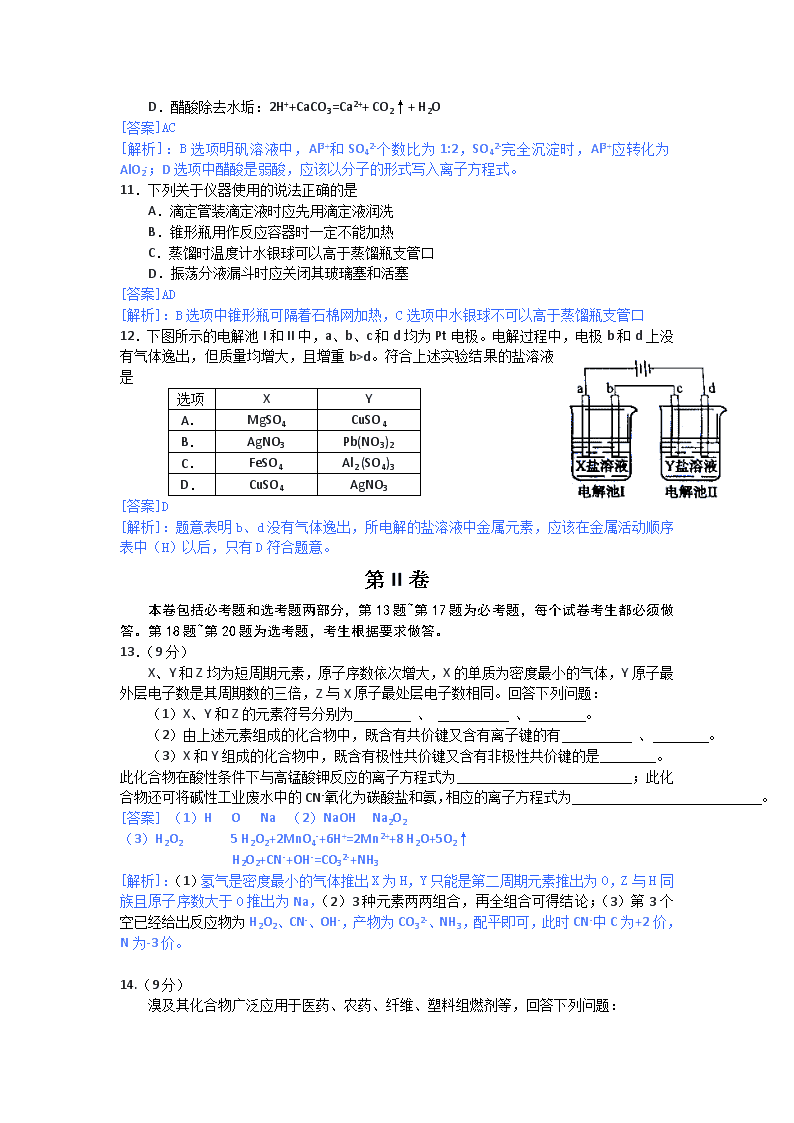
2013年海南省高考化学科试题答案及解析(word版) 可能用到的相对原子质量: H1 C12 O16 Na23 Mg24 Al27 S32 Cl35.5 K39 Fe56 Cu64 Ag108 Ba137 Pb207 第I卷 一、选择题:本题共6小题。每小题2分,共12分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.下列有机化合物中沸点最高的是 A.乙烷 B.乙烯 C.乙醇 D.乙酸 [答案]D [解析]:四项中,C、D两项为液态,沸点明显要高,但学生只注意了乙醇的氢键,易失误。 2.下列化合物的俗称与化学式不对应的是 A.绿矾-FeSO4·7H2O B.芒硝-Na2SO4·10H2O C.明矾- Al2(SO4)3·12H2O D.胆矾- CuSO4·5H2O [答案]C [解析]:对常见物质俗称识记。 3.重水(D2O)是重要的核工业原料,下列说法错误的是 A.氘(D)原子核外有1个电子 B.1H与D互称同位素 C.H2O与D2O互称同素异形体 D.1H18O与D216O的相对分子质量相同 [答案]C [解析]:同位素是同种元素不同种原子间互称。 4.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为: 2AgCl+ Mg = Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是 A.Mg为电池的正极 B.负极反应为AgCl+e-=Ag+Cl- C.不能被KCl 溶液激活 D.可用于海上应急照明供电 [答案]D [解析]:根据氧化还原判断,Mg为还原剂是负极、失电子,所以A、B都错,C是指电解质溶液可用KCl 溶液代替。 5.已知下列反应的热化学方程式: 6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1 2 H2(g)+ O2(g)= 2H2O(g) △H2 C(s)+ O2(g)=CO2(g) △H3 则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为 A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3 C.12△H3-5△H2 -2△H1 D.△H1-5△H2-12△H3 [答案]A [解析]:盖斯定律常规考查。 6.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是 A.a-b-c-d-e-e-f-g-h B.a-e-d-c-b-h-i-g C.a-d-e-c-b-h-i-g D.a-c-b-d-e-h-i-f [答案]B [解析]:装置顺序为:制氯气、除杂(HCl、水蒸气)、反应制备、尾气碱处理,注意洗气瓶中导管为“长进短出”。 二、选择题:本题共6小题。每小题4分,共24分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。 7.下列鉴别方法不可行的是 A.用水鉴别乙醇、甲苯和溴苯 B.用燃烧法鉴别乙醇、苯和四氯化碳 C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 D.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷 [答案]D [解析]:A、B、C均可鉴别:A中,乙醇溶于水,甲苯比水密度小,溴苯比水密度大;B中,乙醇、苯燃烧火焰有明显差别,而四氯化碳不燃烧;C中,乙醇溶于碳酸钠,乙酸与碳酸钠反应产生气泡,乙酸乙酯浮于溶液表面。 8.0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是 A.c(H+)> c(F-) B.c(H+)> c(HF) C.c(OH-)> c(HF) D.c(HF) > c(F-) [答案]BC [解析]:电离后,因水也电离产生H+,所以c(H+)>c(F-)均约为0.01,c(HF)约0.09,c(OH-)为10-12。 9.下列烃在光照下与氯气反应,只生成一种一氯代物的有 A.2-甲基丙烷 B.环戊烷 C.2,2-二甲基丁烷 D.2,2-二甲基丙烷 [答案]BD [解析]:等效氢的考查,其中A、C均有2种,B、D均只有1种。 10.能正确表示下列反应的离子反应方程式为 A.NH4HCO3溶于过量的浓KOH溶液中: NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: 2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl- D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O [答案]AC [解析]:B选项明矾溶液中,Al3+和SO42-个数比为1:2,SO42-完全沉淀时,Al3+应转化为AlO2-;D选项中醋酸是弱酸,应该以分子的形式写入离子方程式。 11.下列关于仪器使用的说法正确的是 A.滴定管装滴定液时应先用滴定液润洗 B.锥形瓶用作反应容器时一定不能加热 C.蒸馏时温度计水银球可以高于蒸馏瓶支管口 D.振荡分液漏斗时应关闭其玻璃塞和活塞 [答案]AD [解析]:B选项中锥形瓶可隔着石棉网加热,C选项中水银球不可以高于蒸馏瓶支管口 12.下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是 选项 X Y A. MgSO4 CuSO4 B. AgNO3 Pb(NO3)2 C. FeSO4 Al2 (SO4)3 D. CuSO4 AgNO3 [答案]D [解析]:题意表明b、d没有气体逸出,所电解的盐溶液中金属元素,应该在金属活动顺序表中(H)以后,只有D符合题意。 第II卷 本卷包括必考题和选考题两部分,第13题~第17题为必考题,每个试卷考生都必须做答。第18题~第20题为选考题,考生根据要求做答。 13.(9分) X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最处层电子数相同。回答下列问题: (1)X、Y和Z的元素符号分别为 、 、 。 (2)由上述元素组成的化合物中,既含有共价键又含有离子键的有 、 。 (3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 。 此化合物在酸性条件下与高锰酸钾反应的离子方程式为 ;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。 [答案] (1)H O Na (2)NaOH Na2O2 (3)H2O2 5 H2O2+2MnO4-+6H+=2Mn2++8 H2O+5O2↑ H2O2+CN-+OH-=CO32-+NH3 [解析]:(1)氢气是密度最小的气体推出X为H,Y只能是第二周期元素推出为O,Z与H同族且原子序数大于O推出为Na,(2)3种元素两两组合,再全组合可得结论;(3)第3个空已经给出反应物为H2O2、CN-、OH-,产物为CO32-、NH3,配平即可,此时CN-中C为+2价,N为-3价。 14.(9分) 溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题: (1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。 (2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。 (3)CuBr2分解的热化学方程式为: 2CuBr2(s)=2 CuBr(s)+ Br2(g) △H=+105.4kJ/mol 在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。 ①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。 ②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。 [答案] (1)Cl2 3 Br2+6 CO32-+3H2O=5 Br-+ BrO3-+6HCO3- (或3 Br2+3CO32-=5 Br-+ BrO3-+3CO2) (2)Br BrCl+H2O=HCl+ HBrO (3)①增大 ②2.33×103Pa< p(Br2)≤4.66×103Pa [解析]:(1)溴在碳酸钠溶液的歧化可把反应理解为,溴与水发生歧化,产生H+的被碳酸钠吸收。 (2)正电性的原子或原子团结合OH形成分子,则生成HBrO。(3)①升高温度,平衡向吸热反应方向移动,因而可提高p(Br2);②体积增大一倍时,p(Br2)降为原来的一半,即2.33×103Pa,减压使平衡向气体体积数增大的方向移动,因而会大于2.33×103Pa;若反应物足量,可平衡恢复到原有的p(Br2)。 15.(9分) 反应A(g) B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题: (1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于”或“等于”) (2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则: ①平衡时体系总的物质的量为 。 ②反应的平衡常数K= 。 ③反应在0~5min区间的平均反应速率v(A)= 。 [答案] (1)小于 小于 (2)①0.085mol ②0.082mol/L ③0.007mol/(L·min) [解析]:(1)图中显示,T2时达到平衡所用时间少,速率大所以温度高;而温度越高c(A)越小,可判断反应为吸热反应,升温K将增大。(2)平衡问题的常规计算,略。 16.(8分) 2-丁烯是石油裂解的产物之一,回答下列问题: (1)在催化剂作用下,2-丁烯与氢气反应的化学方程式为 ,反应类型为 。 (2)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 ;A分子中能够共平面的碳原子个数为 ,A与溴的四氯化碳溶液反应的化学方程式为 。 [答案] (1)CH3CH=CHCH3+H2CH3CH2CH2CH3 加成反应 (2) [解析]:(2)A加氢后不生成正丁烷,可判断其碳链有支链,结构只能是一种,4个碳原子均在碳碳双键形成的平面上。(嵚崟感叹:第3个空形同鸡肋,考了加氢接着又考加溴的方程式?就算考个现象描述都比这强,出题人江郎才尽矣) 17.(9分) BaCl2·xH2O中结晶水数目可通过重量法来确定: ①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置; ②过滤并洗涤沉淀; ③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。 回答下列问题: (1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是 。 (2)计算BaCl2·xH2O中的x= (要求写出计算过程)。 (3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。 [答案] (1)蒸馏水 取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净。 (2)样品中BaCl2的物质的量为 质量 (3)偏高 [解析]:(1)若沉淀洗涤后洗涤液中不含Cl-则已经洗净,这是沉淀洗涤的常用方法;(2)计算氯化钡和水的物质的量比,即求出x;(3)题中已经表明硫酸钡被还原为BaS,则沉淀质量减小,相对水的质量比提高,x数据将偏高。 选考题(请考生在请18.19.20三题中任选一题作答,如果多做,则按所做的第一题计分。作答时用2B铅笔在答题卡上把所选题目的题号涂黑。) 第18.19.20三题的第一题为选择题,在给出的四个选项中,至少有两项是符合题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第二题为非选择题,请在答题卡上相应位置作答并写明小题号。 18.[选修5——有机化学基础](20分) 18-I(6分)下列化合物中,同分异构体数目超过7个的有 A.已烷 B.已烯 C.1,2-二溴丙烷 D.乙酸乙酯 [答案]BD [解析]:同分异构体常规考查。 18-II(14分) 肉桂酸异戊酯G()是一种香料,一种合成路线如下: 已知以下信息: ①; ②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。 回答下列问题: (1)A的化学名称为 。 (2)B和C反应生成D的化学方程式为 。 (3)F中含有官能团的名称为 。 (4)E和F反应生成G的化学方程式为 ,反应类型为 。 (5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为 (写结构简式)。 [答案] (1)苯甲醇 (2) (3)羟基(4) 取代反应(或酯化反应) (5)6 [解析]:(1)A的不饱和度为4含苯环,分子可能为苯甲醇或邻、间、对甲苯酚,而转化为B的条件为醇氧化,因而A为苯甲醇;(2)根据信息可得此反应为两醛缩合,结合G的结构可判断出用到了乙醛;(3)根据反应条件,E与F反应为酯化,结合G的结构,醇那部分结构就明了;(5)F的异构体不能与金属钠反应只能是醚。醚的异构体写出,以氧原子为分界:①左1个碳右4个碳(丁基),丁基有4种异构则醚有4种异构体,②左2个碳右3个碳(丙基),丙基有2种异构则醚有2种异构体,共6种。 19.[选修3——物质结构与性质](20分) 19-I(6分)下列化合物中,含有非极性共价键的离子化合物是 A.CaC2 B.N2H4 C.Na2S2 D.NH4NO3 [答案]AC [解析]:略。 19-II(14分)图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。 回答下列问题: (1)图B对应的物质名称是 ,其晶胞中的原子数为 ,晶体类型为 。 (2)d中元素的原子核外电子排布式为 。 (3)图A中由二种元素组成的物质中,沸点最高的是 ,原因是 ,该物质的分子构型为 ,中心原子的杂化轨道类型为 。 (4)图A中的双原子分子中,极性最大的分子是 。 (5)k的分子式为 ,中心原子的杂化轨道类型为 ,属于 分子(填“极性”或“非极性”)。 [答案] (1)金刚石 8 原子晶体 (2)1s22s22p63s23p5 (3)H2O 分子间形成氢键 V形(或角形) sp3 (4)HCl (5)COCl2 sp2 极性 [解析]:(1)每个原子周围有4个键,判断为金刚石。(2)a为C,则b为H2、c为O2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2。(3)除a、b、c、d外,f为CO,g为CO2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2(在历届高考中有出现过)。所有两元素形成的物质中,只有水是液态,其它都是气体。(4)所有双原子分子中,只有H、Cl电负性差值最大,因而极性最大。(5)COCl2中羰基的平面结构显示其为sp2杂化。 20.[选修2——化学与技术] (20分) 20-I(6分)下列叙述正确的是 A.合成氨的“造气”阶段会产生废气 B.电镀的酸性废液用碱中和后就可以排放 C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗 D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染 [答案]AD [解析]:A中氨的造气用天燃气或煤,必产生二氧化碳;B中电镀液含重金属离子,应处理后排放;C中,铝的生产中阳极会产生二氧化碳,煤有消耗;D中煤的气化后作了脱硫处理,污染减少。 20-II(14分)硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题: (1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。 (2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有 。 (3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: ①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。 ②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。 物质 Si SiCl4 SiHCl3 SiH2Cl2 SiH3Cl HCl SiH4 沸点/℃ 2355 57.6 31.8 8.2 -30.4 -84.9 -111.9 ③SiHCl3极易水解,其完全水解的产物为 。 (4)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。 [答案] (1)含有硅、碳的铁合金(或硅铁) (2)石英砂、纯碱和石灰石 (3)①SiO2+3CSiC+2CO↑ 金刚砂 金刚石(或单晶硅) ②精馏(或蒸馏)③H4SiO4(或H2SiO3)、H2、HCl (4)H2、HCl [解析]:大多为常见知识考查。(3)比较SiHCl3、SiCl4、SiH2Cl2、SiH3Cl的沸点,可得常温下SiHCl3、SiCl4为液体、SiH2Cl2、SiH3Cl为气体,沉降除去产物中的固体后,冷凝得到SiHCl3、SiCl4的混合液体,用蒸馏可分离二者。 查看更多