- 2021-05-13 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学三轮冲刺导学案硫及其氧化物的性质含解析
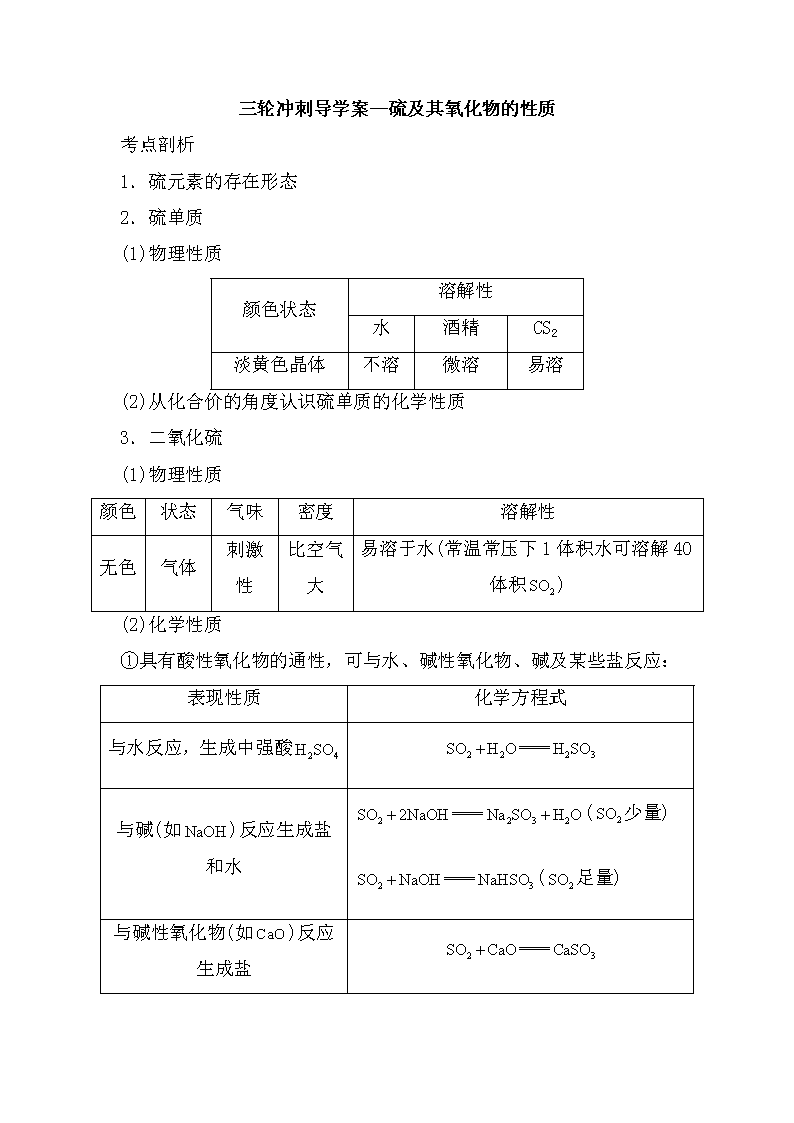
三轮冲刺导学案--硫及其氧化物的性质 考点剖析 1.硫元素的存在形态 2.硫单质 (1)物理性质 颜色状态 溶解性 水 酒精 CS2 淡黄色晶体 不溶 微溶 易溶 (2)从化合价的角度认识硫单质的化学性质 3.二氧化硫 (1)物理性质 颜色 状态 气味 密度 溶解性 无色 气体 刺激性 比空气大 易溶于水(常温常压下1体积水可溶解40体积) (2)化学性质 ①具有酸性氧化物的通性,可与水、碱性氧化物、碱及某些盐反应: 表现性质 化学方程式 与水反应,生成中强酸 与碱(如)反应生成盐和水 (少量) (足量) 与碱性氧化物(如)反应生成盐 与某些盐(如)反应生成亚硫酸盐 (少量) ②氧化性:(氧化产物和还原产物的质量比是2∶1)。 ③还原性:,还能被、、、、等氧化。 ④漂白性:能使品红溶液褪色(褪色后,加热,恢复原来颜色),能漂白某些有色物质(属于不稳定的化合漂白)。 4.三氧化硫 (1)物理性质 在标准状况下为固体,熔点为16.8℃,易挥发,极易溶于水并放出大量的热。 (2)化学性质 表现性质 方程式 与水反应,生成强酸 (工业生产硫酸) 与碱(如)反应生成盐和水 与碱性氧化物(如)反应生成盐 与某些盐(如)反应生成硫酸盐 5.污染及治理 (1)酸雨的形成 是污染大气的有害气体之一,是引发酸雨的主要污染物。空气中的与、作用生成、,随雨水降落到地面,形成酸雨,其pH小于5.6。 (2)来源及治理 ①来源:空气中的主要来自化石燃料(煤和石油)的燃烧,此外,还有含硫矿石的冶炼和硫酸、磷肥、纸浆生产等产生的工业废气。 ②治理方法:消除污染的主要方法是减少的排放,从源头进行控制。例如,硫酸厂、化工厂、冶金厂等的尾气在排放前进行处理。 类型一 硫及其化合物的转化 1.基本转化规律 (1)同种价态之间的转化 硫元素的化合价相同的物质之间的转化,属于非氧化还原反应,主要试剂是酸、碱、盐、氧化物等。 (2)不同价态之间的转化 硫元素的化合价不同的物质之间的转化,属于氧化还原反应,主要试剂是氧化剂和还原剂。 2.价态变化规律 (1)是硫元素的最低价态,只有还原性;、处于中间价态,既有氧化性,又有还原性;是硫元素的最高价态,只有氧化性。 (2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。 例如: (3)有时硫的化合价发生跳位转化。如、遇到强氧化剂时可被氧化为+6价:、。 (4)硫元素相邻价态的微粒之间不发生氧化还原反应。如S和、S和、和之间不发生氧化还原反应。 3.重要转化关系 (1)含−2价硫元素的化合物之间的转化 (2)含+6价硫元素的化合物之间的转化 (3)氧化还原反应转化关系 类型二 SO2性质的多样性 不同溶液中通入SO2的现象及解释: 溶液 石蕊试液 加有酚酞的氢氧化钠溶液 酸性KMnO4溶液 溴水 品红溶液 H2S溶液 现象 变红 褪色 褪色 褪色 褪色 生成浅黄色沉淀 SO2的性质 溶于水显酸性 溶于水显酸性 还原性 还原性 漂白性 氧化性 典例精析 常见物质的转化是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反应完成的是 A.Na→NaOH→Na2CO3→NaCl B.Al→Al2O3→Al(OH)3→AlCl3 C.Fe→Fe(NO3)3→Fe(OH)3→Fe2O3 D.S→ SO2→ SO3→ H2SO4 【答案】B 【解析】A.Na→NaOH→Na2CO3→NaCl过程中反应的化学方程式分别为:2Na+2H2O===2NaOH+H2↑、2NaOH+CO2===Na2CO3+H2O、Na2CO3+CaCl2===CaCO3↓+2NaCl,所以能一步实现,故A不选;B、由Al2O3不能直接制得Al(OH)3 ,故B合题意;C、Fe→Fe(NO3)3→Fe(OH)3→Fe2O3 中反应分别是Fe与过量的硝酸生成Fe(NO3)3,再与氢氧化钠生成Fe(OH)3,Fe(OH)3加热得Fe2O3,所以能一步实现,故C不选;D、S+O2SO2;2 SO2 + O22 SO3;SO3 + H2O === H2SO4,故D不选;故选B。 【典例3】游泳池中的水经常需要消毒。下列物质中不能用于游泳池消毒的是 A.漂白粉 B.漂白液 C.臭氧 D.SO2 【答案】D 【解析】用于游泳池消毒的物质一般具有强氧化性,A、漂白粉的有效成分是Ca(ClO)2,具有氧化性,能杀菌消毒,能用于游泳池消毒,故说法正确;B、漂白液有效成分是NaClO,具有氧化性,能杀菌消毒,能用于游泳池消毒,故说法正确;C、臭氧具有强氧化性,能用于游泳池杀菌消毒,故说法正确;D、SO2不具有强氧化性,不能用于游泳池杀菌消毒,故说法错误。 对点训练 1.下列不能使有色布条或品红溶液褪色的物质是 A.氯化钙溶液 B.氯水 C.次氯酸钠溶液 D.二氧化硫 【答案】A 【解析】A.氯化钙溶液不具有漂白性,故A选;B.氯水中含有HClO,具有漂白性,故B不选;C.次氯酸钠溶液含有ClO− ,能生成HClO,具有漂白性,故C不选;D.SO2能使品红溶液褪色,具有漂白性,故D不选;故选A。 2.①过氧化钠可用于自来水消毒;②雨水中溶解二氧化碳过多,可造成酸雨;③应严厉打击商贩用二氧化硫熏蒸银耳制作美观的“雪耳”;④ “84”消毒液(主要成分为次氯酸钠)和洁厕灵(主要成分为盐酸)不能混用。以上说法正确的是 A.①④ B.③④ C.②④ D.②③ 【答案】B 【解析】①过氧化钠与水反应生成强碱NaOH,具有腐蚀性,则不能用于自来水消毒,故错误;②雨水中溶解二氧化碳过多,为正常雨水,不会造成酸雨,故错误;③二氧化硫有毒,不能漂白食品,则严厉打击商贩用二氧化硫熏蒸银耳制作美观的“雪耳”,故正确;④“84”消毒液(主要成分为次氯酸钠)和洁厕灵(主要成分为盐酸)混合,发生氧化还原反应生成有毒气体氯气,则不能混合使用,故正确;故选B。 3.将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是 选项 操作 现象 A 加入NaOH溶液 有红褐色沉淀 B 加入Ba(NO3)2溶液 有白色沉淀 C 加入酸性KMnO4溶液 紫色褪去 D 加入K3(铁氰化钾)溶液 有蓝色沉淀 【答案】D 【解析】A.将一定量的SO2通入FeCl3溶液中,加入NaOH溶液有红褐色沉淀生成氢氧化铁沉淀,过程中没有化合价变化,不是氧化还原反应,故A错误;B.加入Ba(NO3)2溶液,有白色沉淀,硝酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,即使二氧化硫与三价铁离子不发生氧化还原反应,也可产生白色沉淀,所以不能证明SO2与FeCl3溶液发生氧化还原反应,故B错误;C.加入酸性KMnO4溶液,紫色褪去,因为二氧化硫具有还原性能够还原酸性高锰酸钾,即使二氧化硫与三价铁离子不发生氧化还原反应,也可使其溶液褪色,所以不能证明SO2与FeCl3溶液发生氧化还原反应,故C错误;D.亚铁离子加入K3(铁氰化钾)溶液生成Fe32 (蓝色沉淀),则可证明溶液中存在二价铁离子,说明SO2与FeCl3溶液发生氧化还原反应,故D正确;故选D。 4.工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂。但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25 g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,夹持仪器省略。 (1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等。 ①请完成下列表格 试剂 作用 A ________________ 验证SO2的还原性 B Na2S溶液 ________________________ C 品红溶液 ________________________ ②A中发生反应的离子方程式为_______________________。 ③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验: 方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去。该方案是否合理________。(填“是”或“否”) 方案二:往第二份试液中加入K3溶液,实验现象为____________。 ④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性。该方案的不妥之处可能为_____________。 (2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量。取50.00 mL葡萄酒样品于250 mL碘量瓶中。加入少量碎冰块,再加入1 mL淀粉指示液,10 mL硫酸溶液,用浓度为c mol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30 s不变即为终点,记下消耗碘标准滴定溶液的体积为V mL。以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Vo mL。该葡萄酒中SO2含量计算式为___g/L。 【答案】(1)①A.FeCl3溶液 B.验证SO2的氧化性 C.验证SO2的漂白性 ②2Fe3++SO2+2H2O===2Fe2++SO42−+4H+ ③否 出现特征的蓝色沉淀 ④高锰酸钾用硫酸酸化 (2) 【解析】(1)①A装置中要验证SO2的还原性,需要选择氧化剂,而备选试剂中浓硫酸和FeCl3溶液是常见氧化剂,浓硫酸不能氧化SO2,故选择FeCl3溶液;B装置中盛有Na2S溶液,是常见还原性物质,与SO2发生氧化还原反应,可验证SO2的氧化性;SO2具有漂白性,可与 C装置中的品红溶液作用,使品红褪色。综上所述, 答案为: A.FeCl3溶液 B.验证SO2的氧化性 C.验证SO2的漂白性 。 ②Fe3+和 SO2反应,根据得失电子守恒和电荷守恒还有参加反应,生成H+,离子方程式为:2Fe3++SO2+2H2O===2Fe2++SO42−+4H+ 。 ③因为通入过量的SO2,SO2会和酸性KMnO4溶液反应,使酸性KMnO4溶液褪色,故不能验证A中发生了氧化还原反应,方案一答案为:否;往第二份试液中加入K3溶液,Fe2+与K3生成特征蓝色的铁氰化亚铁沉淀,故方案二现象为:生成特征的蓝色沉淀。 ④酸性高锰酸钾溶液是用硫酸酸化的,向溶液中滴加氯化钡溶液,即使SO2没有被氧化也会产生BaSO4白色沉淀,故该方案不妥之处为:高锰酸钾用硫酸酸化。 (2)根据化学方程式:I2+SO2+2H2O===2HI+H2SO4,可得关系:I2~SO2,由题意:n(SO2)=c×(V−V0)×10−3 mol,所以该葡萄酒中SO2含量为:c×(V−V0)×10−3 mol×64 g/mol÷( 5×10−2 L)= g/L。查看更多