- 2021-05-13 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考专题复习之高中化学计算常用方法和技巧最终版
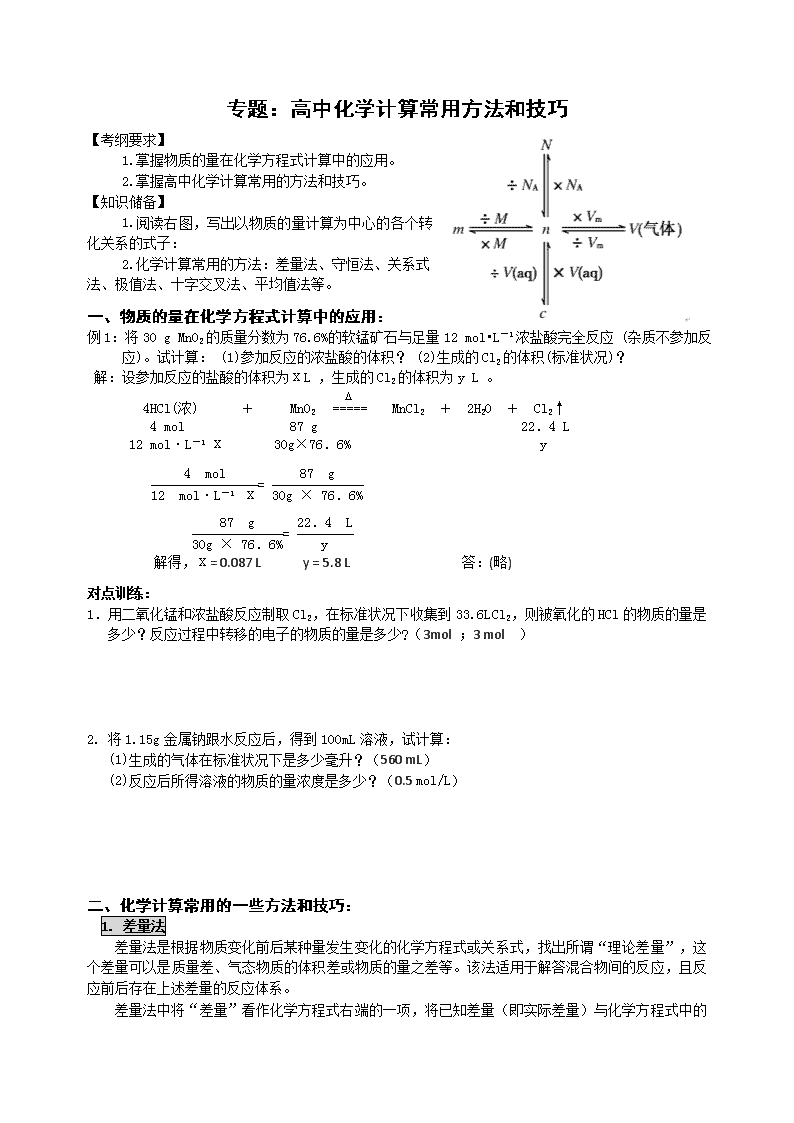
专题:高中化学计算常用方法和技巧 【考纲要求】 1.掌握物质的量在化学方程式计算中的应用。 2.掌握高中化学计算常用的方法和技巧。 【知识储备】 1.阅读右图,写出以物质的量计算为中心的各个转化关系的式子: 2.化学计算常用的方法:差量法、守恒法、关系式法、极值法、十字交叉法、平均值法等。 一、物质的量在化学方程式计算中的应用: 例1:将30 g MnO2的质量分数为76.6%的软锰矿石与足量12 mol•L-1浓盐酸完全反应 (杂质不参加反应)。试计算: (1)参加反应的浓盐酸的体积? (2)生成的Cl2的体积(标准状况)? 解:设参加反应的盐酸的体积为ⅹL ,生成的Cl2的体积为y L 。 4HCl(浓) + MnO2 MnCl2 + 2H2O + Cl2↑ 4 mol 87 g 22.4 L 12 mol·L-1 ⅹ 30g×76.6% y = = 解得,ⅹ= 0.087 L y = 5.8 L 答:(略) 对点训练: 1.用二氧化锰和浓盐酸反应制取Cl2,在标准状况下收集到33.6 L Cl2,则被氧化的HCl的物质的量是多少?反应过程中转移的电子的物质的量是多少?(3mol ;3 mol ) 2. 将1.15g金属钠跟水反应后,得到100mL溶液,试计算: (1)生成的气体在标准状况下是多少毫升?(560 mL) (2)反应后所得溶液的物质的量浓度是多少?(0.5 mol/L) 二、化学计算常用的一些方法和技巧: 1. 差量法 差量法是根据物质变化前后某种量发生变化的化学方程式或关系式,找出所谓“理论差量”,这个差量可以是质量差、气态物质的体积差或物质的量之差等。该法适用于解答混合物间的反应,且反应前后存在上述差量的反应体系。 差量法中将“差量”看作化学方程式右端的一项,将已知差量(即实际差量)与化学方程式中的对应差量(即理论差量)列成比例,其他解题步骤与按化学方程式列比例或解题完全一样。 (1)质量差量法 例1: 在含有20.6g的NaBr溶液中,通人C12后,将溶液蒸干,称量所得固体为16.5g,则参加反应的NaBr的质量为( ) A、1lg B、9.5g C、8g D、5g 解析:2NaBr+C12 ==2NaCl+Br2 固体质量减轻(△m) 2×103 2×58.5 2×(103-58.5)=89g m(NaBr) 20.6-16.5 =4.1g m(NaBr)=9.5g 答案:B。 对点训练: 1. 将碳酸钠和碳酸氢钠的混合物21.0g,加热至质量不再变化时,称得固体质量为14.8g。求混合物中碳酸钠的质量分数?(20%) 2.将10gCO2和N2的混合气体,通过装有足量Na2O2的干燥管,反应后干燥管的总质量增加了5.6g,则原混合气体中C02的质量分数为 ( ) A.32% B.44% C.56% D.88% (2)体积差量法 例2:二硫化碳(CS2液态)能够在氧气中完全燃烧生成C02和S02。今用O.228 g CS2在O.448L02(标准状况)中完全燃烧,反应后气体混合物在标准状况时的体积是多少? 解析:本题告诉了两种反应物的量,常规方法应先判断CS2和O2中,哪种是过量的。然后根据不足量的按照CS2燃烧的化学方程式,计算生成物的量,气体混合物在标准状况下的体积就可求出。 观察反应方程式: CS2 + 302 == C02 + 2S02 气体体积减少 (△V) 3L 1L 2L 0 所以,反应前后,混合气体在标准状况下的体积和反应前的气体体积相等,即为0.448L。 答:反应后气体混合物在标准状况时的体积是0.448L. 对点训练: 1. 10毫升某气态烃在80毫升氧气中完全燃烧后,恢复到原来状况(1.01×105Pa , 270C)时,测得气体体积为70毫升,求此烃的分子式。 【点拨】原混和气体总体积为90毫升,反应后为70毫升,体积减少了20毫升。剩余气体应该是生成的二氧化碳和过量的氧气,下面可以利用差量法进行有关计算。 CxHy + (x+)O2 xCO2 + H2O 气体体积减少 1 1+ 10 20 计算可得y=4 ,所以烃的分子式为:CH4或C3H4或C2H4 。 2. 守恒法 在化学中有许多守恒关系,如原子守恒、得失电子守恒、溶液中电荷守恒等,无需参照复杂的变化途径、细节,直接从始态和终态思考入手求解: 原子守恒:反应前后质量守恒,变化前后同种元素的原子个数相等。 得失电子守恒:在氧化还原反应中,得失电子相等。 电荷守恒:①在电解质溶液中,由于溶液呈电中性,所以阴离子所带负电荷总数等于阳离子所带正电荷总数。②在离子方程式中,方程式两边所带电荷总数相等。 (1)原子守恒法 例3: 有0.4g铁的氧化物, 用足量的CO 在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到0.75g固体沉淀物,这种铁的氧化物的化学式为( ) A. FeO B. Fe2O3 C. Fe3O4 D. Fe4O5 解析:由题意得知,铁的氧化物中的氧原子最后转移到沉淀物CaCO3中。且n(O)=n(CaCO3)=0.0075mol, m(O)=0.0075mol×16g/mol=0.12g。m(Fe)=0.4g-0.12g=0.28g,n(Fe)=0.005mol。n(Fe)∶n(O)=2:3,选B 对点训练: 1、 3.2g铜与硝酸完全反应,生成NO和NO2,标准状况下体积为1.12L。则该硝酸中HNO3的物质的量为?(0.15mol) (2)元素守恒法 例4:将几种铁的氧化物的混合物加入100mL、7mol•L―1的盐酸中。氧化物恰好完全溶解,在所得的溶液中通入0.56L(标况)氯气时,恰好使溶液中的Fe2+完全转化为Fe3+,则该混合物中铁元素的质量分数为 ( ) A. 72.4% B. 71.4% C. 79.0% D. 63.6% 解 析:铁的氧化物中含Fe和O两种元素,由题意,反应后,HCl中的H全在水中,O元素全部转化为水中的O,由关系式:2HCl~H2O~O,得:n(O)=, m(O)=0.35mol×16g•mol―1=5.6 g; 而铁最终全部转化为FeCl3,n(Cl)=0.56L ÷22.4L/mol×2 + 0.7mol=0.75mol, n(Fe)=,m(Fe)=0.25mol×56g/mol =14 g, 则,选B。 对点训练: 1.将3.20gCu跟30.0mL10.0mol/L的硝酸反应,产物只有NO和NO2。若反应后溶液中有a mol H+,则此时溶液中含有NO3-离子的物质的量为( ) A.a/2 mol B.2a mol C.0.1a mol D.(a+0.1) mol (3)得失电子守恒法 例6:某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,生成NO,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为 ( ) A. 4∶1 B. 2∶1 C. 1∶1 D. 3∶2 解 析:设Fe2+为xmol,Fe3+为ymol,则: x+y==0.1(Fe元素守恒) ① 2x+3y=(得失电子守恒) ② 联合①②式,解得:x=0.06mol,y=0.04mol。 则x∶y=3∶2。故选D。 (4)电荷守恒法 例5: 将8g Fe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为( ) A. 1.5mol/L B. 0.5mol/L C. 2mol/L D. 1.2mol/L 解 析:粗看题目,这是一利用关系式进行多步计算的题目,操作起来相当繁琐,但如能仔细阅读题目,挖掘出隐蔽条件,不难发现,反应后只有Na2SO4存在于溶液中,且反应过程中SO42―并无损耗,根据电中性原则:n(SO42―)=n(Na+),则原硫酸的浓度为:2mol/L,故选C。 对点训练: 1.在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为( ) A.0.1mol B.0.5mol C.0.15mol D.0.25mol 3. 关系式法 实际化工生产中以及化学工作者进行科学研究时,往往涉及到多步反应:从原料到产品可能要经过若干步反应;测定某一物质的含量可能要经过若干步中间过程。对于多步反应体系,依据若干化学反应方程式,找出起始物质与最终物质的量的关系,并据此列比例式进行计算求解方法,称为“关系式”法。利用关系式法可以节省不必要的中间运算步骤,避免计算错误,并能迅速准确地获得结果。用关系式解题的关键是建立关系式,建立关系式的方法主要有:1、利用微粒守恒关系建立关系式,2、利用方程式中的化学计量数间的关系建立关系式,3、利用方程式的加合建立关系式。 例7:工业上制硫酸的主要反应如下: 4FeS2+11O22Fe2O3+8SO2 , 2SO2+O22SO3 , SO3+H2O=H2SO4 煅烧2.5t含85%FeS2的黄铁矿石(杂质不参加反应)时,FeS2中的S有5.0%损失而混入炉渣,计算可制得98%硫酸的质量。 解析:根据化学方程式,可以找出下列关系:FeS2~2SO2~2SO3~2H2SO4, 本题从FeS2制H2SO4,是同种元素转化的多步反应,即理论上FeS2中的S全部转变成H2SO4中的S。得关系式: FeS2~2H2SO4 。 过程中的损耗认作第一步反应中的损耗,得可制得98%硫酸的质量是: =3.36。 对点训练: 1.为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下: IO3-+5I-+6 H+→3I2+3H2O I2+2S2O32-→2I-+S4O62- 【点拨】本题为多步反应的计算,可根据反应方程式直接建立IO3-和S2O32-的关系式进行求解。 解: 6S2O32- ------- IO3- 6mol 1mol 0.030mol/L×18.00mL×10-3 n 解得, n(IO3-) = 0.09×10-3mol 所以,食盐样品428克含KIO3:0.09×10-3mol ×214 g/mol = 19.26×10-3 g = 19.26 mg 从而,可求每千克食盐中含KIO3:×1000 = 45 mg ∴该加碘食盐是合格的. 4. 极值法 “极值法”即 “极端假设法”,是用数学方法解决化学问题的常用方法.所谓“极值法”就是对数据不足无从下手的计算或混合物组成判断的题,极端假设恰好为某一成分,或者极端假设为恰好完全反应,以确定混合体系各成分的名称、质量分数、体积分数的解题方法。 例8:将4l.6 gBaCl2溶于水配成lL溶液,向溶液中加入29gNa2SO4和Na2CO3的混合物,恰好使Ba2+完全沉淀,将沉淀过滤、洗涤、烘干,其总质量为 ( ) A、48.9g B、48.8g C、44.8g D、38.5g 解析:n(BaCl2)= 4l.6/208=0.2mol M(BaSO4)=233g/mol M(BaCO3)=197g/mol 假设只生成BaSO4沉淀:m(BaSO4)=233g/mol×0.2mol=46.6g 假设只生成BaCO3沉淀:m(BaCO3)=197g/mol×0.2mol=39.4g 实际沉淀的质量应该是:39.4g<m(沉淀)<46.6g,答案为C。 对点训练: 1.将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8 L(标准状况),原混合物的质量可能是( ) A. 2g B. 4g C. 8g D. 10g 【点拨】本题给出的数据不足,故不能求出每一种金属的质量,只能确定取值范围。三种金属中产生等量的氢气质量最大的为锌,质量最小的为铝。故假设金属全部为锌可求的金属质量为8.125g,假设金属全部为铝可求的金属质量为2.25g,金属实际质量应在2.25g ~8.125g之间。故答案为:B、C。 2. 不纯的CuCl2样品13.5g与足量的AgNO3溶液充分反应后得到沉淀29g,则样品中不可能含的杂质是( ) (A)AlCl3 (B)NaCl (C)ZnCl2 (D)CaCl2 3. 在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是( ) (A)Na2O (B)Na2O2 (C)Na2O和Na2O2 (D)Na2O2和NaO2 5. 十字交叉法 在有关混合物的计算中,如果知道其中两个物理量的平均值,如平均摩尔质量、平均相对原子(或分子)质量等等,就可以用十字交叉法计算相关物质的组成比列,将计算过程大大简化。 例9:已知氯元素的平均相对原子质量为35.5,在自然界中,氯元素有两种同位素, 即35Cl和37Cl,求两种同位素的原子个数之比。 解析:据题意可知,35和37的平均值为35.5,可以用十字交叉法快速求解 答:35Cl和37Cl的原子个数之比为3:1。 对点训练: 1.在自然界中,硼元素有10B、11B两种同位素,硼元素的平均摩尔质量为10.8 g/mol,计算两种硼的同位素的原子个数之比 。 (1:4) 2.短周期元素X和Y所形成的两种气态化合物A和B,已知A和B的混合物对H2的相对密度为20.25,在相同条件下,A与B的密度比为15:22,则A的化学式为 ,B的化学式为 ,混合物中A与B的体积之比为 。 (NO; N2O; 1:3) 3.在标准状况下,将C02和CO组成的混合气体9g,完全燃烧后在标准状况下测得C02的体积为5.6L,求混合气体中二氧化碳和一氧化碳的体积各多少升? (2.8 L; 2.8 L) 【提示】CO燃烧变成C02 ,体积不变,故原混合气体也为5.6L,即0.25 mol。 所以,原混合气体平均摩尔质量为9 g /0.25 mol =36g.mol-1 6. 平均值法 所谓平均值法是一种将数学平均原理应用于化学计算的解题方法。它所依据的数学原理是:两个数Mr1和Mr2(Mr1大于Mr2)的算术平均值Mr,一定介于两者之间。所以,只要求出平均值Mr,就可以判断出Mr1和Mr2的取值范围,再结合题给条件即可迅速求出正确答案。常见方法有:求平均原子量、平均式量、平均摩尔电子质量、平均组成等。 例10:由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是 A.锌 B.铁 C.铝 D.镁 解析:本题利用平均摩尔电子质量求解,据10克金属与足量的盐酸反应产生的氢气在标准状况下为11.2升可得金属平均摩尔电子质量为10g/mol。四种金属的摩尔电子质量分别为:Zn:32.5g/mol、Fe:28g/mol、Al:9g/mol、Mg:12g/mol,其中只有Al的摩尔电子质量小于10g/mol,故答案为C。 对点训练: 1.由10g含有杂质的CaCO3和足量的盐酸反应,产生CO2 0.1mol,则此样品中可能含有的杂质是( ) A.KHCO3和MgCO3 B.MgCO3和SiO2 C.K2CO3和SiO2 D.无法计算 三、巩固训练: 1、将一块NaCl和NaBr的混合物16.15 g,溶于水后,通入足量的氯气充分反应,把溶液蒸干、灼烧,得固体11.70 g.求原混合物中NaCl的质量?(5.85 g) 2、铁片放入500 mL 1 mol·L-1的CuS04溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重O.8 g,反应后溶液中CuS04的物质的量浓度是多少?(0.8 mol·L-1) 3、将充有20 mL N2和NO2气体的试管倒立在水槽中,充分反应后,试管内残留气体为10 mL,则原混合气体中N2和NO2的体积比是? ( 1:3 ) 4、 要把12mol/L的盐酸(密度1.19g/cm3)50mL稀释成6mol/L 的盐酸(密度1.10g/cm3),需加水( ) A.50mL B.50.5mL C.55mL D.59.5mL 5、1.92gCu粉与一定量的浓硝酸反应,当铜粉完全反应时收集到气体1.12L(标况),则所消耗硝酸的物质的量是( ) A、0.12mol B、0.11mol C、0.09mol D、0.08mol 6、 把NaHCO3和Na2CO3·10H2O的混合物7.4g溶于水,配成100mL溶液,其中Na+的离子浓度为0.6mol/L,如果将7.4g这种混合物加热到恒重,余下的物质的质量会是多少g ?(3.18 g) 7、0.6 mol镁与足量稀硫酸反应,得到的氢气与多少克氯酸钾完全分解制得的氧气恰好完全反应? (24.5 g) 8、用CO还原10.0 g某磁铁矿石样品(所含的杂质不参加反应),生成的CO2再跟过量的石灰水反应, 得到12.8 g沉淀。求磁铁矿石中Fe3O4的质量分数。(74.24%) 9、取5.4克由某碱金属R及其氧化物R2O组成的混合物。该混合物与足量的水反应。反应完毕,蒸发反应后得到的溶液,得到8克无水晶体。试通过计算,判断该金属是哪一种碱金属?(Na) 10、用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体的平均式量为19,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为( ) A. B. C. D. 无法判断 11、锌、铁、镁三种金属中的两种混合物13g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( ) A.锌 B.铁 C.镁 D.无法推断 12、用8.7 g MnO2与100 g 36.5%的浓盐酸反应,消耗盐酸的物质的量是多少?产生Cl2在标况下的体积是多少?(0.4 mol;2.24 L) 13、将0.65 g锌加到50 mL 1 mol·L-1盐酸中,计算: (1)标准状况下,生成H2的体积.(0.224 L) (2)若反应完成后,溶液体积仍为50 mL,这时溶液中的Zn2+和H+的物质的量浓度是多少? (0.2 mol·L-1 ;0.6mol·L-1) 巩固练习部分参考答案: 4.[解析](质量守恒法)根据 公式C1V1=C2V2得:12mol/L 0.05L=6mol/L×V2 , V2=0.1L; m2(液)=0.1L×1000ml/L×1.10g/cm3=110g, 所以需要加水:110g-50mL×1.19g/cm3=50.5g,即50.5ml。[答案]B 9. [解析](极值法)(1) 设5.4克混合物都是碱金属R,则由: (2) 设5.4克混合物都是R的氧化物R2O,则由: R ------ ROH R2O ------ 2ROH M M+17 (式中,M为碱金属R的式量) 2M+16 2M+34 5.4g 8g 5.4 g 8 g 解得,M=35.3 解得,M=10.7 综合(1)和(2)所述,碱金属R的式量M的范围为(10.7,35.3)。在碱金属中,只有金属Na的式量23在(10.7,35.3)中,所以该碱金属是金属钠。 10.[解析](十字交叉法)计算氨气与空气的体积比: 所以氨气占5/6,空气占1/6;由于氨气易溶于水,故剩余气体为空气。 [答案]C 11.[解析] (平均值法)根据锌、铁、镁三种金属与足量的盐酸反应,均生成二价金属阳离子得: R + 2HCl= RCl2+ H2 (R为金属,设平均式量M) M 22.4L 13 11.2L M:13=22.4:11.2 求得,M=26 则必须有相对原子质量大于26和小于26的金属存在,又因为锌、铁的相对原子质量均大于26,只有镁的相对原子质量小于26,故答案为C。 [答案]C www.ks5u.com查看更多