- 2021-05-13 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学无机推断题集锦
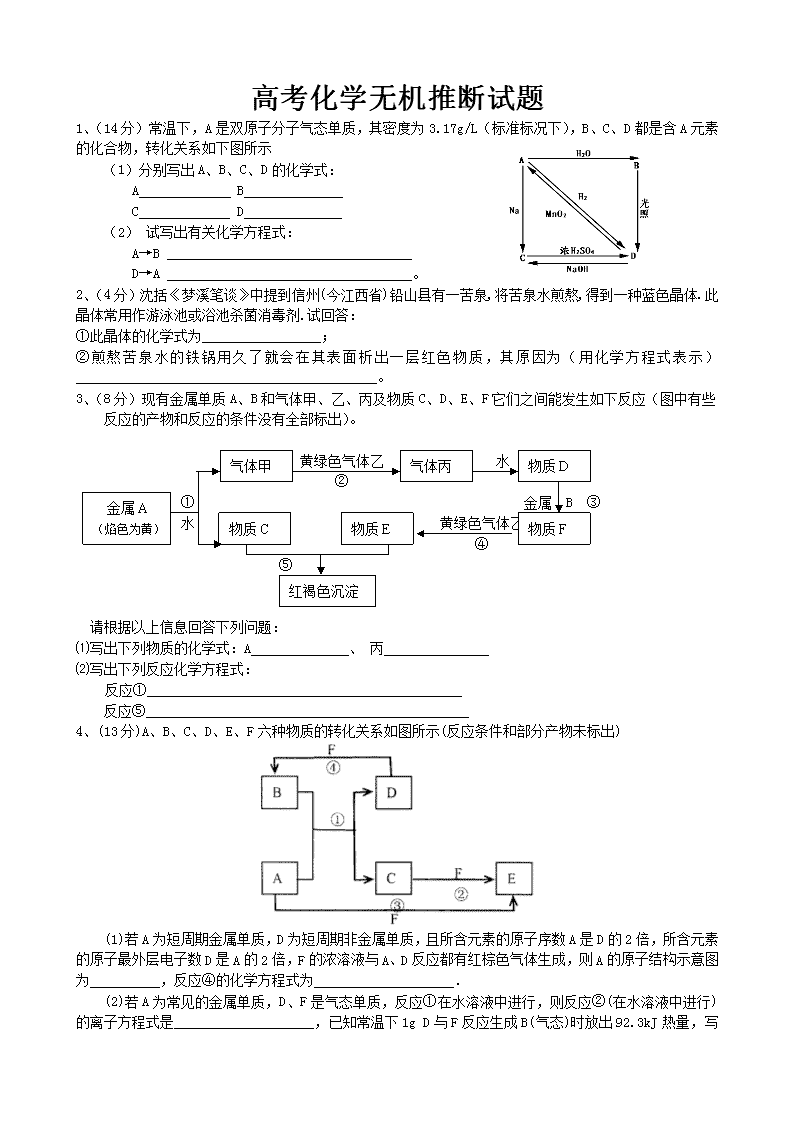
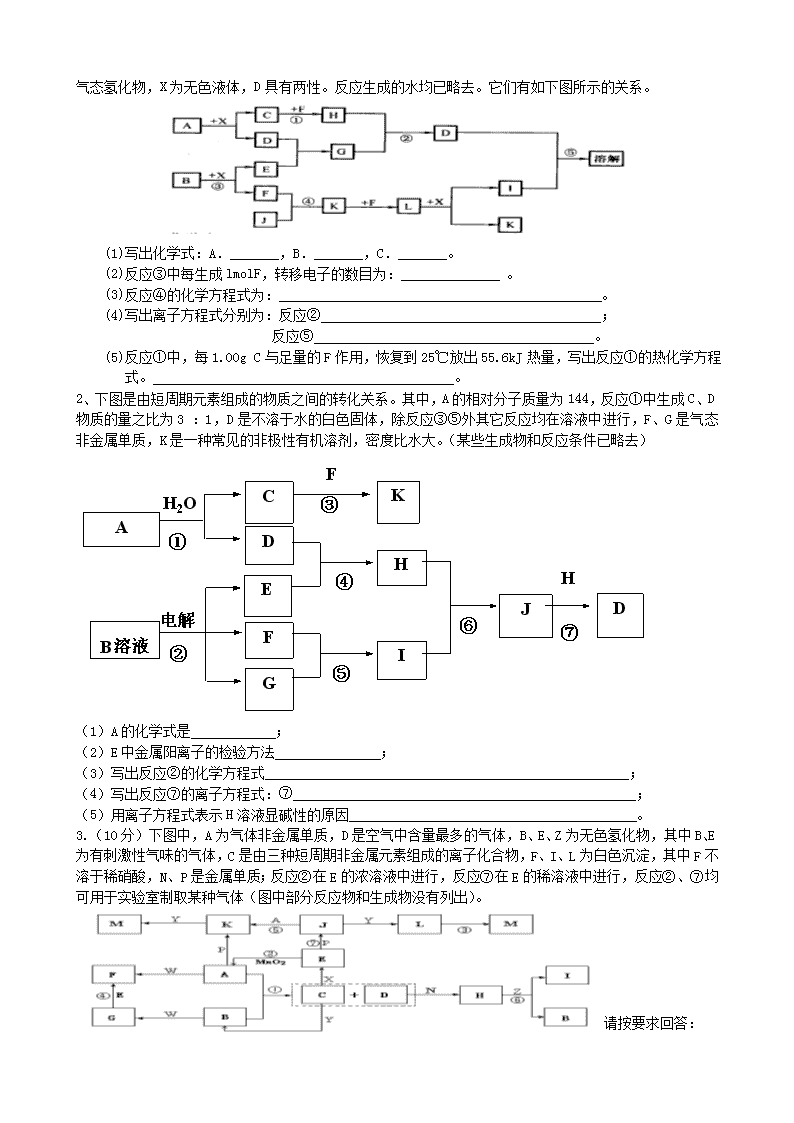
高考化学无机推断试题 1、(14分) 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如下图所示 (1)分别写出A、B、C、D的化学式: A B C D (2) 试写出有关化学方程式: A→B D→A 。 2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________; ②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。 3、(8分)现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。 物质D 气体丙 气体甲 黄绿色气体乙 水 ② 金属A (焰色为黄) ① 金属 B ③ 物质F 物质E 物质C 水 黄绿色气体乙 ④ ⑤ 红褐色沉淀 请根据以上信息回答下列问题: ⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式: 反应① 反应⑤ 4、(13分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) (1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为____________________. (2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________. (3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,B固体属于__________晶体. 5.(10分)短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。 请回答下列问题: (1)若C是离子化合物,D是一种强碱,写出C的化学式 。 (2)若C与水发生复分解反应,E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。 ①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。 。 ②用等式表示E与NaOH溶液反应生成的正盐溶液中所有离子浓度之间的关系 ______________________________________________________。 (3)若C是一种气体,D是一种强酸。 ①C与水反应的化学方程式_________________________。 ②有人认为“浓H2SO4可以干燥气体C”。某同学 为了验证该观点是否正确,用右图装置进行实验。 实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是__________________________________________________________________________。 答案1. (1)A Cl2 B HClO C NaCl D HCl (2)A→B Cl2 +H2O HClO+ HCl D→A MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 2、(1)①CuSO4·5H2O, ②Fe + CuSO4 = FeSO4 + Cu 3、(1)Na HCl (2)2Na + 2H2O = 2NaOH + H2↑ FeCl3 + 3NaOH ==Fe(OH)3↓+ 3NaCl 4.(10分)⑴+12 2 8 2 (1分) C+4HNO3(浓) CO2↑+4NO2↑+2H2O (2分) ⑵2Fe2++Cl2 2Fe3++2Cl-(2分) H2(g )+Cl2 (g)2HCl(g);△H=-184.6kJ·mol-1 (2分) ⑶2C+SiO2 2CO↑+Si (2分) 原子(1分) 5.(10分,每空2分) (1)Na2O2 (2分) (2)① H++H2O+AlO2- Al(OH)3 Al3++3OH- (2分) ② c(Na+)+c(H+) = 2c(S2-)+c(HS-)+c(OH-) (2分) (3)①3NO2+H2O = 2HNO3+NO (2分) ②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2 (2分) 1 、已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性。反应生成的水均已略去。它们有如下图所示的关系。www.ks5.u.com (1)写出化学式:A. ,B. ,C. 。 (2)反应③中每生成lmolF,转移电子的数目为: 。 (3)反应④的化学方程式为: 。 (4)写出离子方程式分别为:反应② ; 反应⑤ 。 (5)反应①中,每1.00g C与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式。 。 2、下图是由短周期元素组成的物质之间的转化关系。其中,A的相对分子质量为144,反应①中生成C、D物质的量之比为3 :1,D是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,F、G是气态非金属单质,K是一种常见的非极性有机溶剂,密度比水大。(某些生成物和反应条件已略去)w.w.w.k.s.5.u.c.o.m A C D B溶液 F K E F G H J D I H2O 电解 H ① ② ③ ⑤ ④ ⑥ ⑦ (1)A的化学式是 ; (2)E中金属阳离子的检验方法 ; (3)写出反应②的化学方程式 ; (4)写出反应⑦的离子方程式:⑦ ; (5)用离子方程式表示H溶液显碱性的原因 。 3.(10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。 请按要求回答: (1)写出C的电子式 ,I的化学式 ; (2)反应③的化学方程式为 ; (3)反应④的离子方程式为 ; (4)由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。 4.(10分)已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出)。化合物A是一种常用的肥料,其化学式可表示为XY4ZM2,组成A的四种元素都是短周期元素、其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大。C、D、G、I、J、K为气体,其中C、K的温室效应均显著,K是含碳量最高的有机物,D能使湿润的红色石蕊试纸变蓝。B为一种白色固体,其化学式可表示为X3Y6M6,E的化学式可表示为X3M4。请按要求回答下列问题: ② A B C D F G I I J E ① 加热,加压 电解O2 H I C K F 隔绝空气加热 F L ③ (1)反应①、②、③的化学方程式分别为 、 、 。 (2)B中M的质量分数为 。 (3)化合物E是一种新型无机材料,它的一种结构(β- X3M4)具有可与金刚石相媲美的硬度。请推测该材料可能用途之一是 。 5.A是一种重要的矿石,B—I均是中学化学常见物质,其中D、H为气体。J是有两种元素形成的化合物,它是一种良好的耐热冲击材料,抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料,它还是电绝缘体。它们在一定条件下有如下转化关系(某些反应产物和反应条件已略去),其中反应①一④是某工业流程的重要组成部分: 试回答下列问题: (1)写出反应②和⑤的离子方程式: ②_______________________________________, ⑤_______________________________________; (2)操作I和操作Ⅱ的实验名称分别是______ ___和___________; (3)H气体在后续反应中必须是干燥的,干燥H气体时所选择的干燥剂可以是________ (4)J的化学式为____________,其晶体中存在的化学键类型有共价键和________ (5)有人说在反应⑤中选择(NH4)2CO3比NH4HCO3更好,其理由是_____________ ______________________________________________。 6.(10分)已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质,D为无色气体,在空气中会出 F X溶液 滤液A 固体C 盐酸 D 溶液B 沉淀G H △ 固体E N 蓝色 沉淀 Y F ② ③ M ① ④ 现红棕色。各物质的转化关系如下图(部分反应产物已略去)。 请回答下列问题: (1)X的化学式为 ;F的电子式为 。 (2)反应①的离子方程式为_______________________________________________。 反应②的化学方程式为_______________________________________________。 (3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。(假设体积不变) 答案1、(1)Al4C3;Na2O2;CH4 (2)1.204×1024 (3)4NH3+5O2 4NO+6H2O (4)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- (或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-); Al(OH)3+3H+=Al3++3H2O (5)CH4(g)+2O2(g)CO2(g)+2H2O(l);△H=-889.6kJ·mol-1 2、(1)Al4C3 (2) 取试样,进行焰色反应,若火焰显黄色,说明有Na+存在。 (3) 2NaCl+2H2O=== Cl2↑+ Cl2↑+2NaOH (4) Al3++3AlO2-+6 H2O==4Al(OH)3↓ (5)AlO2-+2 H2OAl(OH)3+ OH- 3.(8分)(1) Mg(OH)2 (每空1分) (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分) (3)Ag(NH3)2++2H++Cl-=2NH4++AgCl↓(2分) (4)C为固体 无氧(每空1分) 4.(1)6(NH2)2CO → C3H6N6 + 6NH3 + 3CO2、4NO2 + O2+2H2O = 4HNO3、 CO2+4H2→CH4 +2H2O (2)66.7% (3)做耐磨材料等。 5.(1)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- NH4++HCO3-+2OH-NH3↑+CO32-+2H2O (2)过滤、加热 (3)碱石灰 (4)AlN,配位键 (5)使用(NH4)2CO3时,使用等量的NaOH溶液生成的NH3多 6、(10分)(1),(2分/个,共4分) (2)① 3Fe2+ + NO3-+ 4H+ == 3Fe3+ + NO↑+ 2H2O(2分) ② (2分) (3)0.2 mol/L(2分) 1、(10分)有下列物质之间的相互转化 ② 刺激性 气 体 O2、△ ① 催化剂 NaOH 金属 红棕色气体 NaOH 无色液体 O2 A B C D E F E Na2FO2 C A NaOH Na2F2O4 A 已知E是具有还原性的含氧酸钠盐,回答下列问题(方程式中的物质用对应的元素符号或化学式表示) ⑴写出A和O2反应生成B和C的方程式: 。 ⑵Na2FO2和Na2F2O4均为易溶于水的盐。Na2FO2溶于过量的新制氯水后形成黄色溶液,向该溶液中滴入KSCN溶液出现血红色。分别写出反应②以及Na2FO2溶于过量氯水的离子方程式: 、 。 ⑶事实上,金属F放置于一定浓度NaOH和E混合溶液中一段时间,发生反应①、②,生成的Na2FO2和Na2F2O4能发生可逆反应,在F表面生成一层致密的氧化物保护层。试写出Na2FO2和Na2F2O4相互反应生成保护层的化学反应方程式为: 。 ⑷为防止金属F的腐蚀,将F制品放置于一定浓度NaOH和E混合溶液中时,NaOH的浓度不宜 (填“太小”或“太大”)。 2.(12分)A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题: ⑴H的化学式为_____________,D的电子式为_________________________; ⑵B和N的离子反应方程式为_______________________________________________; ⑶D与G反应的离子方程式为_______________________________________________; ⑷G与M反应的化学方程式为_______________________________________________; ⑸I可用于净化水,其原因是 3.(8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去) Y A 氯气 D溶液 C X D无水晶体 E F G H A B溶液 G 原电池 反 应 +氧气⑥ +Y高温⑦ ① ② ③ 电解 熔融 操作a +氧气 +氧气 +C ⑤ △ ④ 浓溶液 请填写下列空白: (1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 _____ (2)从D溶液制备D的无水晶体的“操作a”为 。 (3)反应②的化学方程式为 。 (4)反应⑤的化学方程式为 。 答案 1、 (10分)(1)4NH3 + 5O2 4NO + 6H2O (2)6FeO22— + NO2— + 5H2O = 3Fe2O42— + NH3 + 7OH— 2FeO22— + Cl2 + 8H+ = 2 Fe3+ + 2Cl— + 4H2O (3)Na2FeO2 + Na2Fe2O4 +2H2O Fe3O4 + 4NaOH (4)太大;(每空2分) 2.(共12分)(每空2分)⑴H化学式:Fe3O4 D的电子式: ⑵Cl2 + 2OH- = Cl- + ClO- + H2O ⑶2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑ ⑷3Fe + 4H2O(g)Fe3O4 + H2↑ ⑸FeCl3水解生成Fe(OH)3胶体, Fe(OH)3胶体吸附水中悬浮杂质而净水 催化剂 Δ △ 3.(8分)(1)2Mg+CO2====2MgO+C; (2分) (2)将D溶液在HCl气流中蒸干;(2分) (3)②4NH3+5O2====4NO+6H2O; (2分) (4)⑤C+4HNO3====CO2+4NO2↑+2H2O (2分)查看更多