- 2021-05-13 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
北京高考理综化学
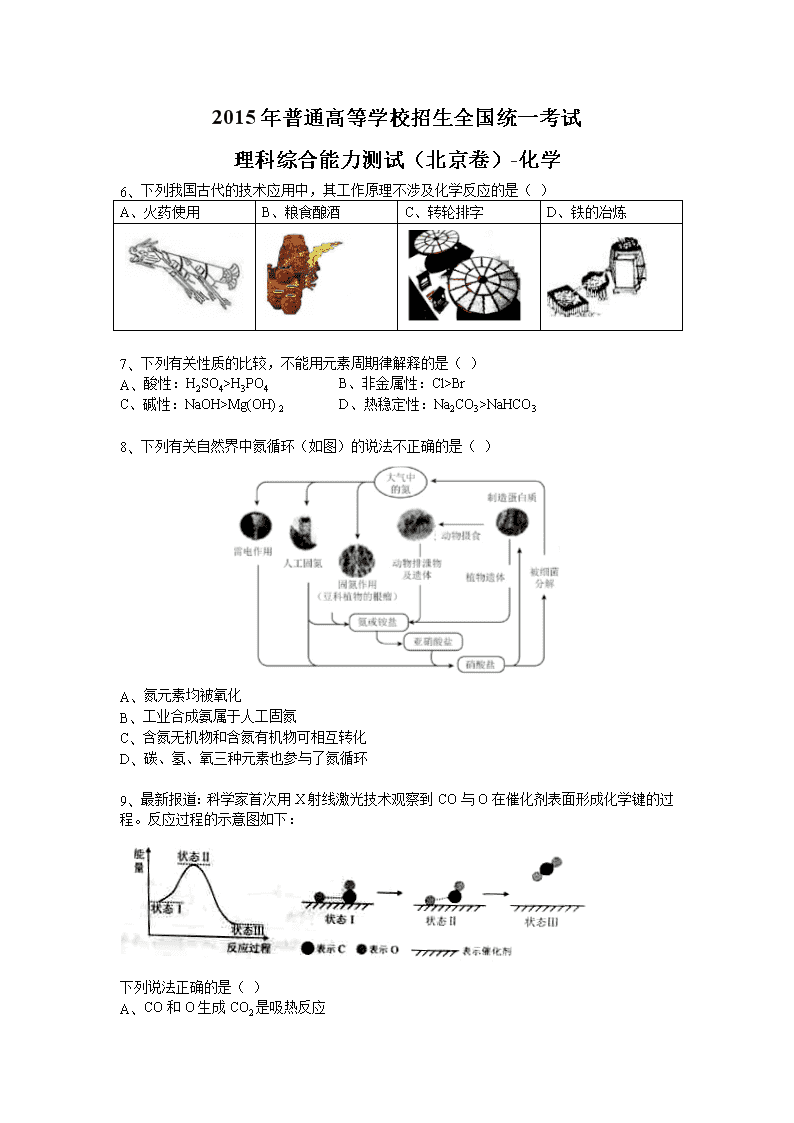
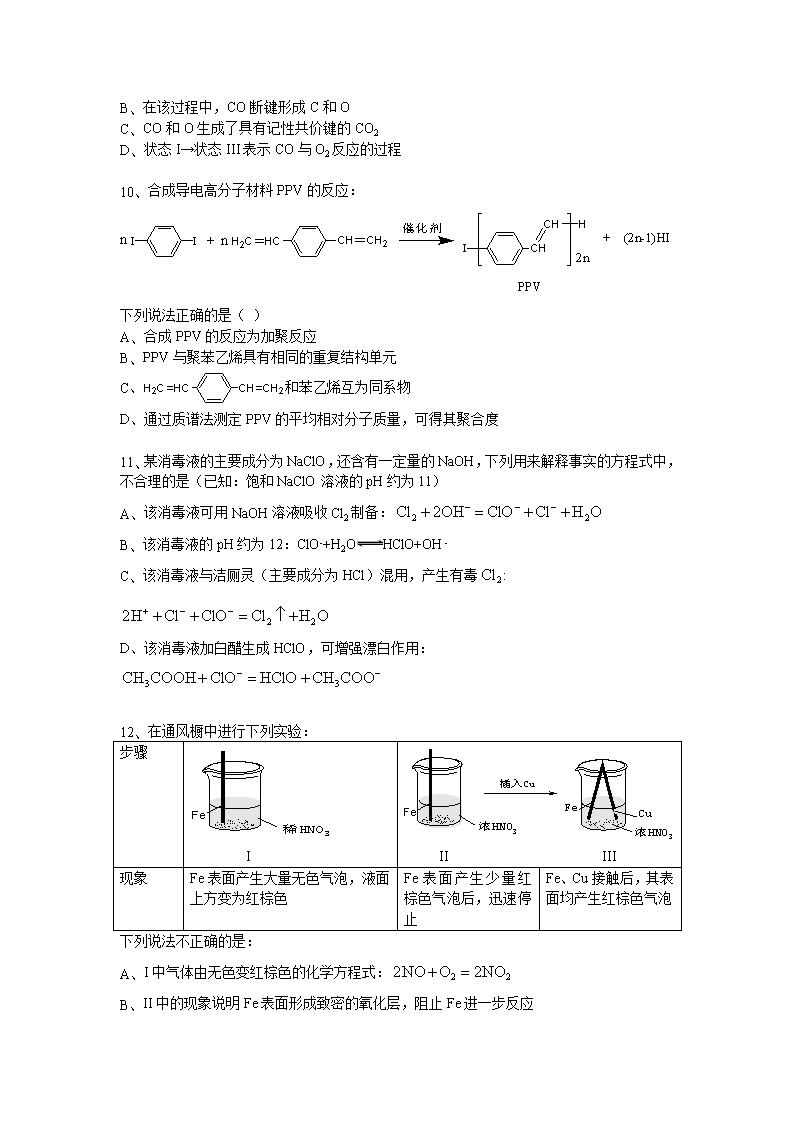
2015年普通高等学校招生全国统一考试 理科综合能力测试(北京卷)-化学 6、 下列我国古代的技术应用中,其工作原理不涉及化学反应的是( ) A、火药使用 B、粮食酿酒 C、转轮排字 D、铁的冶炼 7、 下列有关性质的比较,不能用元素周期律解释的是( ) A、 酸性:H2SO4>H3PO4 B、非金属性:Cl>Br C、碱性:NaOH>Mg(OH)2 D、热稳定性:Na2CO3>NaHCO3 8、 下列有关自然界中氮循环(如图)的说法不正确的是( ) A、 氮元素均被氧化 B、 工业合成氨属于人工固氮 C、 含氮无机物和含氮有机物可相互转化 D、 碳、氢、氧三种元素也参与了氮循环 9、 最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是( ) A、 CO和O生成CO2是吸热反应 A、 在该过程中,CO断键形成C和O B、 CO和O生成了具有记性共价键的CO2 C、 状态I→状态III表示CO与O2反应的过程 10、 合成导电高分子材料PPV的反应: 下列说法正确的是( ) A、 合成PPV的反应为加聚反应 B、 PPV与聚苯乙烯具有相同的重复结构单元 C、和苯乙烯互为同系物 D、通过质谱法测定PPV的平均相对分子质量,可得其聚合度 11、 某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11) A、 该消毒液可用NaOH溶液吸收Cl2制备: B、 该消毒液的pH约为12:ClO-+H2OHClO+OH- C、 该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒: D、该消毒液加白醋生成HClO,可增强漂白作用: 12、 在通风橱中进行下列实验: 步骤 I II III 现象 Fe表面产生大量无色气泡,液面上方变为红棕色 Fe表面产生少量红棕色气泡后,迅速停止 Fe、Cu接触后,其表面均产生红棕色气泡 下列说法不正确的是: A、 I中气体由无色变红棕色的化学方程式: B、 II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 A、 对此I、II中现象,说明稀HNO3的氧化性强于浓HNO3 B、 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 25、 (17分) “张-烯炔环异构化反应”被《Name Reactions》收录,该反应可高效构筑五元环状化合物: (R、R’、R’’表示氢、烷基或芳基) 合成五元环有机化合物J的路线如下: 已知: (1) A属于炔烃,其结构简式是 。 (2) B由碳、氢、氧三种元素组成,相对分子质量是30。B的结构简式是 。 (3) C、D含有与B相同的官能团,C是芳香族化合物。E中含有的官能团是 。 (4) F与试剂a反应生成G的化学方程式是 ;试剂b是 。 (5) M和N均为不饱和醇。M的结构简式是 。 (6) N为顺式结构,写出N和H生成I(顺式结构)的化学方程式: 。 26、 (12分) 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示: (1) 反应I的化学方程式是 。 (2) 反应I得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层-含低浓度I2的H2SO4层和含高浓度I2的HI层。 ①根据上述事实,下列说法正确的是 (选填序号)。 a. 两层溶液的密度存在差异 b. 加I2前,H2SO4溶液和HI溶液不互溶 c. I2在HI溶液中比在H2SO4溶液中易溶 ②辨别两层溶液的方法是 。 ③经检测,H2SO4层中。其比值大于2的原因是 。 (3) 反应II:, 它由两步反应组成:i. ,; ii. 分解。 L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,ii中的平衡转化率随X的变化关系。 ①X代表的物理量是 。 ②判断L1、L2的大小关系,并简述理由: 。 27、 (14分) 研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。 (1) 溶于海水的CO2主要以4种无机碳形式存在。其中占95%。写出CO2溶于水产生的方程式: 。 (2) 在海洋碳循环中,通过如图所示的途径固碳。 ①写出钙化作用的离子方程式: 。 ②同位素示踪法证实光合作用释放出的O2只来自于H2O。用 标记物质的光合作用的化学方程式如下,将其补充完整: + (1) 海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法: ①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线中的装置补充完整并标出所用试剂。 ②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用x mol/L HCl溶液滴定,消耗y mL HCl溶液。海水中溶解无机碳的浓度= mol/L。 (2) 利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。 ①结合方程式简述提取CO2的原理: 。 ②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。 28、 (15分) 为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-2Fe2++I2”反应中的Fe3+和Fe2+的相互转化,实验如下: (1) 待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。 (2) iii是ii的对比实验,目的是排出ii中的 造成的影响。 (3) i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。 (4) 根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+。用右图装置(a、b均为石墨电极)进行实验验证。 ①K闭合时,指针向右偏转,b作 极。 ②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液。产生的现象证实了其推测。该现象是 。 (5) 按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因。 ①转化原因是 。 ②与(4)实验对比,不同的操作是 。 (6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-。将(3)和(4)、(5)作对比,得出的结论是 。查看更多