- 2021-05-13 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学真题Word——全国卷试题答案解析
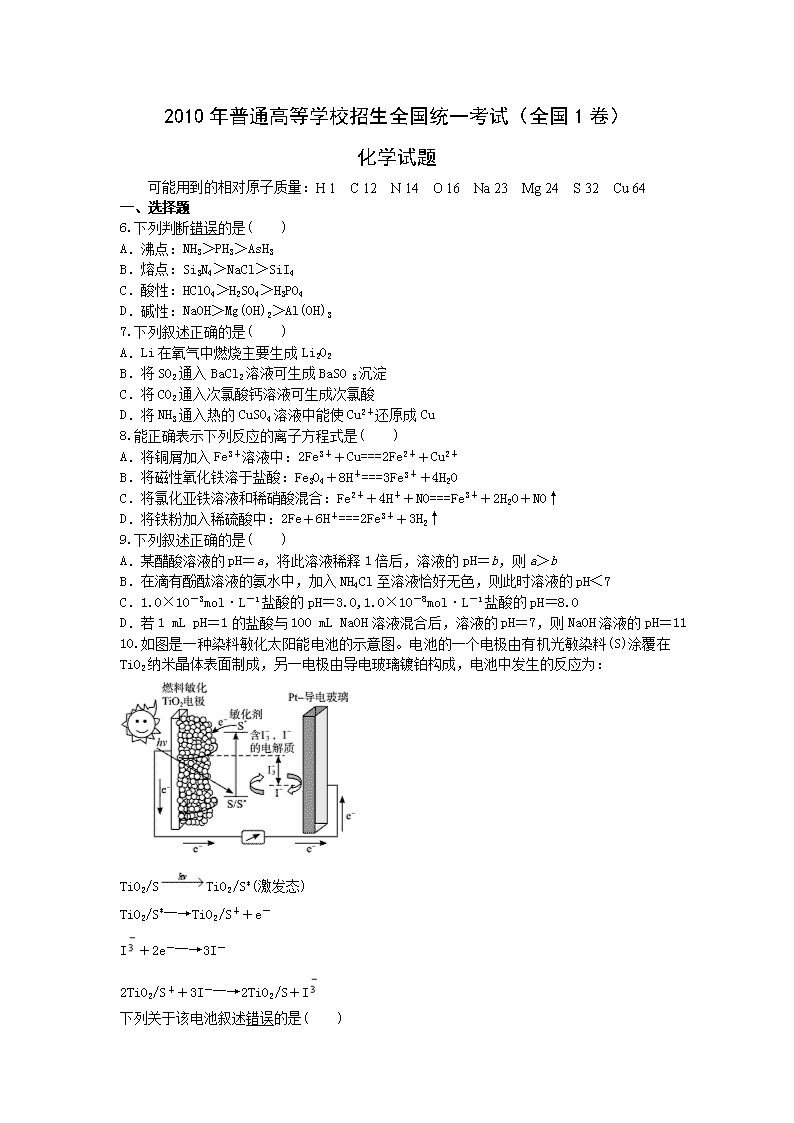
2010年普通高等学校招生全国统一考试(全国1卷) 化学试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Cu 64 一、选择题 6.下列判断错误的是( ) A.沸点:NH3>PH3>AsH3 B.熔点:Si3N4>NaCl>SiI4 C.酸性:HClO4>H2SO4>H3PO4 D.碱性:NaOH>Mg(OH)2>Al(OH)3 7.下列叙述正确的是( ) A.Li在氧气中燃烧主要生成Li2O2 B.将SO2通入BaCl2溶液可生成BaSO 3沉淀 C.将CO2通入次氯酸钙溶液可生成次氯酸 D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu 8.能正确表示下列反应的离子方程式是( ) A.将铜屑加入Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+ B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2O C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO===Fe3++2H2O+NO↑ D.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑ 9.下列叙述正确的是( ) A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 C.1.0×10-3mol·L-1盐酸的pH=3.0,1.0×10-8mol·L-1盐酸的pH=8.0 D.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 10.如图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: TiO2/STiO2/S*(激发态) TiO2/S*―→TiO2/S++e- I+2e-―→3I- 2TiO2/S++3I-―→2TiO2/S+I 下列关于该电池叙述错误的是( ) A.电池工作时,是将太阳能转化为电能 B.电池工作时,I-在镀铂导电玻璃电极上放电 C.电池中镀铂导电玻璃为正极 D.电池的电解质溶液中I-和I的浓度不会减少 11.下图表示4溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是( ) A.①④ B.③④ C.②③ D.①② 12.一定条件下磷与干燥氯气反应,若0.25 g磷消耗掉314 mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( ) A.1∶2 B.2∶3 C.3∶1 D.5∶3 13.下面关于SiO2晶体网状结构的叙述正确的是( ) A.存在四面体结构单元,O处于中心,Si处于4个顶角 B.最小的环上,有3个Si原子和3个O原子 C.最小的环上,Si和O原子数之比为1∶2 D.最小的环上,有6个Si原子和6个O原子 二、非选择题 27.在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1、c(B)=0.200 mol·L-1及c(C)=0 mol·L-1。反应物A的浓度随时间的变化如下图所示。 请回答下列问题: (1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是: ②________________________________________________________________________; ③________________________________________________________________________。 (2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为________。 (3)该反应的ΔH________0,其判断理由是___________________________________ ________________________________________________________________________。 (4)该反应进行到4.0 min时的平均反应速率: 实验②:v(B)=________; 实验③:v(C)=________。 28.有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验: ①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾; ②将A分别加入其他五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解; ③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出; ④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。 根据上述实验信息,请回答下列问题: (1)能确定的溶液是(写出溶液标号与相应溶质的化学式):________________; (2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:________。 29.请设计CO2在高温下与木炭反应生成CO的实验。 (1)在下面方框中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请完成A后该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下: (2)根据方框中的装置图,填写该表: 仪器标号 仪器中所加物质 作用 A 石灰石、稀盐酸 石灰石与盐酸作用产生CO2 (3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是________________________________________________________; (4)验证CO的方法是_____________________________________________________。 30.有机化合物A~H的转换关系如下图所示: 请回答下列问题: (1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗 7 mol 氧气,则A的结构简式是_________________________________________, 名称是____________________________; (2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是________________________________________________________________________ ________________________________________________________________________; (3)G与金属钠反应能放出气体。由G转化为H的化学方程式是____________________; (4)①的反应类型是________;③的反应类型是____________; (5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B所有可能的结构简式_______________________________________________; (6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构),则C的结构简式为______________________________________________________________________。 答案解析 一、选择题 6.答案:A 解析:PH3的相对分子质量小于AsH3的,所以PH3的沸点小于AsH3的,A错误;Si3N4是沸点很高的原子晶体,SiI4是分子晶体,B正确;P、S、Cl非金属性逐渐增强,所以其最高价氧化物水化物的酸性也逐渐增强,C正确;Na、Mg、Al的金属性逐渐减弱,所以其最高价氧化物水化物的碱性也逐渐减弱,D正确。 7.答案:C 解析:Li在氧气中燃烧只生成Li2O,A错误;SO2与BaCl2不反应,B错误;碳酸的酸性大于次氯酸,C正确;NH3通入CuSO4溶液中不会发生氧化还原反应,而是生成Cu(OH)2沉淀,D错误。 8.答案:A 解析:B选项中还应有Fe2+生成;C选项中,电荷、原子、得失电子均不守恒;D选项不符合客观事实,应该生成Fe2+。所以只有A选项正确。 9.答案:D 解析:酸稀释c(H+)减小,pH增大,A错误;酚酞的变色范围为8~10,溶液恰好无色时,pH可能大于7,B错误;酸的pH一定不能大于7,C错误;酸碱混合后,pH=7,所以c(H+)×V(HCl)=c(OH-)×V(NaOH),10-1×1=c(OH-)×100,所以c(OH-)=10-3 mol·L-1,D正确。 10.答案:B 解析:由信息可知A正确;由电子转移方向可知镀铂导电玻璃是正极,C正确;正极发生的是得电子的反应:I+2e-―→3I-,B错误;负极发生的是失电子的反应:3I--2e-―→I,依据得失电子守恒,D正确。 11.答案:B 解析:①发生氧化反应CC键断裂,生成羧基,产物中含有—COOH和—Br; ②发生水解,—Br被—OH取代,产物中含有—OH和;③发生消去反应,产物中只含有键;④发生加成反应,产物中只含有—Br。 12.答案:C 解析:n(P)=≈0.008 mol、n(Cl)=×2≈0.028 mol,所以n(P)∶n(Cl)≈2∶7,依P、Cl原子守恒,只有C选项符合。 13.答案:D 解析:依据甲烷的结构可知Si处于中心,O处于4个顶点,A错误;金刚石中最小的环上有6个碳原子,所以晶体硅中最小的环上也有6个硅原子,SiO2晶体相当于在每个Si—Si键之间加上一个氧原子,所以D正确。 二、非选择题 27.答案:(1)①加催化剂 达到平衡的时间缩短,平衡时A的浓度未变 ②温度升高 达到平衡的时间缩短,平衡时A的浓度减小 (2)40%(或0.4) 0.060 mol·L-1 (3)> 温度升高,平衡向正反应方向移动,故该反应是吸热反应 (4)0.014 mol·(L·min)-1 0.009 mol·(L·min)-1 解析:(1)②③的反应速率大于①的,影响化学反应速率的外界因素有温度、浓度、催化剂、压强等,此反应在溶液中进行且浓度一定,所以此题只能从温度、催化剂中选择,因为任何反应均伴随着能量变化,所以只要温度改变,化学平衡一定发生移动; (2)由三步曲 A + 2BC 始态(mol·L-1): 0.100 0.200 0 ①②反应(mol·L-1): 0.040 0.080 0.040 ①②终态(mol·L-1): 0.060 0.120 0.040 ③反应(mol·L-1): 0.060 0.120 0.060 ③终态(mol·L-1): 0.040 0.080 0.060 可知②中B的转化率等于×100%;(4)由化学方程式中计量数可知v(B)=2v(A)、v(C)=v(A),由v(A)求算。 28.答案:(1)A:NH3,E:H2SO4,F:AgNO3,C:BaCl2 (若C作为不能确定的溶液,进一步鉴别的方法合理也可) (2)B Na2CO3或K2CO3 用铂丝沾取少量B,在酒精灯火焰中灼烧,若焰色呈黄色,则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液 D Al2(SO4)3或MgSO4,取少量D,向其中滴加NaOH溶液有沉淀生成,继续加过量NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶,则D为MgSO4溶液 解析:(1)由①可知A为NH3,由纯E为无色油状液体可知E为硫酸。与氨水反应生成沉淀且无色的离子常见的有Mg2+、Al3+、Ag+,AgOH溶于氨水生成银氨溶液,所以F为AgNO3,B与E(硫酸)反应生成无色无味气体,所以B为碳酸盐,C与E(硫酸)、F(AgNO3)反应均生成不溶于硝酸的沉淀,所以C为BaCl2,D为MgSO4或Al2(SO4)3;(2)常见的可溶性碳酸盐为Na2CO3和K2CO3,鉴别钠盐、钾盐用焰色反应; Al(OH)3溶于强碱,所以用NaOH鉴别Mg2+、Al3+。 29.答案:(1)如下图 (2) 仪器标号 仪器中所加物质 作用 B 饱和碳酸氢钠溶液 除去CO2中的HCl气体 C 浓硫酸 除去CO2中的水汽 D 干燥木炭粉 与CO2反应产生CO E 澄清石灰水 吸收未反应的CO2 (3)可以通过控制加酸的量,来控制气体产生的快慢;同时小试管中充满盐酸,可以起到液封作用,防止反应剧烈时气体经漏斗冲出 (4)点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊。 解析:(1)(2)盐酸是挥发性酸,所以制取的CO2中含有HCl及水蒸气,首先除杂,先用饱和碳酸氢钠除去HCl,然后再用浓硫酸除去水蒸气,除杂后主要实验(碳与CO2反应),生成的CO气体中一定含有CO2,最后还得把CO中的CO2除去;(3)如果不加小试管,应该一次加入比较多的盐酸,才能浸没长颈漏斗尖端,无法用分次加入来控制反应速率及生成气体的量。 30.答案:(1)(CH3)2CHCCH 3-甲基-1-丁炔 (2)(CH3)2CHCHCH2+Br2 (3) ++2H2O (4)加成反应(或还原反应) 取代反应(水解) (5)CH3CHCHCHCH2(或写它的顺、反异构体)CH3CH2CCCH3 (6) 解析:确定烃A的化学式的方法有:①由相对分子质量65~75可知A只能含有5个碳原子,1 mol A完全燃烧消耗7 mol氧气,所以A的化学式为C5H8;②通过反应④及G、H的化学式可知,G含有5个碳原子,A也含有5个碳原子;A只含有一个官能团,所以A是炔烃,有一个支链,所以其结构只能为 , 与等物质的量氢气反应生成E: , E与Br2的四氯化碳溶液发生加成反应生成 F:, F水解生成G: , 依据氧原子个数可知H中含有两个酯基,是环状酯;(5)因为B为链烃,所以只能为二烯烃或单炔烃;(6)C的一氯代物只有一种,所以应该高度对称,由(5)可知二烯烃或单炔烃均不符合,那么只能为环状化合物,如果是单环也不符合,只能为双环。查看更多