全国高考理综化学试题及答案全国卷
2016年全国高考理综(化学)试题及答案-全国卷3
适用地区:云南、广西、贵州
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 V 51 Fe 56
第Ⅰ卷
一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
8.下列说法错误的是
A.乙烷室温下能与浓盐酸发生取代反应
B.乙烯可以用作生产食品包装材料的原料
C.乙醇室温下在水中的溶解度大于溴乙烷
D.乙酸在甲酸甲酯互为同分异构体
9.下列有关实验的操作正确的是
实验
操作
A.
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
B.
排水法收集KMnO4分解产生的O2
先熄灭酒精灯,后移出导管
C.
浓盐酸与MnO2反应制备纯净Cl2
气体产物先通过浓硫酸,后通过饱和食盐水
D.
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
10.已知异丙苯的结构简式如下,下列说法错误的是
A.异丙苯的分子式为C9H12 B.异丙苯的沸点比苯高
C.异丙苯中碳原子可能都处于同一平面
D.异丙苯的和苯为同系物
11.锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn + O2 + 4OH–+ 2H2O==== 2Zn(OH)42-。下列说法正确的是
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn + 4OH– − 2e–==== Zn(OH)
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
12.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A.简单离子半径:W
Z
13.下列有关电解质溶液的说法正确的是
A.向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中 减小
c(H+)
c(CH3COOH)
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大
c(CH3COO-)
c(CH3COOH)•c(OH-)
C.向盐酸中加入氨水至中性,溶液中 >1
c(NH4+)
c(Cl-)
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 不变
c(Cl-)
c(Br-)
第Ⅱ卷
三、非选择题:本卷包括必考题和选考题两部分。第22~32题为必考题,每个考生都必须作答。第33~40题为选考题,考生根据要求作答。
(一)必考题
26.(14分)
过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。学.科网.以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
石灰石
(含少量铁的氧化物)
双氧水和氨水
小火煮沸
①
盐酸
过滤
滤渣
滤液
CaCO3
碳酸铵溶液
氨水
过滤
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
白色结晶
稀盐酸、煮沸、过滤
②
滤液
CaCO3
过滤
氨水和双氧水
水浴③
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
27.(15分)
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为
5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子
SO42−
SO32−
NO3−
NO2−
Cl−
c/(mol·L−1)
8.35×10−4
6.87×10−6
1.5×10−4
1.2×10−5
3.4×10−3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
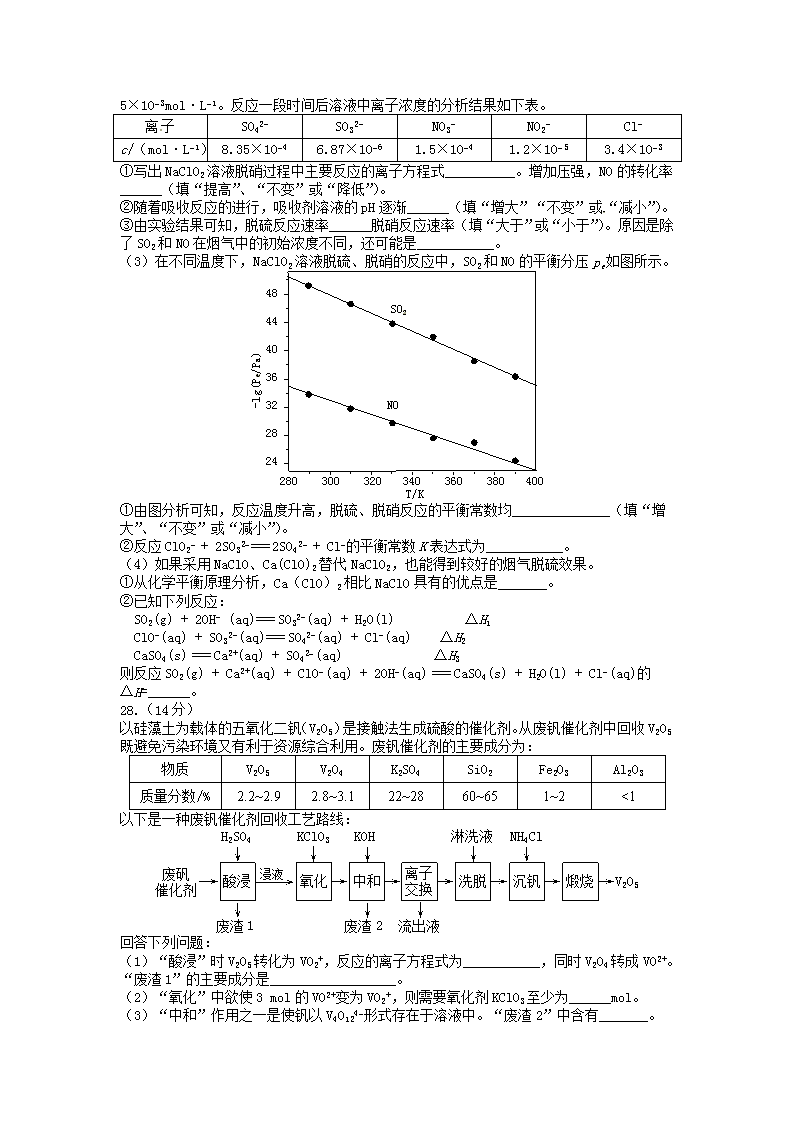
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
48
44
40
36
32
28
24
280 300 320 340 360 380 400
T/K
-lg(Pe/Pa)
SO2
NO
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2− + 2SO32−==== 2SO42− + Cl−的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g) + 2OH− (aq)==== SO32−(aq) + H2O(l) ΔH1
ClO−(aq) + SO32−(aq)==== SO42−(aq) + Cl−(aq) ΔH2
CaSO4(s) ==== Ca2+(aq) + SO42−(aq) ΔH3
则反应SO2(g) + Ca2+(aq) + ClO−(aq) + 2OH−(aq) ==== CaSO4(s) + H2O(l) + Cl−(aq)的ΔH=______。
28.(14分)
以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
以下是一种废钒催化剂回收工艺路线:
废矾
催化剂
酸浸
离子
交换
氧化
中和
洗脱
沉钒
煅烧
V2O5
浸液
H2SO4
KClO3
KOH
淋洗液
NH4Cl
废渣1
废渣2
流出液
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124−形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH + V4O124− R4V4O12 + 4OH−(ROH为
离子交换
洗脱
强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
(二)选考题:
36.[化学——选修2:化学与技术](15分)
聚合硫酸铁(PFS)是水处理中重要的絮凝剂。下图是以回收废铁屑为原料制备PFS的一种工艺流程。
废铁屑
PFS固体产品
[Fe2(OH)x(SO4)3 - ]y
x
2
粉
碎
机
减
压
蒸
发
酸
浸
槽
反
应
釜
聚
合
釜
过筛
固体残渣
氧化剂
酸
水+ 硫酸
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液,已知该样品中Fe的质量分数w,则B的表达式为__________
37.[化学——选修3:物质结构与性质](15分)
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol−1和MAs g·mol−1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
As
Ga
38.[化学——选修5:有机化学基础](15分)
端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—HR—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
A
C8H10
C16H10
CCl2CH3
C≡CH
CH3CH2Cl
AlCl3△
①
Cl2
光照
②
1)NaNH2
2)H2O
③
Glaser反应
④
B
C
D
E
回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4−二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物( )也可发生Glaser偶联反应生成聚合物,该聚合反
C≡CH
HC≡C
应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2−苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
参考答案
一、选择题
7.B 8.A 9.D 10.C 11.C 12. B 13. D
26. (14分)
(一)(1)调节溶液pH使Fe(OH)3沉淀过滤分离(每空1分,共2分)
(2)ade (3分)
(二)(3)酸除去溶液中的CO2
(4)CaCl2+2NH3·H2O+H2O2+6H2OCaO2·8H2O↓ +2NH4Cl 或CaCl2+2NH3·H2O+H2O2CaO2↓+2NH4Cl+2H2O (2分,1分,共3分)
(5)去除结晶表面水分(2分)
(6)工艺简单、操作方便纯度较低(每空1分,共2分)
27.(15分)
(1)亚氯酸钠(2分)
(2)①4NO+3ClO2—+5HO—=4NO3—+2H2O+3Cl— 提高 (2分,1分,共3分)
②减小(1分)③NO溶解度较低或脱硝反应活化能较高(每空1分,共2分)
(3)①减小(1分)②(2分)
(4)①形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高(2分)
②ΔH1+ΔH2-ΔH3 (2分)
28. (1)V2O5+2H+2VO2++H2O SiO2(每空2分,共4分)
(2)0.5(2分)
(3)Fe(OH)3和Al(OH)3(2分)
(4)碱(2分)
(5)K+(2分)
(6)2NH4VO3V2O5+2NH3↑+H2O↑(2分)
36.(1)Fe2O3·xH2O(1分)选取细小颗粒,学科&网增大反应物接触面积,提高“酸浸”反应速率(2分)
(2)H2SO4 Fe2O3·xH2O+6H+2Fe3++(x+3)H2O
(3)使Fe从+2价变成+3价 c(每空1分,共2分)
(4)形成氢氧化铁沉淀(2分)
(5)降低蒸发温度防止产物分解(2分)
(6)(3分)
37.[化学——选修3:物质结构与性质](15分)
(1)[Ar]3d104s24p3(1分)
(2)大于小于(每空2分,共4分)
(3)三角锥形 sp3(每空1分,共2分)
(4)GaF3为离子晶体,GaCl3为分子晶体(2分)
(5)学科.网原子晶体共价(每空2分,6分)
38.[化学——选修5:有机化学基础](15分)
(1)苯乙炔(每空1分,共2分)
(2)取代反应消去反应(每空1分,共2分)
(3) 4(2分,1分,共3分)
(4)(2分)
(5)(任意三种)(3分)
(6)(3分)