- 2021-05-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学大二轮优选习题 考前强化练20 化学综合实验题
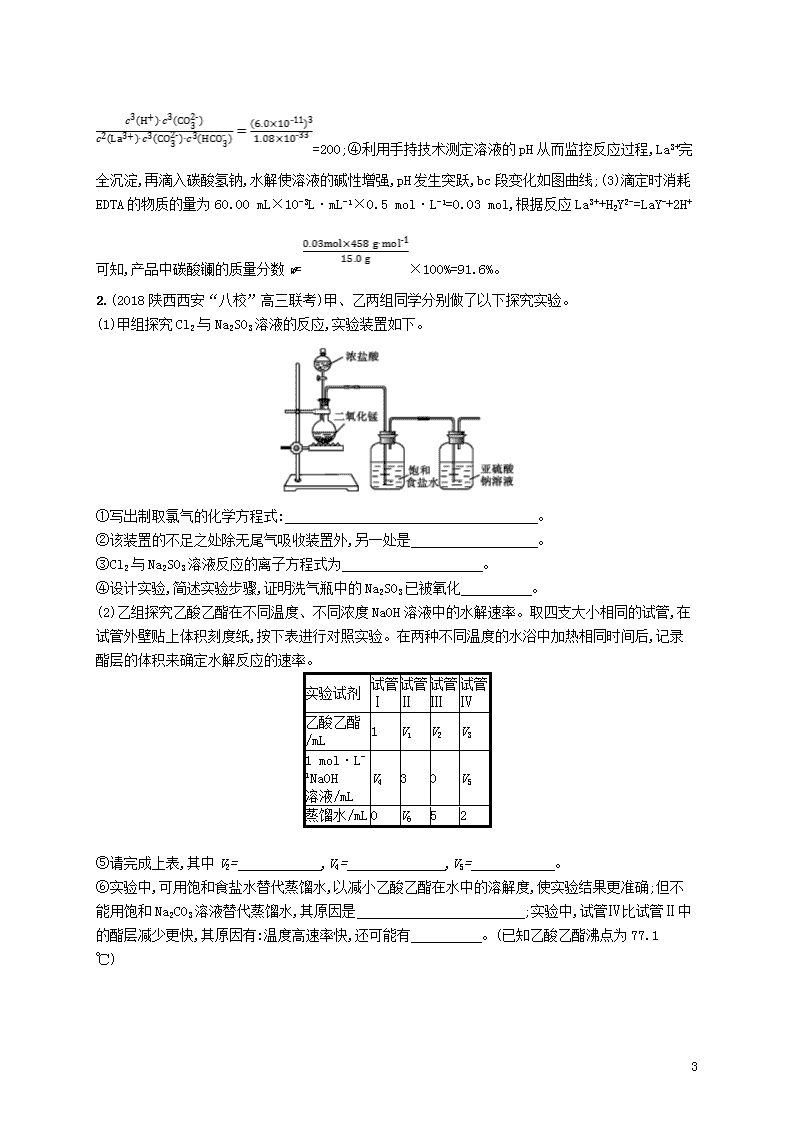
考前强化练20 化学综合实验题 1.(2018山东青岛高三模拟)碳酸镧咀嚼片是一种不含钙和铝的磷酸盐结合剂,用于慢性肾衰患者高磷血症的治疗。碳酸镧可由LaCl3为原料来制备,整个反应在较低的pH条件下进行,避免生成碱式碳酸镧[La(OH)CO3]。 (1)化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。 ①仪器X的名称为 ;检验装置甲气密性良好的方法是 。 ②实验中K1、K2打开的先后顺序为 ;为保证碳酸镧的纯度,实验过程中需要注意的问题有 。 (2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。 ①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,过程中会发生两个平行反应,其离子方程式为 和 。 ②选择碳酸氢钠溶液制备碳酸镧的优点是 (任写一条)。 ③T ℃时,碳酸镧的溶解度可表示为1.0×10-7 mol·L-1,HC的电离平衡常数为6.0×10-11。请计算反应2LaCl3+3NaHCO3La2(CO3)3↓+3NaCl+3HCl的平衡常数K= 。 ④利用手持技术测定溶液的pH从而监控反应过程,得到如图曲线。请说明bc段变化的原因 。 6 (3)碳酸镧(式量为458)质量分数的测定:准确称取15.0 g产品试样,溶于10.0 mL稀盐酸中,加入10 mL NH3-NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 mol·L-1EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-LaY-+2H+),消耗EDTA溶液60.00 mL。则产品中碳酸镧的质量分数w= 。 答案(1)①球形干燥管 关闭活塞K1,向球形漏斗中加水至漏斗内外形成液面差,一段时间后,液面差保持不变,说明气密性良好 ②先打开K2再打开K1 控制氨气(或CO2)通入量 (2)①2La3++3HCLa2(CO3)3+3H+ H++HCCO2↑+H2O ②碳酸氢钠溶液碱性相对较弱,可防止生成碱式碳酸镧[La(OH)CO3] ③200 ④La3+完全沉淀,再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃 (3)91.6% 解析(1)①仪器X的名称为球形干燥管;检验装置甲气密性的方法是关闭活塞K1,向球形漏斗中加水至漏斗内外形成液面差,一段时间后,液面差保持不变,说明气密性良好;②氨气是极易溶于水的气体,先通氨气,在碱性条件下再通入二氧化碳,溶解的量较大,故实验中先打开K2再打开K1;为保证碳酸镧的纯度,实验过程中需要控制氨气(或CO2)通入量;(2)①碳酸氢钠分别与La2+、H+反应,过程中发生两个平行反应的离子方程式为2La3++3HCLa2(CO3)3+3H+和H++HCCO2↑+H2O;②选择碳酸氢钠溶液制备碳酸镧的优点是碳酸氢钠溶液碱性相对较弱,可防止生成碱式碳酸镧[La(OH)CO3];③2LaCl3+3NaHCO3La2(CO3)3↓+3NaCl+3HCl的离子方程式为2La2++3HCLa2(CO3)3↓+3H+,T ℃时,碳酸镧的溶解度可表示为1.0×10-7 mol·L-1,则饱和溶液中c(La2+)=2c[La2(CO3)3]=2.0×10-7 mol·L-1,c(C)= 3c[La2(CO3)3]=3.0×10-7 mol·L-1,Ksp[La2(CO3)3]=c2(La3+)·c3(C)=(2.0×10-7 mol·L-1)2×(3.0×10-7 mol·L-1)3=1.08×10-33,HC的电离平衡常数为6.0×10-11,则反应的平衡常数K== 6 =200;④利用手持技术测定溶液的pH从而监控反应过程,La3+完全沉淀,再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃,bc段变化如图曲线;(3)滴定时消耗EDTA的物质的量为60.00 mL×10-3L·mL-1×0.5 mol·L-1=0.03 mol,根据反应La3++H2Y2-=LaY-+2H+可知,产品中碳酸镧的质量分数w=×100%=91.6%。 2.(2018陕西西安“八校”高三联考)甲、乙两组同学分别做了以下探究实验。 (1)甲组探究Cl2与Na2SO3溶液的反应,实验装置如下。 ①写出制取氯气的化学方程式: 。 ②该装置的不足之处除无尾气吸收装置外,另一处是 。 ③Cl2与Na2SO3溶液反应的离子方程式为 。 ④设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化 。 (2)乙组探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。 实验试剂 试管Ⅰ 试管Ⅱ 试管Ⅲ 试管Ⅳ 乙酸乙酯/mL 1 V1 V2 V3 1 mol·L-1NaOH 溶液/mL V4 3 0 V5 蒸馏水/mL 0 V6 5 2 ⑤请完成上表,其中V2= ,V4= ,V5= 。 ⑥实验中,可用饱和食盐水替代蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是 ;实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,其原因有:温度高速率快,还可能有 。(已知乙酸乙酯沸点为77.1 ℃) 6 答案(1)①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O ②没有加热装置 ③Cl2+S+H2O2Cl-+S+2H+ ④取少量洗气瓶中的液体置于干燥试管中,加入足量盐酸(滴加稀盐酸至不再产生气体),再滴加少量的氯化钡溶液,若产生白色沉淀,则证明已经被氧化 (2)⑤1 5 3 ⑥碳酸钠溶液水解显碱性,干扰了探究NaOH溶液对水解速率的影响 水浴加热接近乙酸乙酯的沸点,温度越高,乙酸乙酯挥发也越快,得不到正确结果 解析(1)①实验室利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,制取氯气的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;②浓盐酸与二氧化锰制取氯气的反应需要加热,氯气有毒,应该使用尾气吸收装置;③氯气与亚硫酸钠溶液反应生成硫酸钠和氯化氢,反应的离子方程式为Cl2+S+H2O2Cl-+S+2H+;④若洗气瓶中的Na2SO3已被氧化,则洗气瓶的溶液中应该存在硫酸根离子,检验方法为:取少量洗气瓶中的液体置于干燥试管中,加入足量盐酸(滴加稀盐酸至不再产生气体),再滴加少量的氯化钡溶液,若产生白色沉淀,则证明已经被氧化;(2)⑤乙组探究乙酸乙酯(沸点77.1 ℃)在不同温度、不同浓度NaOH溶液中的水解速率,四支试管中乙酸乙酯的体积都应该为1 mL,即V1=V2=V3=1;试管Ⅰ和试管Ⅲ中蒸馏水的体积不同,则探究的是氢氧化钠的浓度对乙酸乙酯水解的影响,还必须保证溶液总体积相等,则试管Ⅰ中氢氧化钠溶液体积应该为5 mL,即V4=5;结合总体积必须相等可知,试管Ⅳ和试管Ⅱ应该是探究温度对乙酸乙酯水解程度的影响,试管Ⅳ中氢氧化钠溶液体积应该为3 mL,即V5=3;⑥碳酸钠溶液水解显碱性,干扰了探究NaOH溶液对水解速率的影响,所以不能用饱和Na2CO3溶液替代蒸馏水;乙酸乙酯的沸点为77.1 ℃,水浴温度接近乙酸乙酯的沸点,温度越高,一方面反应速率加快,另一方面乙酸乙酯挥发也越快,导致试管中酯层减少速率加快,干扰了实验结果。 3.(2018陕西榆林高三模拟)三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33 ℃,沸点为73 ℃。实验室可用如图装置制取ICl3。 (1)仪器a的名称是 。 (2)制备氯气选用的药品为漂白粉固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为 。 (3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象: 。 (4)试剂X为 。 6 (5)氯气与单质碘需在温度稍低于70 ℃时反应,则装置D适宜的加热方式为 。 (6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0 g于烧杯中,加入适量水和过量KI晶体,充分反应生成I2(样品中杂质不反应)。写出反应的化学方程式 ;将所得溶液配制成100 mL待测液, 取25.00 mL待测液,用2.0 mol·L-1的Na2S2O3标准液滴定(I2+2S22I-+S4),以淀粉溶液作指示剂,达到终点时的现象为 ;重复滴定,实验数据记录如下: 滴定次数 待测液体 积/mL Na2S2O3标准液体积/mL 滴定前读数/mL 滴定后读数/mL 1 25.00 0.50 20.40 2 25.00 4.00 24.10 3 25.00 4.20 26.70 该样品中ICl3的质量分数为 (ICl3相对分子质量为233.5)。 答案(1)蒸馏烧瓶 (2)Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O (3)吸滤瓶中液面下降,长颈漏斗中液面上升 (4)碱石灰 (5)水浴加热 (6)ICl3+3KI2I2+3KCl 当加入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且在半分钟内不恢复蓝色 93.4% 解析(1)根据装置图可知仪器a的名称为蒸馏烧瓶;(2)漂白粉固体和浓盐酸反应生成氯化钙、氯气和水,化学方程式为Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O;(3)装置B也是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,吸滤瓶中液面下降,长颈漏斗中液面上升;(4)反应后剩余的氯气能够污染空气,不能排放到空气中,装置E为球形干燥管,装有固体药品碱石灰,可吸收多余的氯气,防止污染空气;(5)因水浴能简便控制加热的温度,且能使反应试管受热均匀,由于氯气与单质碘需在温度稍低于70 ℃下反应,应采取水浴加热;(6)ICl3样品中加入适量水和过量KI晶体,充分反应生成I2,同时生成碘化钾,反应的化学方程式为ICl3+3KI2I2+3KCl;以淀粉溶液作指示剂,达到终点时的现象为当加入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且在半分钟内不恢复蓝色;第3组溶液的体积与第1、2组相差比较大,舍去第3组,将第1、2组的平均值作为消耗溶液的体积,故消耗KMnO4溶液的体积为 mL=20.0 mL,令样品中ICl3的物质的量为x,则根据化学反应可得关系式: ICl3~2I2~4S2, 1 4 x 2 mol·L-1×20×10-3L 6 解得x=1×10-2 mol,该样品中ICl3的质量分数为:×100%=93.4%。 6查看更多