- 2021-05-13 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
独家高考化学一轮讲练析学案难溶电解质的溶解平衡
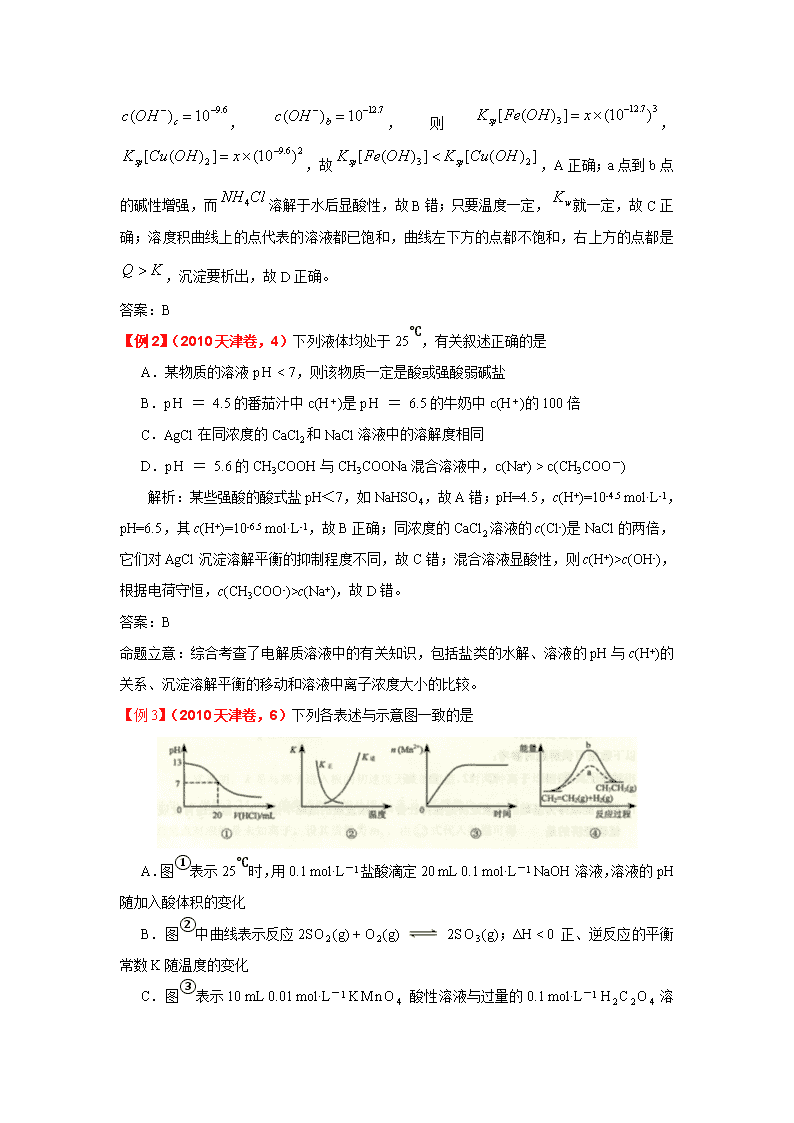
2011年高考化学一轮讲练析精品学案 第15讲 难溶电解质的溶解平衡 考点解读 1. 能描述沉淀溶解平衡,知道沉淀转化的本质 2. 了解难溶电解质的溶解平衡 基础过关 溶度积原理及其应用 1.了解沉淀溶解平衡的本质 ⑴难溶电解质的溶解平衡 在一定重要条件下,当沉淀与溶解的速度相等时,便达到固体难溶电解质与溶液中离子间的平衡状态。例如: BaSO4(s) Ba2+(aq) + SO42-(aq) ⑵溶度积:在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数,称为溶度积常数,简称溶度积。用符号Ksp表示。 对于AmBn型电解质来说,溶度积的公式是:Ksp=[An+]m[Bm+]n ① 溶度积与溶解度的关系 溶度积和溶解度都可以表示物质的溶解能力,溶度积的大小与溶解度有关,它反映了物质的溶解能力。 ② 溶度积规则,可以判断溶液中沉淀的生成和溶解。 ③ 离子积Qc与溶度积Ksp的区别与联系 某难溶电解质的溶液中任一情况下有关离子浓度的乘积Qc 当Qc<Ksp时,为不饱和溶液; 当Qc=Ksp时,为饱和溶液; 当Qc>Ksp时,为过饱和溶液。 2. 了解沉淀转化的原理 ⑴沉淀的生成:可通过调节溶液PH或加入某些沉淀剂。 ⑵沉淀的溶解: ①生成弱电解质。如生成弱酸、弱碱、水或微溶气体使沉淀溶解。难溶物的Ksp越大、生成的弱电解质越弱,沉淀越易溶解。如CuS、HgS、As2S3等Ksp太小即使加入浓盐酸也不能有效降低S2-的浓度使其溶解。 ②发生氧化还原反应,即利用发生氧化还原反应降低电解质离子浓度的方法使沉淀溶解。 ③生成难电离的配离子,指利用络合反应降低电解质离子浓度的方法使沉淀溶解。 ⑶沉淀的转化:把一种难溶电解质转化为另一种难溶电解质的过程叫沉淀的转化。 在含有沉淀的溶液中加入另一种沉淀剂,使其与溶液中某一离子结合成更难溶的物质,引起一种沉淀转变成另一种沉淀。例如: CaSO4(s)+Na2CO3 = CaCO3(s)+Na2SO4 在氯化银饱和溶液中,尚有氯化银固体存在,当分别向溶液中加入下列物质时,将有何种变化? 在氯化银饱和溶液中,尚有氯化银固体存在,当分别向溶液中加入下列物质时,将有何种变化? 加入物质 平衡移动方向 AgCl溶解度 溶液中C(Ag+) 溶液中C(Cl-) 发生变化的原因 0.1mol·L-1HCl 0.1mol·L-1AgNO3 KNO3(s) 0.1mol·L-1NH3·H2O H2O 【解析】AgCl(s)Ag+(aq) + Cl-(aq) 加入物质 平衡移动方向 AgCl溶解度 溶液中C(Ag+) 溶液中C(Cl-) 发生变化的原因 0.1mol·L-1HCl 向左 减小 减小 增大 同离子效应 0.1mol·L-1AgNO3 向左 减小 增大 减小 同离子效应 KNO3(s) 向右 增大 增大 增大 盐效应 0.1mol·L-1NH3·H2O 向右 增大 减小 增大 形成配合物 H2O 向右 不变 不变 不变 稀释作用 典型例题 【例1】(2010山东卷,15)某温度下,分别在溶液中达到沉淀溶解平衡后,改变溶液,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是 A. B.加适量固体可使溶液由点变到点 C.两点代表的溶液中与乘积相等 D.、分别在、两点代表的溶液中达到饱和 解析:b、c两点金属阳离子的浓度相等,都设为x, ,,则,,故,A正确;a点到b点的碱性增强,而溶解于水后显酸性,故B错;只要温度一定,就一定,故C正确;溶度积曲线上的点代表的溶液都已饱和,曲线左下方的点都不饱和,右上方的点都是,沉淀要析出,故D正确。 答案:B 【例2】(2010天津卷,4)下列液体均处于25℃,有关叙述正确的是 A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐 B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍 C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-) 解析:某些强酸的酸式盐pH<7,如NaHSO4,故A错;pH=4.5,c(H+)=10-4.5 mol·L-1,pH=6.5,其c(H+)=10-6.5 mol·L-1,故B正确;同浓度的CaCl2溶液的c(Cl-)是NaCl的两倍,它们对AgCl沉淀溶解平衡的抑制程度不同,故C错;混合溶液显酸性,则c(H+)>c(OH-),根据电荷守恒,c(CH3COO-)>c(Na+),故D错。 答案:B 命题立意:综合考查了电解质溶液中的有关知识,包括盐类的水解、溶液的pH与c(H+)的关系、沉淀溶解平衡的移动和溶液中离子浓度大小的比较。 【例3】(2010天津卷,6)下列各表述与示意图一致的是 A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 B.图②中曲线表示反应2SO2(g) + O2(g) 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化 D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 解析:酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错;正逆反应的平衡常数互为倒数关系,故B正确;反应是放热反应,且反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,C错;反应是放热反应,但图像描述是吸热反应,故D错。 答案:B 命题立意:综合考查了有关图像问题,有酸碱中和滴定图像、正逆反应的平衡常数图像,反应速率图像和能量变化图像。 【例4】(2009浙江卷10)已知:25°C时,,。下列说法正确的是 ( ) A.25°C时,饱和溶液与饱和溶液相比,前者的大 B.25°C时,在的悬浊液加入少量的固体,增大 C.25°C时,固体在20ml0.01 mol·氨水中的比在20mL0.01mol· 溶液中的小 D.25°C时,在的悬浊液加入溶液后,不可能转化成为 答案 B 解析 Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,错; A项, NH4+ 可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正 向移动,C(Mg2+)增大,正确。 B项, Ksp仅与温度有关,故错; D项,由于MgF2的溶度积更小,所以沉淀会向更难溶的方向进行,即可以生成MgF2沉淀,正确。 【例5】(2010浙江卷,26) (15分)已知: ①25℃时弱电解质电离平衡数:Ka(CH3COOH)=,Ka(HSCN)=0.13 ;难溶电解质的溶度积常数:Kap(CaF2)= ②25℃时,mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: 请根据以下信息回答下旬问题: 图2 (1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”) (2)25℃时,HF电离平衡常数的数值Ka ,列式并说明得出该常数的理由 。 (3) mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。 试题解析: 给信息多,可以对信息进行初步分析,也可以根据问题再去取舍信息。 信息分析:①HSCN比CH3COOH易电离,CaF2难溶。②F-PH=6,PH=0时以HF存在。 F-与HF总量不变。 问题引导分析(解题分析与答案): (1)相同的起始条件,只能是因为两种酸的电离度不同导致溶液中起始反应时H+ 浓度不同引起反应速率的不同。反应结束后,溶质为CH3COONa和NaSCN,因CH3COOH酸性弱于HSCN,故CH3COONa水解程度大,c(CH3COO-)<c(SCN-)。 (2)HF电离平衡常数Ka= 【c(H+)* c(F-)】/ c(HF),其中c(H+)、 c(F-)、 c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4, c(F-)=1.6×10-3、 c(HF)=4.0×10-4。Ka=0.4×10-3。 (3)PH=4.0,则c(H+)=10-4,此时:根据HF电离,产生的c(F-)=1.6×10-3,而溶 液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Kap(CaF2)= ,此时有少量沉淀产生。 教与学提示: 本题比较全面地考察了电离平衡常数与溶解平衡常数的知识内容。要求学生会读图,要掌握平衡常数的表达式和含义:平衡时的溶液中的各种相关离子的浓度。要理解溶解平衡的含义:达到饱和溶液时的最大值,大于则沉淀析出,小于则不析出。明确平衡常数是随温度变化的,不随溶液中的离子浓度的实际值而发生变化。在平衡常数的教学中,可以设计一个关于化学平衡常数、电离平衡常数、沉淀溶解平衡常数的专题,有比较,有触类旁通地系统地研究和学习平衡常数问题。 26题再一次说明,平衡常数的题目不再只是说要考,而总是回避大题的内容。难点突破在高考复习中意义重大。也再一次说明,高考的热点往往和大学基础要求有联系。 【例6】(2010全国卷1,28) (15分)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验: ①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾; ②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解; ③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出; ④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。 根据上述实验信息,请回答下列问题: (1) 能确定溶液是(写出溶液标号与相应溶质的化学式): (2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法: 【解析】(I)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(II)由题干和①步操作可知A为氨水; (III)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+;AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(IV)由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定(V)同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3 结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案 【答案】(1)A NH3·H2O或NH3 ;E H2SO 4 F AgNO3 C BaCl2 若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分 (2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液 D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液 【命题意图】考查学生的分析与综合能力,涉及到无机元素及其化合物的性质,离子反应,未知物的推断,物质的检验,常见物质量多与量少的反应不同,现象不同等,此题综合性强,难度大,区分度很好,是一道不可多得的经典好题! 【点评】此题一改过去每年元素推断的通病,思维容量显著增大能力要求高,与2008年全国卷I理综28题有得一拼,比2009年的第29题出得高超一些,相比以前的无机推断显然有质的飞跃,看到命题人在进步!但是此题是不是一点瑕疵没有呢?x显然不是,例如本题条件很宽广,没太明显的限制条件,因而答案是丰富多彩的,这不会给阅卷者带来喜出望外,只会增加难度,不好统一评分标准,也就缺乏公平性!特别是B和C上就有争议,如B还可能是(NH4)2CO3,C还可能是BaBr2、BaI2等,当然限制一下沉淀颜色就排除了C的歧义! 难溶电解质的溶解平衡单元测试 一、选择题(每小题只有1个正确答案) 1.AgCl(s)Ag+ + Cl-,平衡时,[Ag+] [Cl-]=Ksp ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中[Ag+]大小顺序为 A、③①②④ B、④①②③ C、①②③④ D、④③②① 2.下列说法正确的是 A、在硫酸铜饱和溶液中,加入少量的无水硫酸铜粉末,饱和溶液的质量增加 B、同温同压下,同种溶质的不饱和溶液浓度不一定比饱和溶液浓度小。 C、在某物质的饱和溶液中加入其它任何溶质都不能溶解。 D、某物质的饱和溶液在温度升高后若溶液质量不变,则质量百分比浓度也不变。 3.一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH–(aq) 向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是 A、溶液中Ca2+离子数目减少 B、溶液中c(Ca2+)增大 C、溶液的pH增大 D、溶液中溶质的质量分数增大 4.从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测 A、HR应为红色 B、HR应为蓝色 C、HR应为无色 D、R一应为红色 5.常温下,向0.1mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的质量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同的阶段的溶液,下列有关说法中不正确的是 A. 溶液的pH:a查看更多