- 2021-05-13 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学第二轮复习 专题 原子结构,元素周期律,元素周期表学案 鲁科版
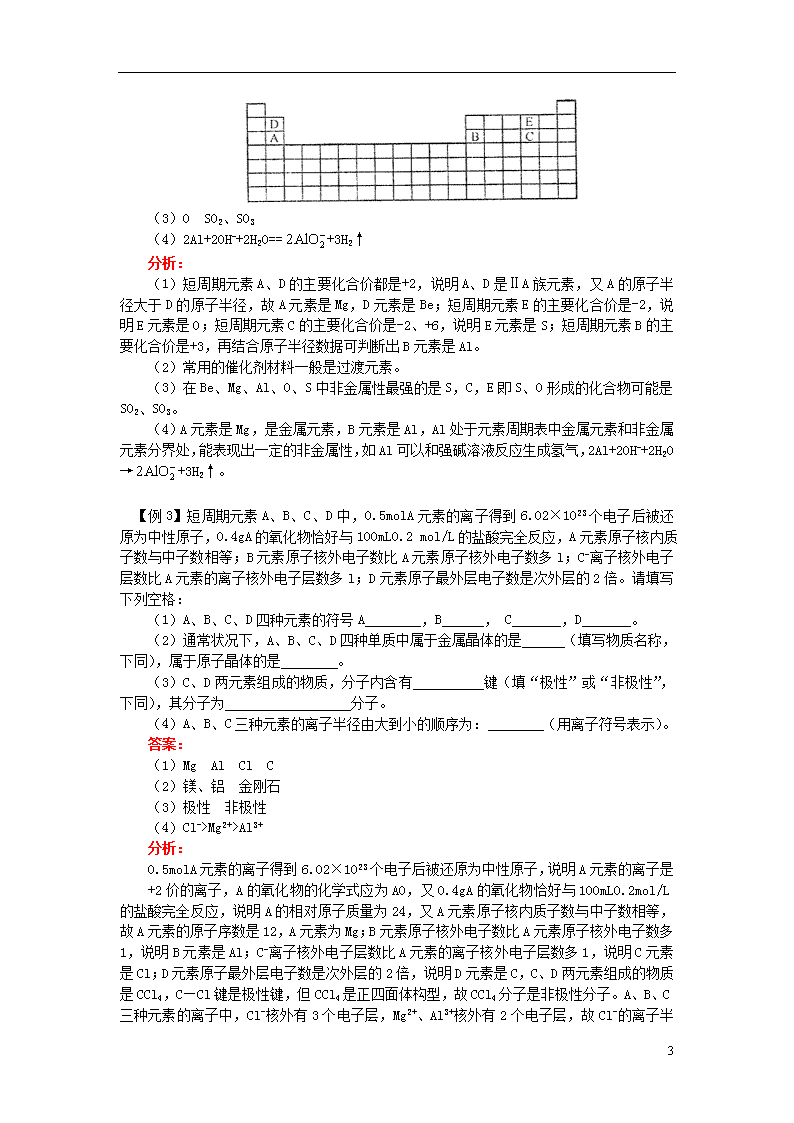
原子结构,元素周期律,元素周期表 【本讲教育信息】 一、教学内容: 高考第二轮复习《专题6》 二、教学目的 1、能画出1~18号元素的原子结构示意图。 2、能结合有关数据和实验事实(原子核外电子排布、原子半径、元素的主要化合价、最高价氧化物对应的水化物的酸碱性、元素的金属性与非金属性等)认识元素周期律。 3、了解原子结构与元素性质的关系。 4、知道周期与族的概念,能描述元素周期表的结构。认识元素在周期表中的位置与其原子的电子层结构的关系。 5、知道金属、非金属在元素周期表中的位置及其性质的递变规律。 6、知道元素电离能的涵义。 7、认识同一周期、同一主族中元素电离能的变化规律,了解元素电离能和原子核外电子排布的关系。 8、能应用元素电离能说明原子或离子失去电子的难易、元素主要化合价等的周期性变化。 9、知道元素电负性的涵义。 10、了解元素电负性和元素在化合物中吸引电子能力的关系,认识同一周期、同一主族中元素电负性的变化规律。 11、能根据元素电负性大小说出主族元素的金属性和非金属性的强弱。 12、认识原子结构与元素周期律的关系,了解元素周期律的应用价值。 三、知识网络 1、元素周期律 2、周期表的结构 4 【典型例题】 【例l】下列说法中正确的是( ) A、ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子 B、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 C、原子及其离子的核外电子层数等于该元素所在的周期数 D、所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 答案:B 分析: ⅠA、ⅡA族元素的原子序数增加,原子半径增大,元素的金属性增强,越易失去电子;元素周期表中从ⅢB族到ⅡB族10个纵行的元素总称过渡元素,全部是金属元素;原子的核外电子层数等于该元素所在的周期数,某些原子失去电子形成的阳离子的核外电子层数小于该元素所在的周期数;所有主族元素的原子,形成单原子阳离子时的化合价和它的族序数相等,形成单原子阴离子时的化合价等于它的族序数减8或它的族序数减2。 【例2】元素周期表是学习化学的重要工具,它包含许多信息和规律。下表所列是五种短周期的原子半径及主要化合价: 元素代号 A B C D E 原子半径/nm 0.16 0.143 0.102 0.089 0.074 主要化合价 +2 +3 +6,-2 +2 -2 (1)用元素代号标出它们在周期表中对应位置。 (2)在上面的元素周期表中通常寻找催化剂材料的区域,用粗线标出。 (3)五种元素中非金属性最强的是 (填元素符号),C、E形成化合物为 (填化学式)。 (4)证明B元素与A元素在性质上有明显不同的离子方程式为 。 答案: (1)、(2) 4 (3)O SO2、SO3 (4)2Al+2OH-+2H2O==+3H2↑ 分析: (1)短周期元素A、D的主要化合价都是+2,说明A、D是ⅡA族元素,又A的原子半径大于D的原子半径,故A元素是Mg,D元素是Be;短周期元素E的主要化合价是-2,说明E元素是O;短周期元素C的主要化合价是-2、+6,说明E元素是S;短周期元素B的主要化合价是+3,再结合原子半径数据可判断出B元素是Al。 (2)常用的催化剂材料一般是过渡元素。 (3)在Be、Mg、Al、O、S中非金属性最强的是S,C,E即S、O形成的化合物可能是SO2、SO3。 (4)A元素是Mg,是金属元素,B元素是Al,Al处于元素周期表中金属元素和非金属元素分界处,能表现出一定的非金属性,如Al可以和强碱溶液反应生成氢气,2Al+2OH-+2H2O→+3H2↑。 【例3】短周期元素A、B、C、D中,0.5molA元素的离子得到6.02×1023个电子后被还原为中性原子,0.4gA的氧化物恰好与100mL0.2 mol/L的盐酸完全反应,A元素原子核内质子数与中子数相等;B元素原子核外电子数比A元素原子核外电子数多l;C-离子核外电子层数比A元素的离子核外电子层数多l;D元素原子最外层电子数是次外层的2倍。请填写下列空格: (1)A、B、C、D四种元素的符号A ,B , C ,D 。 (2)通常状况下,A、B、C、D四种单质中属于金属晶体的是 (填写物质名称,下同),属于原子晶体的是 。 (3)C、D两元素组成的物质,分子内含有 键(填“极性”或“非极性”,下同),其分子为 分子。 (4)A、B、C三种元素的离子半径由大到小的顺序为: (用离子符号表示)。 答案: (1)Mg Al Cl C (2)镁、铝 金刚石 (3)极性 非极性 (4)Cl->Mg2+>Al3+ 分析: 0.5molA元素的离子得到6.02×1023个电子后被还原为中性原子,说明A元素的离子是 +2价的离子,A的氧化物的化学式应为AO,又0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应,说明A的相对原子质量为24,又A元素原子核内质子数与中子数相等,故A元素的原子序数是12,A元素为Mg;B元素原子核外电子数比A元素原子核外电子数多1,说明B元素是Al;C-离子核外电子层数比A元素的离子核外电子层数多1,说明C元素是Cl;D元素原子最外层电子数是次外层的2倍,说明D元素是C,C、D两元素组成的物质是CCl4,C—Cl键是极性键,但CCl4是正四面体构型,故CCl4分子是非极性分子。A、B、C三种元素的离子中,Cl-核外有3个电子层,Mg2+、Al3+核外有2个电子层,故Cl- 4 的离子半径较大,又Mg2+、Al3+具有相同的核外电子排布,核电荷数Al3+大于Mg2+,离子半径Mg2+>Al3+,故A、B、C三种元素的离子半径由大到小的顺序为Cl->Mg2+>Al3+。 【例4】有X、Y、Z三种元素,其原子核外均有3个电子层。其中X元素有2种氧化物,XO2和XnOm。在XO2中X元素的含量为50%,且X元素原子中质子数等于中子数。X元素与Y元素化合时能形成Y2X型化合物。Z元素的单质可以与X元素的单质化合成Z2X3的化合物。根据以上事实推断: (1)X、Y、Z的元素符号。 (2)XO2、XnOm、Z2X3、Y2X的化学式。 答案: (1)X:S Y:Na Z:Al (2)XO2:SO2 XnOm:SO3 Z2X3:Al2S3 Y2X:Na2S 分析: 解“构—位—性”三结合,这类题的一般思路是:原子结构决定元素在周期表中的位置,而由元素位置和原子结构又可推断元素及化合物的性质。在此题中由第一句知X、Y、Z三种元素在第三周期,是Na、Mg、Al、Si、P、S、Cl、Ar八种元素之中的三种。再由XO2中X的含量为50%算出X的相对原子质量,由于质子数与中子数相等,计算X的质子数,确定X。 所以X的质子数: X为硫元素。 与硫生成Y2S化合物,Y定为钠元素,与硫生成Z2X3化合物,Z定为铝元素。 4查看更多