- 2021-05-13 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新课标高考化学卷
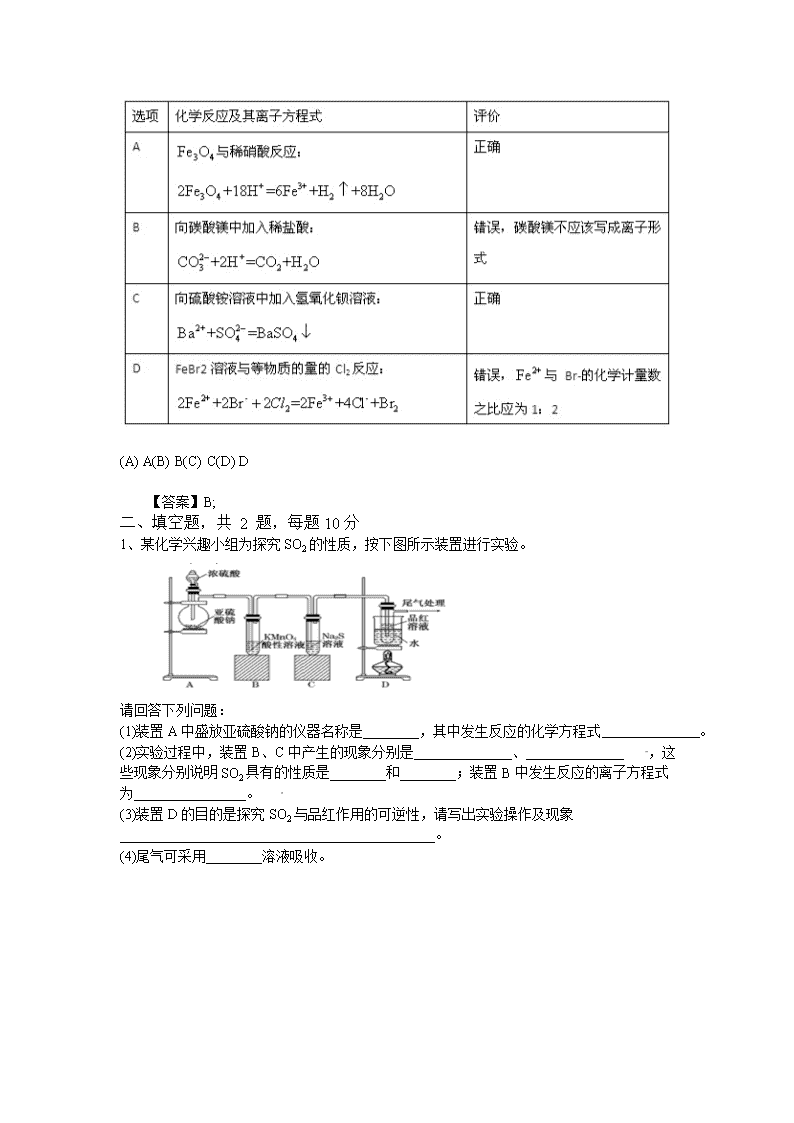
2010年新课标高考化学卷 一、单项选择题,共 7 题,每题5分 1、下列各项表达式中正确的是( ) (A) Na2O2的电子式为 (B) 106 g的乙醇和丙醇混合液完全燃烧生成的CO2为112 L(标准状况) (C) 在氮原子中,质子数为7而中子数不一定为7 (D) Cl-的结构示意图为 【答案】C; 2、分子式为C3H6Cl2的同分异构体共有(不考虑立体异构)( ) (A) 3种(B) 4种 (C) 5种(D) 6种 【答案】B; 3、下列各组中的反应,属于同一反应类型的是( ) (A) 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 (B) 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 (C) 由氯代环己烷消去制环己烯;由丙烯加溴制 二溴丙烷 (D) 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 【答案】D; 【解析】考查有机反应类型的判断。选项A中前者是取代反应,后者是加成反应;选项B中前者是取代反应,后者是氧化反应;选项C中前者是消去反应,后者是加成反应;选项D中都是取代反应,所以答案选D。 4、把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( ) (A) (B) (C) (D) 【答案】D; 5、己知:HCN(aq)与NaOH(aq)反应的VH=-12.1KJgmol-1 ; 与 反应的 。则HCN在水溶液中电离的VH等于( ) (A) (B) (C) (D) 【答案】C; 6、根据右图,可判断出下列离子方程式中错误的是 (A) (B) (C) (D) 【答案】A; 7、下表中评价合理的是( ) (A) A(B) B(C) C(D) D 【答案】B; 二、填空题,共 2 题,每题10分 1、某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。 请回答下列问题: (1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式 。 (2)实验过程中,装置B、C中产生的现象分别是______________、______________ ,这些现象分别说明SO2具有的性质是________和________;装置B中发生反应的离子方程式为________________。 (3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_____________________________________________。 (4)尾气可采用________溶液吸收。 【答案】 (3)品红溶液褪色后;关闭分液漏斗的旋塞;点燃酒精灯加热;溶液恢复为红色 (4)NaOH ; 2、某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有 、 ; (2)硫酸铜溶液可以加快氢气生成速率的原因是 ; (3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4中溶液,可与实验中CuSO4溶液起相似作用的是 ; (4)要加快上述实验中气体产生的速率,还可采取的措施有 、 (答两种); (5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。 ①请完成此实验设计,其中:V1= ,V6= ,V9= ; ②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色; ③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。 【答案】; 三、解答题,共 4 题,每题10分 1、物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。 请回答下列问题: (1)写出下列物质的化学式:B 、E 、G ; (2)利用电解可提纯C物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 ; (3)反应②的化学方程式是 。 (4)将0. 23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则B的平衡浓度 (填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”)。 【答案】(1)设粒子的发射速度为 ,粒子做圆周运动的轨道半径为R,由牛顿第二定律和洛仑兹力公式,得 由①式得 ②当 时,在磁场中运动时间最长的粒子,其轨迹是圆心为C的圆弧,圆弧与磁场的上边界相切,如图所示。设该粒子在磁场运动的时间为t,依题意 ,得 ③ ; 2、水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题: (1)天然水中溶解的气体主要有 、 。 (2)天然水在净化处理过程中加入的混凝剂可以是 ,其净水作用的原理是_____。 (3)水的净化和软化的区别是 。 (4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为 。 (5)若(4)中的天然水还含有c =8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 g,后加入Na2CO3g 。 【答案】(1)O2 CO2(或氮气) (2)明矾、硫酸铝、硫酸铁、硫酸亚铁 铝盐(或铁盐)等在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的(3)水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子(4)10° (5)740 1484; 3、PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,以下是某研究小组开发的生产PC的合成路线: 因而得到了广泛的应用。 已知以下信息: ①A可使溴的CCl4溶液褪色; ②B中有五种不同化学环境的氢; ③C可与FeCl3溶液发生显色反应: ④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。 请回答下列问题: (1)A的化学名称是 ; (2)B的结构简式为——; (3)C与D反应生成E的化学方程式为 ; (4)D有多种同分异构体,其中能发生银镜反应的是 (写出结构简式); (5)B的同分异构体中含有苯环的还有 种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是 (写出结构简式)。 【答案】(1)丙烯(2) (3) (4) (5)7 ; 4、主要元素W、X、Y、Z的原子序数一次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题: (1)W元素原子的L层电子排布式为 ,W3分子的空间构型为 ; (2)X单质与水发生主要反应的化学方程式为 ; (3)化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有 ,O—C—O的键角约为 ; (4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z= ; (5)含有元素Z的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。 【答案】(1) 形(2) (3)MgO 晶格能大 和 (4)3:1:1 (5)激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量;查看更多