- 2021-05-13 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
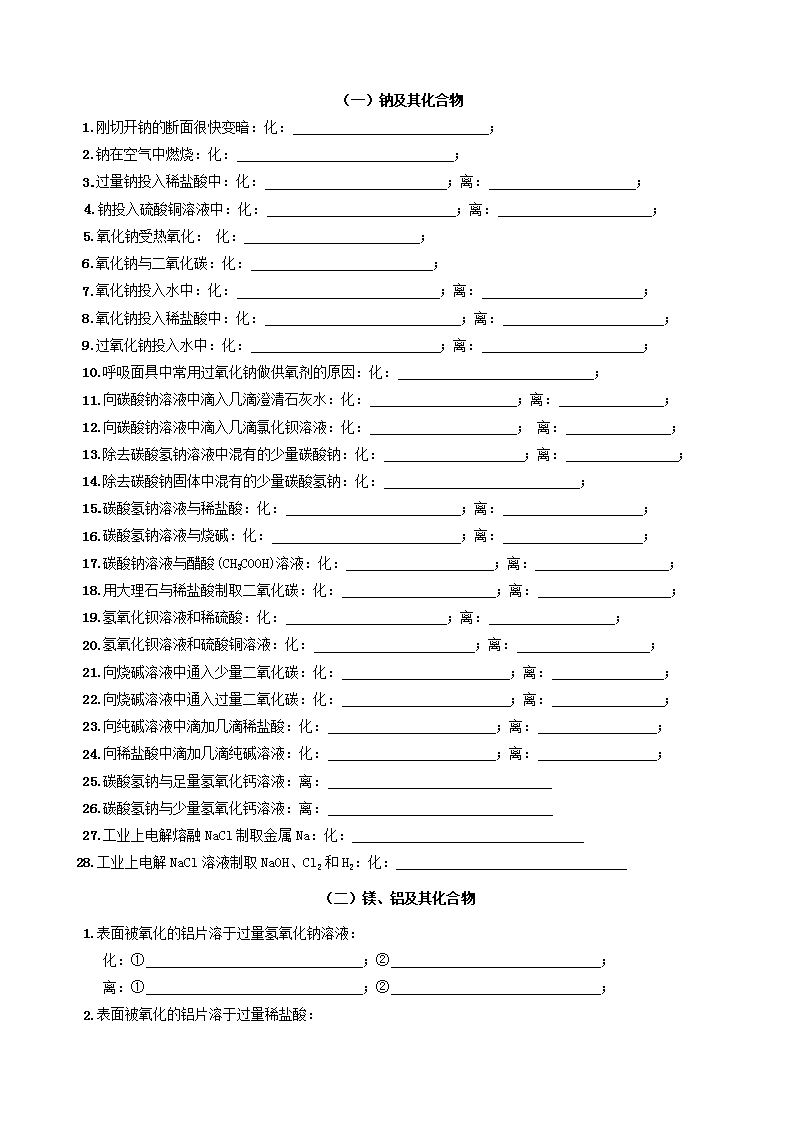
高考金属及其化合物化学方程式练习版
(一)钠及其化合物 1.刚切开钠的断面很快变暗:化: ; 2.钠在空气中燃烧:化: ; 3.过量钠投入稀盐酸中:化: ;离: ; 4.钠投入硫酸铜溶液中:化: ;离: ; 5.氧化钠受热氧化: 化: ; 6.氧化钠与二氧化碳:化: ; 7.氧化钠投入水中:化: ;离: ; 8.氧化钠投入稀盐酸中:化: ;离: ; 9.过氧化钠投入水中:化: ;离: ; 10.呼吸面具中常用过氧化钠做供氧剂的原因:化: ; 11.向碳酸钠溶液中滴入几滴澄清石灰水:化: ;离: ; 12.向碳酸钠溶液中滴入几滴氯化钡溶液:化: ; 离: ; 13.除去碳酸氢钠溶液中混有的少量碳酸钠:化: ;离: ; 14.除去碳酸钠固体中混有的少量碳酸氢钠:化: ; 15.碳酸氢钠溶液与稀盐酸:化: ;离: ; 16.碳酸氢钠溶液与烧碱:化: ;离: ; 17.碳酸钠溶液与醋酸(CH3COOH)溶液:化: ;离: ; 18.用大理石与稀盐酸制取二氧化碳:化: ;离: ; 19.氢氧化钡溶液和稀硫酸:化: ;离: ; 20.氢氧化钡溶液和硫酸铜溶液:化: ;离: ; 21.向烧碱溶液中通入少量二氧化碳:化: ;离: ; 22.向烧碱溶液中通入过量二氧化碳:化: ;离: ; 23.向纯碱溶液中滴加几滴稀盐酸:化: ;离: ; 24.向稀盐酸中滴加几滴纯碱溶液:化: ;离: ; 25.碳酸氢钠与足量氢氧化钙溶液:离: 26.碳酸氢钠与少量氢氧化钙溶液:离: 27.工业上电解熔融 NaCl 制取金属 Na:化: 28.工业上电解 NaCl 溶液制取 NaOH、Cl2 和 H2:化: (二)镁、铝及其化合物 1.表面被氧化的铝片溶于过量氢氧化钠溶液: 化:① ;② ; 离:① ;② ; 2.表面被氧化的铝片溶于过量稀盐酸: 化:① ;② ; 离:① ;② ; 3.制备氢氧化铝 (1)往氯化铝溶液中加过量氨水:离: ; (2)往偏铝酸钠溶液中通过量二氧化碳:离: ; 4.氢氧化铝受热分解:化: ; 5.铝盐的性质 往氯化铝溶液中逐滴滴加烧碱溶液,先产生白色胶状沉淀,后沉淀逐渐溶解,最后得到无色透明溶液。 ①离: ;②离: ; 6.偏铝酸盐的性质 往偏铝酸钠溶液中逐滴滴加稀盐酸,先产生白色胶状沉淀,后沉淀逐渐溶解,最后得到无色透明溶液。 ①离: ;②离: ; 7.工业上用电解法制取铝:化: ; 8.以铝粉和氧化铁为铝热剂进行的铝热反应: ; 以铝粉和磁性氧化铁为铝热剂进行的铝热反应: ; 9. A1 与 CuSO4 溶液反应的化学方程式为: ; 10.明矾净水的原理:离: ; 11.MgCO3 中滴加盐酸的化学方程式为: ; 12.Mg 与热水反应的化学方程式:_____________________________________ 13. MgCl2 中滴加过量烧碱溶液的离子方程式为: ; (三)铁及其化合物 1、铁与非金属单质反应: (1) Fe 在纯 O2 中燃烧:化: ; (2) Fe 与 S 的反应:化: ; (3) Fe 与 Cl2 点燃:化: ; (4) Fe 与 I2 的反应:化: ; 2、铁与水反应: (1)与水蒸汽反应:化: ; (2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。 原电池反应:负极: 正极: 总反应: 后续反应: 3、铁与酸反应: (1)与非氧化性酸 ①铁和稀盐酸:化: ; ②铁和稀硫酸:化: ;离: ; (2)与氧化性酸(与浓硫酸、稀硝酸、浓硝酸) ①常温下,浓硫酸和浓硝酸会使 、 钝化,加热反应。 ②铁与浓硫酸:化: ; ③铁与足量浓硝酸:化: ;离: ; ④少量铁与稀硝酸:化: ;离: ; ⑤过量 Fe 与稀硝酸:化: ;离: ; 4.铁与盐溶液反应: (1)铁和氯化铜溶液:化: ;离: ; (2)除去 FeCl2 溶液中的 FeCl3:化: ;离: ; 5.Fe3O4 粉末和稀盐酸:化: ;离: ; 6. CO 还原磁性氧化铁(工业炼铁):化: ; 7. CO 还原氧化铁(工业炼铁):化: ; 8. 氧化铁和 Al 做铝热剂的铝热反应:化: ; 9.向 FeCl2 溶液中通 Cl2:化: ;离: ; 10. 向 Fe(NO3)2 溶液中滴加稀硝酸:化: ;离: ; 11.向硫酸亚铁溶液滴加过量氨水,生成白色沉淀,迅速变灰绿色,最终变成红褐色: 生成白色沉淀, 化: ;离: ; 白色沉淀迅速变灰绿色最终变成红褐色,化:_______________________________ 12.用氯化铁溶液制作铜制印刷电路板: 化: ;离: ; 13.Fe3+ 和 I-不能大量共存,离:____________________________ 14. Fe3+ 和 S2-不能大量共存,离:____________________________ 15.Fe3+的检验: (1)常用硫氰化钾溶液:离: ; (2)高浓度时加氢氧化钠溶液:离: ; 16.Fe2+的检验: (1)常用:先滴加硫氰化钾溶液,观察后,再加氯水: 现象: ; 化:① ;② ; 离:① ;② ; (2)高浓度时可以加氢氧化钠溶液: 现象: ; 化:① ; ② ; (3)当 Fe2+和 Fe3+共存时,用酸性高锰酸钾,现象是_______________________________ 配平离子方程式: Fe2+ + MnO4 - + H+ = Fe3++ Mn2+ + H2O (四)铜及其化合物的化学方程式 一、铜 1、铜与非金属的反应 与氧气反应: 与氯气反应 与硫反应(产物为硫化亚铜) 3、与酸的反应 铜与非氧化性酸(如盐酸、稀硫酸等)不反应。 铜与强氧化性酸(如浓硫酸、浓、稀硝酸等)能反应,但不生成氢气。 与浓硫酸反应 与浓硝酸反应 与稀硝酸反应的离子方程式 4、与盐溶液的反应 与硝酸银溶液反应的离子方程式 、 与氯化铁溶液反应离子方程式 二、铜的冶炼 湿法炼铜(铁和硫酸铜反应) 电解精炼铜是如何除去 Ag、Au、Fe、Zn 等杂质的? 电解精炼铜时,阳极材料: 阴极材料: 电解质溶液: 电极反应(主要电极反应式): 阳极 阴极 三、铜的重要化合物 1、CuO CuO 为黑色,而 Cu2O 为红色。 一氧化碳还原氧化铜 2、Cu(OH)2 蓝色沉淀 氢氧化铜生成的离子方程式 氢氧化铜受热分解查看更多