- 2021-05-13 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考复习归纳初中化学方程式大全
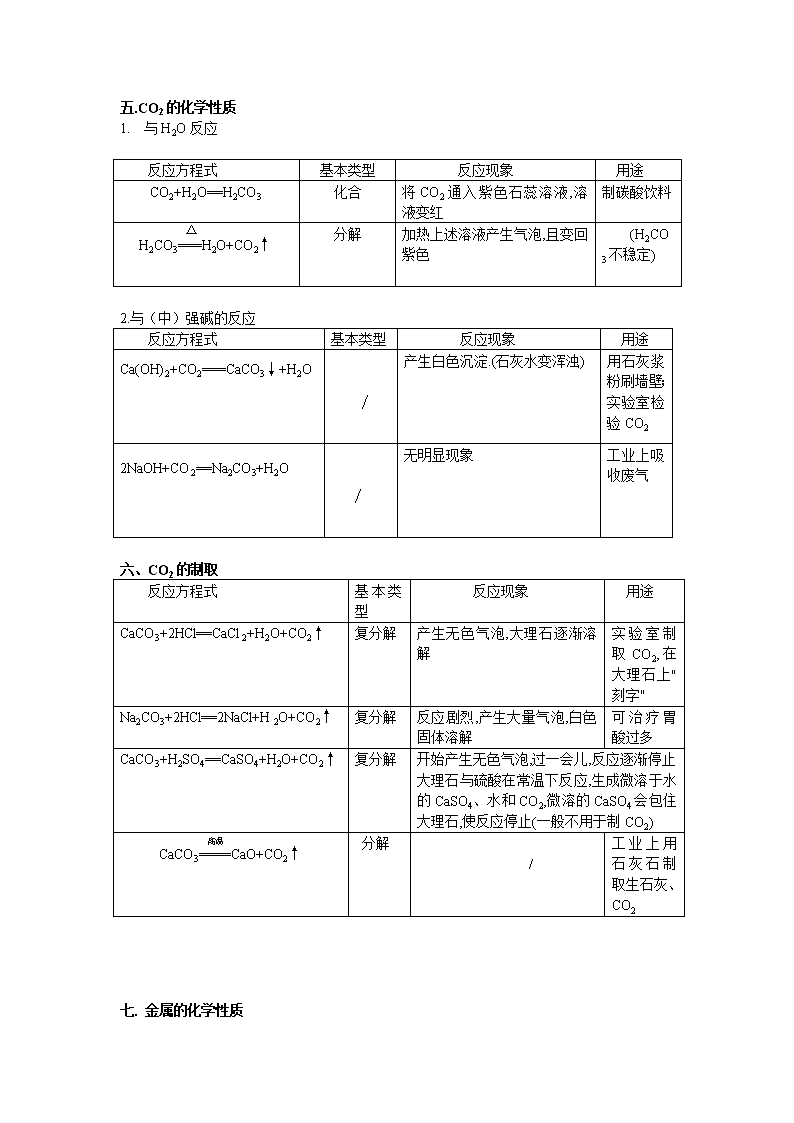
2017中考复习归纳 初中化学方程式 请完成下列化学方程式,并注明反应基本类型: 一、 O2的化学性质(氧化性、可以助燃) 反应方程式 反应基本类型 反应现象 用途 点燃 2H2+O2====2H2O 化合 氢气在氧气中燃烧,发出淡蓝色火焰,放出大量的热,生成水 H2是最清洁的燃料 点燃 S+O2 ====SO2 化合 硫在氧气里燃烧,发出蓝紫色火焰.生成一种带有刺激性气味的气体,并放出热量.在空气中产生微弱蓝紫色火焰。 制炸药(火药) 点燃 4P+5O2====2P2O5 化合 磷在空气中燃烧,产生大量白烟并放出热量. 火柴盒、发令枪 点燃 3Fe+2O2=====Fe3O4 化合 铁丝在氧气中剧烈燃烧,火星四射,生成一种黑色固体,并放出大量的热. / 点燃 2Mg+O2=====2MgO 化合 镁在氧气中燃烧,放出大量的热,同时发出耀眼的白光.生成一种白色固体. 制烟花 点燃 CH4+2O2=====CO2+2H2O / 甲烷在氧气(或空气)中燃烧,发出蓝色明亮的火焰,放热. 天然气的主要成分,主要的燃料 △ 2Hg+O2=====2HgO 化合 (见上册26页) / 二. O2的制法 反应方程式 基本类型 反应现象 用途 △ 2KMnO4===K2MnO4+MnO2+O2↑ 分解 / 实验室制取O2 MnO2 2KClO3=====2KCl+3O2↑ △ 分解 / MnO2 2H2O2====2H2O+O2↑ 分解 产生大量无色气泡 通电 2H2O====2H2↑+O2↑ 分解 正负电极上分别产生无色气泡,负极上产生的气体体积是正极上产生气体体积的两倍 / △ 2HgO ===== 2Hg+O2↑ 分解 红色固体渐消失,产生银色液体 / 三. C的化学性质 1.可燃性 反应方程式 基本类型 反应现象 用途 (O2充足) 点燃 C+O2====CO2 化合 碳在氧气里燃烧,发出白光,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊 煤,木炭的主要成分,做燃料 (O2不充足) 点燃 2C+O2====2CO 化合 碳在氧气里燃烧,发出白光,并放出热量,燃烧后生成的无色气体有毒 含碳燃料不充分的燃烧均生成CO 2.还原性 反应方程式 基本类型 反应现象 用途 高温 CO2+C=====2CO 化合 该反应吸热 煤炉中的反应之一 高温 C+2CuO=====2Cu+CO2↑ 置换 黑色固体逐渐变成红色,且生成一种能使澄清石灰水变浑浊的气体 还原CuO(冶炼金属) 高温 2Fe2O3+3C====4Fe+3CO2↑ 置换 / 还原Fe2O3(炼铁) 四. CO的化学性质 1. 可燃性 反应方程式 基本类型 反应现象 用途 点燃 2CO+O2=====2CO2 化合 一氧化碳在空气中燃烧,发出蓝色火焰,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊 煤气主要成分,做燃料 2. 还原性 反应方程式 基本类型 反应现象 用途 △ CuO+CO====Cu+CO2 / 黑色的CuO逐渐变成红色的Cu,且生成一种使澄清石灰水变浑浊的无色气体 还原CuO(冶炼铜) 高温 Fe2O3+3CO====2Fe+3CO2 / / 还原Fe2O3(炼铁) 高温 Fe3O4+4CO====3Fe+4CO2 / / 还原Fe3O4(炼铁) 对比: △ H2+CuO====Cu+H2O 置换 黑色固体变红色,管壁有水珠 精练Cu 五.CO2的化学性质 1. 与H2O反应 反应方程式 基本类型 反应现象 用途 CO2+H2O==H2CO3 化合 将CO2通入紫色石蕊溶液,溶液变红 制碳酸饮料 △ H2CO3===H2O+CO2↑ 分解 加热上述溶液产生气泡,且变回紫色 (H2CO3不稳定) 2.与(中)强碱的反应 反应方程式 基本类型 反应现象 用途 Ca(OH)2+CO2===CaCO3↓+H2O ∕ 产生白色沉淀.(石灰水变浑浊) 用石灰浆粉刷墙壁;实验室检验CO2 2NaOH+CO2==Na2CO3+H2O ∕ 无明显现象 工业上吸收废气 六、CO2的制取 反应方程式 基本类型 反应现象 用途 CaCO3+2HCl==CaCl2+H2O+CO2↑ 复分解 产生无色气泡,大理石逐渐溶解 实验室制取CO2,在大理石上"刻字" Na2CO3+2HCl==2NaCl+H2O+CO2↑ 复分解 反应剧烈,产生大量气泡,白色固体溶解 可治疗胃酸过多 CaCO3+H2SO4==CaSO4+H2O+CO2↑ 复分解 开始产生无色气泡,过一会儿,反应逐渐停止 大理石与硫酸在常温下反应,生成微溶于水的CaSO4、水和CO2,微溶的CaSO4会包住大理石,使反应停止(一般不用于制CO2) 高温 CaCO3====CaO+CO2↑ 分解 / 工业上用石灰石制取生石灰、CO2 七. 金属的化学性质 金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au 反应方程式 基本类型 反应现象 用途 金属+ O2→金属氧化物 4Al+3O2=====2Al2O3 化合 ∕ 常温下铝表面形成致密氧化膜 △ 2Zn+O2=====2ZnO 化合 ∕ / △ 2Cu+O2=====2CuO 化合 红色固体变成黑色固体 / 金属+酸→盐+ H2 Fe+H2SO4 ==FeSO4+H2↑ 置换 铁钉表面有少量无色气泡生成,无色溶液逐渐变成浅绿色 / Zn+H2SO4==ZnSO4+H2↑ 置换 反应较剧烈,产生无色气泡,锌粒逐渐溶解; 实验室制取H2 Mg+2HCl==MgCl2+H2↑ 置换 反应剧烈,产生大量无色气泡,镁条溶解; / 金属+盐→盐+金属 Fe+CuSO4==FeSO4+Cu 置换 铁钉表面有红色物质生成,蓝色溶液逐渐变成浅绿色 古代湿法制Cu 2Al+3CuSO4 ==Al2(SO4)3 +3Cu 置换 铝片表面有红色物质生成,蓝色溶液逐渐变成无色 / Cu+ 2AgNO3 ==Cu(NO3)2+ 2Ag 置换 铜片表面有黑色物质生成,无色溶液逐渐变成浅蓝色 / 八 .酸、碱、盐的性质 1、 酸在水中的解离方程式进行总结归纳: HCl = H+ + Cl- H2SO 4 = 2H+ +SO42- HNO3 = H+ +NO3- 2、几种碱在水中的解离方程式: NaOH = Na+ + OH- KOH = K+ + OH- Ca(OH)2 = Ca2+ + 2OH- 3、几种盐在水中的解离方程式: NaCl = Na+ + Cl- Al2(SO4)3 = 2Al3+ + 3 SO42- KNO3 =K+ + NO3- KMnO4 = K+ + MnO4 - CuSO4 =Cu2+ + SO42- BaCl2 = Ba2+ + 2Cl - 酸碱盐概念的比较 化学组成 举例 溶液中的阴、阳离子 酸 氢离子和酸根离子 HNO3 阳离子:全部是H+,阴离子是酸根离子 碱 氢氧根离子和金属离子 KOH 阴离子:金属离子, 阴离子:全部是OH—— 盐 金属离子和酸根离子 AgNO3 阳离子:金属离子 阴离子:酸根离子 附表1 稀硫酸的化学性质(稀盐酸相似) 实验内容 实验现象 实验结论(或化学方程式,注明基本类型) 跟指示剂反应 1、 紫色石蕊试液 2、 无色酚酞试液 1、 试液显( 红 )色 试液显( 无 )色 1、 紫色石蕊遇酸溶液(变红 ) 2、 无色酚酞遇酸溶液( 不变色 ) 跟金属反应 1、镁条 2、锌粒 3、铁钉 1、反应剧烈,产生(大量无色气泡),镁条溶解; 2、反应较剧烈,产生(无色气泡 ),锌粒逐渐溶解; 3、铁钉表面有少量(无色气泡 ),溶液逐渐变为(浅绿)色 Mg+H2SO4=MgSO4+H2↑ Zn+H2SO4=ZnSO4+H2↑ Fe+H2SO4=FeSO4+H2↑ 跟金属氧化物反应 1、铁锈(除铁锈) 2、氧化铜 1、 铁钉表面的锈逐渐溶解,溶液显(黄 )色 2、 黑色固体溶解,溶液显( 蓝 )色 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O CuO+H2SO4=CuSO4+H2O 跟碱反应 Cu(OH)2 蓝色固体慢慢溶解,溶液显(蓝 )色 Cu(OH)2+H2SO4=CuSO4+2H2O 跟盐反应 1、BaCl2溶液 2、Na2CO3固体 1、生成(白色沉淀 ) 2、固体溶解,产生大量(无色气泡 ) 1、 BaCl2+H2SO4=BaSO4↓ +2HCl 2、 Na2CO3+H2SO4= Na2 SO4+ H2O+ CO2↑ 附表2盐酸与硫酸的性质比较表 项目 名称 盐酸 硫酸 化学式 HCl H2SO4 颜色,气味 浓HCl无色、有刺激性气味 浓H2SO4无色无味 挥发性 浓HCl易挥发(在空气中形成白雾) 不挥发 。有吸水性、脱水性 与指示剂作用 紫色石蕊变红 无色酚酞不变色 紫色石蕊变红 无色酚酞不变色 与活泼金属反应 (练习书写化学方程式,并注明基本类型,下同) Zn+2HCl=ZnCl2+H2↑ Mg+2HCl==MgCl2+H2↑ Fe+H2SO4=FeSO4+H2 ↑ 2Al+3H2SO4 ==Al2(SO4)3+3H2↑ 与金属氧化物反应 CuO+2HCl=CuCl2+H2O Fe2O3+6HCl==2FeCl3+3H2O Al2O3+3H2SO4=Al2(SO4)3+3H2O ZnO+ H2SO4==ZnSO4+H2O 与碱的反应 NaOH+HCl=NaCl+H2O Mg(OH)2+2HCl==MgCl2+2H2O Ca(OH)2+H2SO4=CaSO4+2H2O 2Fe(OH)3+3H2SO4==Fe2(SO4)3+6H2O 与某些盐反应 AgNO3+HCl=AgCl↓+HNO3 CaCO3+2HCl=CaCl2+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ Ba(NO3)2+H2SO4 =BaSO4 ↓ +2HNO3 K2CO3+H2SO4= K2 SO4+ H2O+ CO2↑ 鉴别试剂 AgNO3 溶液和稀HNO3 BaCl2溶液或Ba(NO3)2溶液和稀HNO3 附表3 氢氧化钠的化学性质 实验步骤 实验现象 实验结论(或化学方程式) 1、 与指示剂的反应 紫色石蕊试液变(蓝)色 无色酚酞试液变(红)色 氢氧化钠溶液使紫色石蕊试液变(蓝 )色, 氢氧化钠溶液使无色酚酞试液变(红 )色 2、与盐溶液的反应 1 2 3 4 1、产生(蓝 )色沉淀 2、产生(红褐 )色沉淀 3、产生(白 )色沉淀 4、产生(蓝、白)色沉淀 化学方程式 1、CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 2、FeCl3+3NaOH==Fe(OH)3↓+3NaCl 3、Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 4、CuSO4+Ba(OH)2==Cu(OH)2↓+BaSO4↓ 附表4 氢氧化钠与氢氧化钙的性质比较表 用途 性质 氢氧化钠 氢氧化钙 化学式 NaOH Ca(OH)2 俗名 烧碱 火碱 苛性钠 熟石灰 消石灰 物理性质 1、 白色固体 2、 具有吸水性(易潮解) 3、 极易溶于水,放热 4、 具有强腐蚀性 1、 白色固体 2、 微溶于水 3、 具有腐蚀性 工业制法 Ca(OH)2+ Na2CO3= CaCO3↓+2NaOH (纯碱) 高温 CaCO3===== CaO +、CO2↑ CaO + H2O == Ca(OH)2(剧烈反应,放出大量热,白色块状固体变成粉末) 化学性质 1、 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 2、 与某些非金属氧化物反应 2NaOH +CO2=Na2CO3+H2O 2NaOH +SO2=Na2SO3+H2O 2NaOH +SO3=Na2SO4+H2O (工业上吸收废气) 3、与酸反应 NaOH +HCl=NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O NaOH+HNO3==NaNO3+H2O 4、与某些盐反应 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 MgCl2+2NaOH==Mg(OH)2↓+2NaCl Zn(NO3)2+2NaOH==Zn(OH)2↓ +2NaNO3 1、使紫色石蕊试液变蓝色,使无色酚酞试液变红色 2、与某些非金属氧化物反应 Ca(OH)2 +CO2=CaCO3↓ +H2O (用于鉴别CO2气体) 3、与酸反应(用于中和土壤酸性) Ca(OH)2+H2SO4=CaSO4+2H2O Ca(OH)2+2HCl==CaCl2+2H2O Ca(OH)2+H2SO4==CaSO4+2H2O 4、与某些盐反应 Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOH Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4 (波尔多液的制取) Ca(OH)2+K2CO3=CaCO3 ↓+2KOH △盐的化学性质(1、2、3见上述内容) 1、盐溶液 + 金属 → 新盐+ 新金属 2、盐 + 酸 → 新盐+ 新酸 3、盐 + 碱 → 新盐+ 新碱 4、盐 + 盐 → 两种新盐 例:CuSO4+BaCl2=BaSO4↓+CuCl2 AgNO3+NaCl= AgCl ↓+ NaNO3 Na2CO3+ CaCl2= 2NaCl+ CaCO3↓ K2CO3+ Ba(NO3)2= 2KNO3+ BaCO3↓ 初中化学全册方程式网络图 一、氧系网络 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂ 二、碳系网络 ⑴可燃性 还原性 ⑵可燃性 还原性 ⑶可燃性 还原性 ⑷ ⑸ ⑹ ⑺ ⑻实验室制二氧化碳 工业制二氧化碳 ⑼ ⑽ ⑾ ⑿ 三、金属、酸、碱、盐系网络 (一)、复分解反应(有五类、见上图①②③④⑤) ①酸+金属氧化物→盐+水 ②酸+碱→盐+水 ③酸+盐→酸+盐 ④盐+碱→盐+碱 ⑤盐+盐→盐+盐 (二)金属和酸、盐溶液的置换反应(见上图⑥⑦) ⑥金属+酸→盐+氢气 ⑦金属+盐→金属+盐 (三)金属氧化物制碱的反应(见上图⑧ Na2O、K2O、BaO、CaO分别和水反应 ) ⑧金属氧化物+水→碱 (四)非金属氧化物制取酸(见上图⑨ CO2 、SO2 、SO3分别和水反应) ⑨非金属氧化物+水→酸 (五)碱溶液和金属氧化物反应( 见上图⑩ ) ⑩碱溶液+非金属氧化物→盐+水 (六)还原剂还原金属氧化物( 见上图⑾ ) 初中化学全册方程式 反应类型 巧记内容 化合反应 单+单 P、S、H2、C、Fe、Cu、Mg、Al的完全燃烧,C的不完全燃烧 单+化 CO的燃烧、高温CO2和木炭反应得CO 化+化 CO2、SO2、SO3或CaO、K2O、Na2O、BaO与水反应得对应酸碱 分解反应 氧化物 H2O、H2O2分解 酸 H2CO3分解 碱 不溶性碱Cu(OH)2、Fe(OH)3分解 盐 KMnO4、KClO3、CaCO3分解 置换反应 金属+酸 金属活动性在H前,酸一般用稀H 2SO 4、稀HCl 金属+盐 遵守金属活动性前置后,盐可溶 金属氧化物+还原性单质 常见CuO、Fe2O3和H2、C反应 复分解反应 酸+金属氧化物 酸+金属氧化物→盐+ H2O 酸+碱 酸+碱→盐+ H2O 盐+酸 盐+酸→盐+酸(盐不能用BaSO4、AgCl) 盐+碱 盐+碱→盐+碱(反应物必须全溶) 盐+盐 盐+盐→盐+盐(反应物必须全溶) 非四大 反应类型 一氧化碳做还原剂 常见CuO、Fe2O3和CO反应 二氧化碳和可溶性碱 常见CO2和Ca(OH) 2、NaOH反应 有机物的燃烧 常见CH 4的燃烧 写出以上反应的化学方程式 反应类型 记忆 化学方程式 化合反应 单+单 P + S + H2 + C + C + Fe + Cu + Mg + Al + 单+化(全书共2个) CO + CO2 + 化+化 CO2 + SO2 + SO3 + CaO + K2O + Na2O + BaO + 分解反应 氧化物分解 H2O —— H2O2 —— 酸分解 H2CO3 —— 不溶性碱分解 Cu(OH)2 —— Fe(OH)3 —— 盐分解 KMnO4 —— KClO3 —— CaCO3 —— 置换反应 (金属活动顺序表) 1、金属+酸 Zn + Fe + 2、金属+盐(可溶) Cu + Fe + 3、金属氧化物+单质还原剂 CuO + Fe2O3 + 复分解反应 (反应条件为生成物有 H2O、↑、↓) 不参加复分解反应的四个物质分别为: 1、酸+金属氧化物 CuO + Fe2O3 + 2、酸+碱 (中和反应) NaOH + Cu(OH)2 + 3、盐+酸 (盐必须溶于酸) CaCO3 + BaCO3 + NaHCO3 + AgNO3 + BaCl2+ 4、盐+碱 (反应物全溶) CuSO4+Ba(OH)2 5、盐+盐(反应物全溶) 非四大反应类型 一氧化碳做还原剂 CuO + Fe2O3 + 二氧化碳+可溶性碱 CO2 + CO2 + CO2 + CO2 + 有机物燃烧 CH4 +查看更多