- 2021-05-10 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学 第三篇 第4-5单元测试题 新人教版1
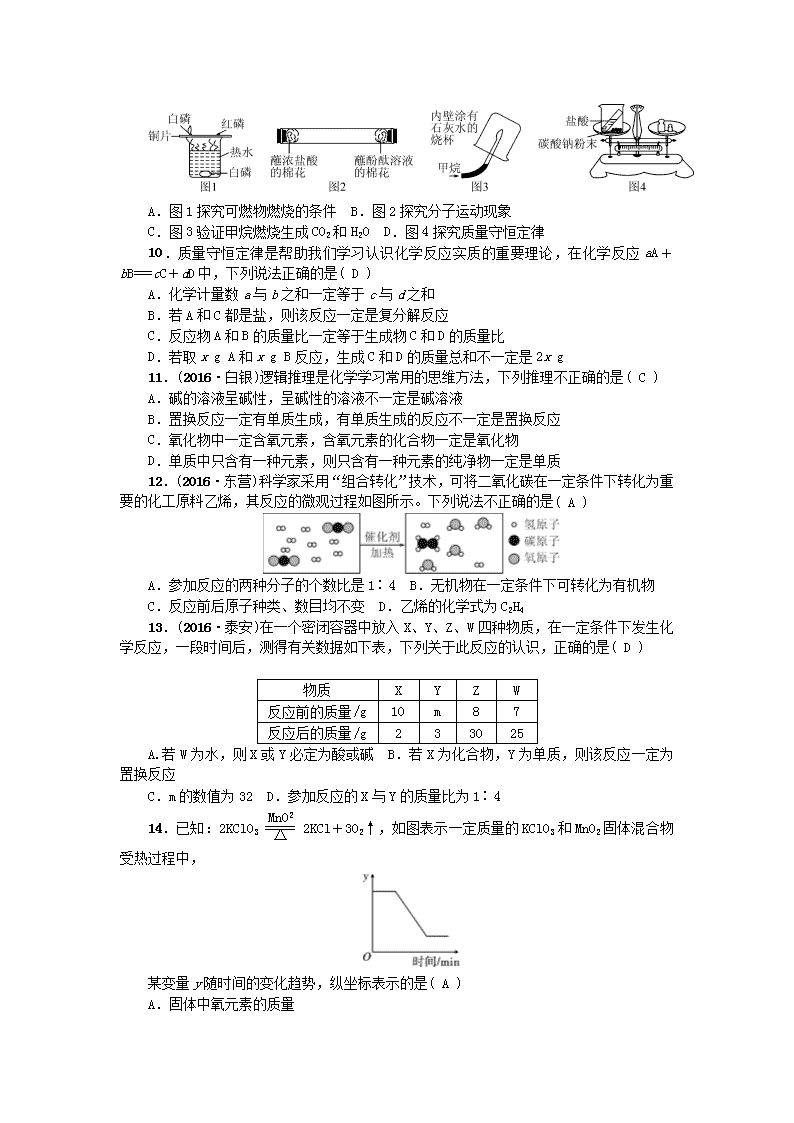
第四、五单元测试题 (满分:100分 时间:45分钟) 相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 K—39 Ca—40 Fe—56 S—32 一、选择题(每小题3分,共45分) 1.水是宝贵的自然资源,下列净化水的方法中,净化程度最高的是( A ) A.蒸馏 B.沉淀 C.过滤 D.吸附 2.(2016·南充)下列关于水的说法错误的是( C ) A.用活性炭可除去水中的色素和异味 B.可用肥皂水区分硬水和软水 C.电解水时,正极产生氢气,负极产生氧气 D.生活污水需集中处理后再排放 3.(2016·衡阳)下列物质中,属于氧化物的是( D ) A.镁 B.空气 C.硝酸钾 D.二氧化锰 4.(2016·娄底)实验室常用加热高锰酸钾的方法制取氧气。KMnO4中锰元素的化合价为( C ) A.+1 B.+6 C.+7 D.+9 5.科学家成功制备出了一种含铱元素的阳离子,在这种离子中,铱元素显+9价,该离子符号的书写正确的是( C ) A.IrO B.IrO C.IrO D.IrO 6.(2016·长沙)某市空气受到SO2的严重污染,环保部门立即派出飞机喷洒X粉末,快速降低空气中的SO2含量,该过程发生的化学反应是2X+2SO2+O2===2CaSO4+2CO2,X的化学式是( D ) A.H2O B.Na2CO3 C. CaO D. CaCO3 7.下列表中的叙述、对应的化学方程式和所属反应类型都正确的是( D ) 叙述 化学反应方程式 反应类型 A 拉瓦锡研究空气成分 2HgO2Hg+O2 分解反应 B 探究一氧化碳的还原性 CO+CuOCu+CO2 置换反应 C 用二氧化碳制作碳酸饮料 CO2+H2O===HCO3 化合反应 D 服用含氢氧化铝的药物治疗胃酸过多 Al(OH)3+3HCl===AlCl3+3H2O 复分解反应 8.(2016·烟台)2015年10月,我国科学家屠呦呦因发现青蒿素(化学式为C15H22O5)而获得诺贝尔奖。青蒿素在加热条件下易分解。下列有关说法错误的是( C ) A.青蒿素由碳、氢、氧三种元素组成 B.青蒿素是由C15H22O5分子构成 C.青蒿素中氢元素的质量分数最高 D.提取青蒿素宜在低温下进行 9.(2016·咸宁)下列实验设计能达到实验目的是( A ) A.图1探究可燃物燃烧的条件 B.图2探究分子运动现象 C.图3验证甲烷燃烧生成CO2和H2O D.图4探究质量守恒定律 10.质量守恒定律是帮助我们学习认识化学反应实质的重要理论,在化学反应aA+bB===cC+dD中,下列说法正确的是( D ) A.化学计量数a与b之和一定等于c与d之和 B.若A和C都是盐,则该反应一定是复分解反应 C.反应物A和B的质量比一定等于生成物C和D的质量比 D.若取x g A和x g B反应,生成C和D的质量总和不一定是2x g 11.(2016·白银)逻辑推理是化学学习常用的思维方法,下列推理不正确的是( C ) A.碱的溶液呈碱性,呈碱性的溶液不一定是碱溶液 B.置换反应一定有单质生成,有单质生成的反应不一定是置换反应 C.氧化物中一定含氧元素,含氧元素的化合物一定是氧化物 D.单质中只含有一种元素,则只含有一种元素的纯净物一定是单质 12.(2016·东营)科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示。下列说法不正确的是( A ) A.参加反应的两种分子的个数比是1∶4 B.无机物在一定条件下可转化为有机物 C.反应前后原子种类、数目均不变 D.乙烯的化学式为C2H4 13.(2016·泰安)在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,下列关于此反应的认识,正确的是( D ) 物质 X Y Z W 反应前的质量/g 10 m 8 7 反应后的质量/g 2 3 30 25 A.若W为水,则X或Y必定为酸或碱 B.若X为化合物,Y为单质,则该反应一定为置换反应 C.m的数值为32 D.参加反应的X与Y的质量比为1∶4 14.已知:2KClO32KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中, 某变量y随时间的变化趋势,纵坐标表示的是( A ) A.固体中氧元素的质量 B.生成O2的质量 C.固体中MnO2的质量 D.固体中钾元素的质量分数 15.(2015·哈尔滨)实验室有碳酸钾和碳酸钙的固体混合物75 g,使之与500 g质量分数为14.6%的盐酸充分反应,将反应后的溶液蒸干得到82.7 g固体。则原混合物中金属元素的质量分数为( A ) A.44% B.46% C.50% D.55% 解析:由化学方程式K2CO3+2HCl===2KCl+H2O+CO2↑;CaCO3+2HCl===CaCl2+H2O+CO2↑可知:反应后溶液的质量增加是因为2个Cl-,代替了1个CO的缘故;根据质量增加值,可算出CO的质量,进而求出金属的质量。 CO―→2Cl- Δm 60 71 11 x (82.7 g-75 g) = x=42 g 混合物中金属的质量分数=×100%=44% 二、填空题(共29分) 16.(16分)(2016·扬州)化学用语是学习化学的重要工具。 (1)写出下列微粒的化学符号: ①镁离子__Mg2+__ ②二氧化氮分子__NO2__ ③5个硅原子__5Si__ ④硝酸分子__HNO3__ (2)用下列字母序号填空: a.硫酸铜 b.氯化钠 c.氮气 d.石墨 ①__b__用作调味品和防腐剂 ②__c__用作粮食保护气 ③__a__用于配制波尔多液 ④__d__用于生产铅笔芯 (3)写出下列反应的化学方程式: ①盐酸与氢氧化钠溶液反应__NaOH+HCl===NaCl+H2O__ ②铝与氧气反应__4Al+3O2===2Al2O3__ ③一氧化碳与氧化铁反应__Fe2O3+3CO2Fe+3CO2__ ④用高锰酸钾制取氧气__2KMnO4K2MnO4+MnO2+O2↑__ 17.(4分)在“宏观—微观—符号”之间建立联系,是化学学科特有的思维方式。以下是某化学反应的微观示意图: 请回答以下问题: (1)该反应前后涉及的化合物共有__3__种,A物质的化学式为__CH4__。 (2)分析微观示意图,你能获得的信息还有(各写一条): 宏观方面:__反应前后元素种类不变__; 微观方面:__反应前后原子种类不变__。 18.(9分)水是人类生活中不可缺少的物质。 (1)目前部分农村的饮用水,主要是取地下水,可用__肥皂水__检验地下水是硬水还是软水,常用__煮沸__方法降低水的硬度。 (2)净水时,通常用__过滤__的方法,除去水中难溶性杂质,常用__活性炭__做吸附剂除去水中的色素和异味。 (3)龚辉同学设计了电解水简易装置,其中A、B电极由金属曲别针制成。通电后的现象如图所示。与A电极相连的试管中收集到的气体是__氧气(或O2)__;电解水的化学方程式为:__2H2O2H2↑+O2↑__。 (4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。Ca(HCO3)2受热分解的化学方程式为__Ca(HCO3)2CaCO3+CO2↑+H2O__。 三、实验探究题(共7分) 19.(7分)请回忆你学习过的“质量守恒定律”的实验探究,并按要求完成实验方案一和实验方案二。(下表中“实验结论”填“=”“>”或“<”) 实验方案 方案一 方案二 反应现象 铁钉表面覆盖一层红色的物质, 溶液由蓝色变成浅绿色 有气泡产生 反应前的总质量 m1 n1 反应后的总质量 m2 n2 实验结论 m1=m2 n1>n2 将两个实验结果进行讨论对比时,有同学分析:有一个方案观察到天平不平衡,是因为__碳酸钾粉末与硫酸反应产生的气体向空气中逸出__,因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是__使反应在密闭容器中进行__。 四、计算题(共23分) 20.(6分)(2016·天津)尿素[CO(NH2)2]是氮肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。 计算: (1)CO(NH2)2中共含有__4__(写数字)种元素。 (2)CO(NH2)2的相对分子质量是__60__。 (3)若CO(NH2)2中含有3 g氮元素,则该CO(NH2)2的质量为__6.4__g(计算结果精确到0.1)。 解析:(1)CO(NH2)2中共含有C、O、N、H四种元素。 (2)CO(NH2)2的相对分子质量=12+16+(14+2)×2=60 (3)设CO(NH2)2的质量为x x×=3 g x≈6.4 g 21.(9分)(2016·兰州)实验室有一瓶硫酸溶液,老师请小明同学设计方案测定该溶液的溶质的质量分数。小明先取一只洁净的小烧杯,称其质量为16.4 g,然后往其中倒入少量硫酸溶液后称量,总质量为30.2 g,之后,将一枚质量为11.8 g的铁钉(已用砂纸打磨去铁锈)放入该小烧杯中,待铁钉表面不再有气泡产生后,再次称量,总质量为41.9 g。请回答下列问题: (1)写出上述反应的化学方程式________________。 (2)反应后产生的气体的质量是______g。 (3)计算该硫酸溶液的溶质的质量分数。(写出计算过程,结果精确到0.1%) 解:(1)Fe+H2SO4===FeSO4+H2↑ (2)30.2 g+11.8 g-41.9 g=0.1 g (3)设与铁反应的硫酸的质量为x,小烧杯中硫酸溶液的质量为30.2 g-16.4 g=13.8 g Fe+H2SO4===FeSO4+H2↑ 98 2 x 0.1 g = x=4.9 g 该硫酸溶液的溶质的质量分数为:×100%≈35.5% 答:该硫酸溶液的溶质的质量分数为35.5%。 22.(8分)(2016·聊城)为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做如下实验:取10片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入50 g盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为65.6 g。(钙片中某他成分不和稀盐酸反应,反应中产生的气体全部放出) (1)反应中生成______g二氧化碳,该钙片中碳酸钙的质量分数为________。 (2)试计算所用稀盐酸中HCl的质量分数。 解:生成CO2的质量=10×2 g+50 g-65.6 g=4.4 g 设50 g盐酸中含有氯化氢的质量为x,10片钙片中CaCO3的质量为y CaCO3+2HCl===CaCl2+H2O+CO2↑ 100 73 44 y x 4.4 g = = x=7.3 g y=10 g 该钙片中CaCO3的质量分数为×100%=50% 所用稀盐酸中HCl的质量分数:×100%=14.6% 答:所用稀盐酸中HCl的质量分数为14.6%。查看更多