- 2022-04-09 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学课下能力提升(八)化学反应速率(含解析)苏教版
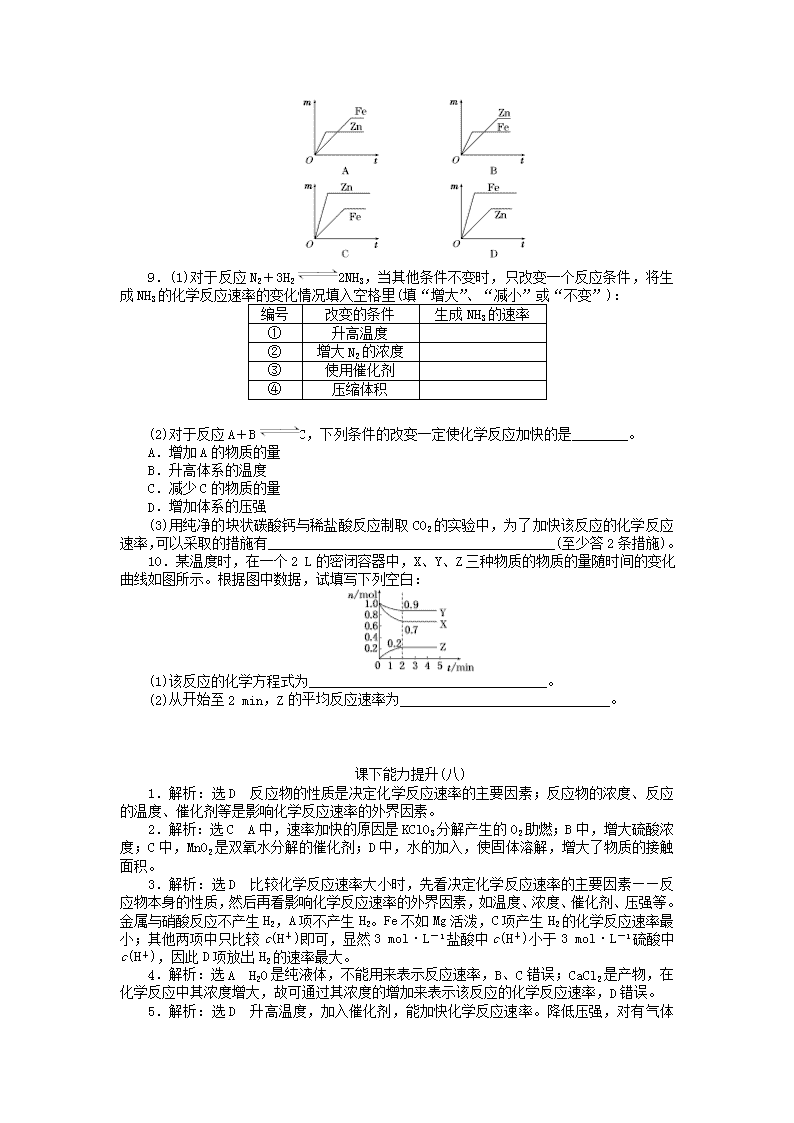
化学反应速率1.决定化学反应速率的主要因素是( )A.反应物的浓度 B.反应温度C.使用催化剂D.反应物的性质2.下列实验中,反应速率加快是由催化剂引起的是( )A.在炭粉中加入KClO3,点燃时燃烧更为剧烈B.锌与稀硫酸反应中加入少量浓硫酸而使反应放出H2的速率加快C.双氧水中加入少量MnO2,可迅速放出气体D.固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀3.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )4.对于反应CaCO3+2HCl===CaCl2+H2O+CO2↑的说法中正确的是( )A.用HCl和CaCl2表示的化学反应速率数据不同,但所表示的意义相同B.不能用CaCO3的浓度变化来表示化学反应速率,但可用水来表示C.用H2O和CO2表示的化学反应速率相同D.用CaCl2浓度的减少表示其化学反应速率5.NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述中不正确的是( )A.升高温度能加快化学反应速率B.使用适当催化剂可以加快化学反应速率C.降低压强能降低化学反应速率D.增大压强对化学反应速率没有影响6.反应4NH3+5O2===4NO+6H2O,在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率为( )A.v(O2)=0.01mol·(L·s)-1B.v(NO)=0.08mol·(L·s)-1C.v(H2O)=0.003mol·(L·s)-1D.v(NH3)=0.003mol·(L·s)-17.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应太慢。为了加快该反应的化学反应速率且不改变H2的产量,可以使用如下方法中的( )①加H2O;②滴入几滴浓HNO3;③滴入几滴浓盐酸;④加CH3COONa固体;⑤加NaCl固体;⑥升高温度(不考虑盐酸挥发);⑦改用10mL 0.1mol·L-1盐酸A.①⑥⑦B.③⑤⑦C.③⑥⑦D.⑤⑥⑦8.如图所示,相等质量的铁和锌与足量的稀H2SO4充分反应,产生氢气的质量(m)与反应时间(t)的正确关系是( )n9.(1)对于反应N2+3H22NH3,当其他条件不变时,只改变一个反应条件,将生成NH3的化学反应速率的变化情况填入空格里(填“增大”、“减小”或“不变”):编号改变的条件生成NH3的速率①升高温度②增大N2的浓度③使用催化剂④压缩体积(2)对于反应A+BC,下列条件的改变一定使化学反应加快的是________。A.增加A的物质的量B.升高体系的温度C.减少C的物质的量D.增加体系的压强(3)用纯净的块状碳酸钙与稀盐酸反应制取CO2的实验中,为了加快该反应的化学反应速率,可以采取的措施有_________________________________________(至少答2条措施)。10.某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:(1)该反应的化学方程式为__________________________________。(2)从开始至2min,Z的平均反应速率为______________________________。课下能力提升(八) 1.解析:选D 反应物的性质是决定化学反应速率的主要因素;反应物的浓度、反应的温度、催化剂等是影响化学反应速率的外界因素。2.解析:选C A中,速率加快的原因是KClO3分解产生的O2助燃;B中,增大硫酸浓度;C中,MnO2是双氧水分解的催化剂;D中,水的加入,使固体溶解,增大了物质的接触面积。3.解析:选D 比较化学反应速率大小时,先看决定化学反应速率的主要因素——反应物本身的性质,然后再看影响化学反应速率的外界因素,如温度、浓度、催化剂、压强等。金属与硝酸反应不产生H2,A项不产生H2。Fe不如Mg活泼,C项产生H2的化学反应速率最小;其他两项中只比较c(H+)即可,显然3mol·L-1盐酸中c(H+)小于3mol·L-1硫酸中c(H+),因此D项放出H2的速率最大。4.解析:选A H2O是纯液体,不能用来表示反应速率,B、C错误;CaCl2是产物,在化学反应中其浓度增大,故可通过其浓度的增加来表示该反应的化学反应速率,D错误。5.n解析:选D 升高温度,加入催化剂,能加快化学反应速率。降低压强,对有气体参加的反应能减小其化学反应速率,而增大压强,可增大有气体参加的反应的化学反应速率。6.解析:选C 先求出NO的化学反应速率,然后运用“化学反应速率比=化学方程式中各物质前的计量数比”求出其他物质的化学反应速率。根据题意计算得v(NO)=0.002mol·(L·s)-1,因v(O2)∶v(NO)=5∶4,故v(O2)=0.0025mol·(L·s)-1,同理v(H2O)=0.003mol·(L·s)-1,v(NH3)=0.002mol·(L·s)-1。7.解析:选C 要加快化学反应速率,同时不改变生成H2的量,可以采取升高温度,增大H+浓度,增大接触面积,使用催化剂等措施。加入浓HNO3虽然能增大H+浓度,但Fe与HNO3反应不能生成H2,会使生成H2的量减少;Cl-不参与该反应,故增大Cl-浓度对化学反应速率无影响。8.解析:选A 化学反应速率的快慢由物质的本性决定,并受外界因素的影响。图像中拐点表示金属已经完全反应。由于Zn比Fe活泼,所以反应速率较快,因此其反应完全所需时间少(横坐标要小);相同质量的锌和铁,锌的物质的量小,生成的H2的质量少,所以锌对应的纵坐标要小。9.解析:(1)升高温度、增大反应物(N2)的浓度、使用催化剂、压缩体积均能增大生成NH3的化学反应速率。(2)若A、C是固体,则增加或减少它们的物质的量,对化学反应速率无影响;若A、B、C都不是气体,则增大压强对化学反应速率无影响。(3)根据外界因素对化学反应速率的影响可知,升高温度、增大盐酸的浓度,或将块状碳酸钙改为粉末状均会加快化学反应速率。答案:(1)①增大 ②增大 ③增大 ④增大(2)B (3)升高温度;将块状碳酸钙改为粉末状;增大盐酸的浓度10.解析:由图中可知2min内X、Y分别减少了0.3mol和0.1mol,Z增加了0.2mol,故X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比为3∶1∶2,该反应的化学方程式为3X+Y2Z,v(Z)==0.05mol·(L·min)-1。答案:(1)3X+Y2Z (2)0.05mol·(L·min)-1查看更多