- 2022-04-09 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学第1章微型专题重点突破(一)学案(含解析)鲁科版
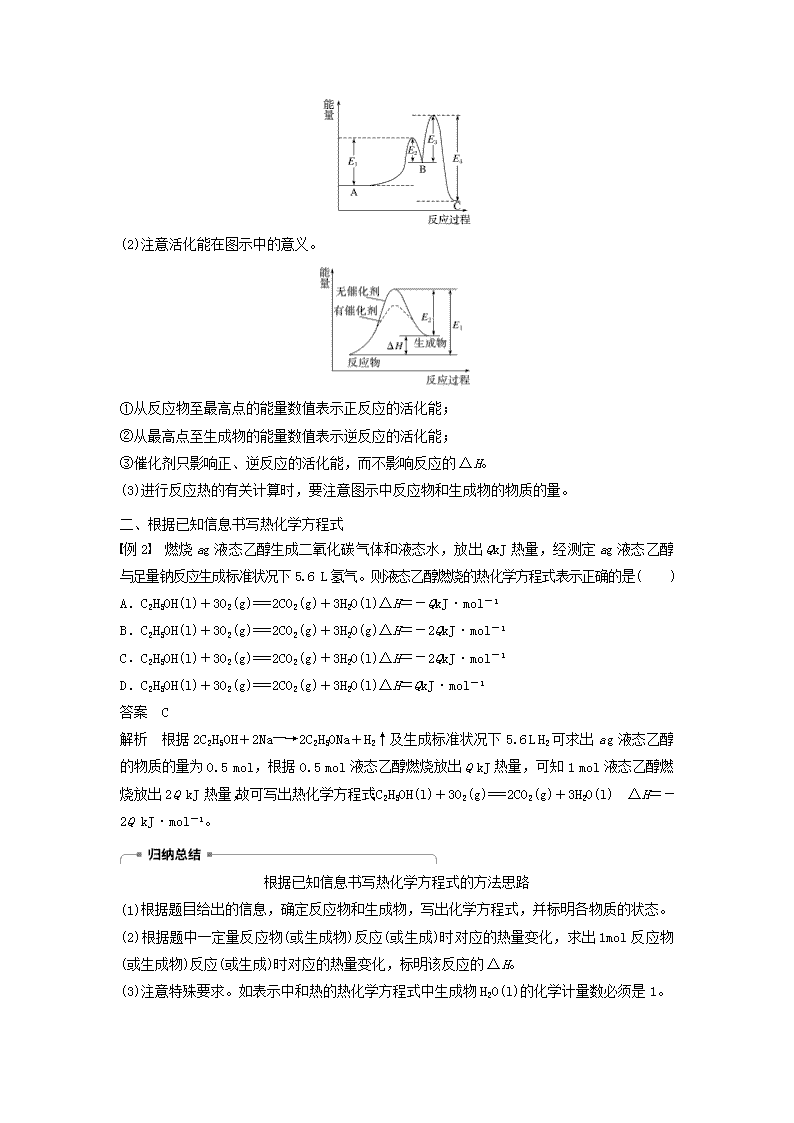
微型专题重点突破(一)[核心素养发展目标] 1.变化观念与平衡思想:能从能量变化和能量守恒的角度认识热化学反应的相关概念和定律,理解热化学方程式的含义,能根据不同的信息条件书写热化学方程式。2.证据推理与模型认知:构建运用盖斯定律解决具体问题的思维方法模型,如书写相关反应的热化学方程式、计算反应热或比较反应热的大小等。一、图像在化学反应能量变化中的应用例1 (2018·长沙期末)根据如图所示示意图,下列说法不正确的是( )A.反应的热化学方程式可表示为C(s)+H2O(g)===CO(g)+H2(g) ΔH=(b-a)kJ·mol-1B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量C.amolC和amolH2O反应生成amolCO和amolH2吸收的热量一定为131.3akJD.1molC(g)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ答案 C解析 由图可知,该反应为吸热反应,反应的热化学方程式可表示为C(s)+H2O(g)===CO(g)+H2(g) ΔH=(b-a)kJ·mol-1,A正确;该反应过程中反应物断键吸收的能量大于生成物成键放出的能量,B正确;没有指明水的状态,C不正确;由图可知,1molC(g)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ,D正确。将化学反应中的能量变化过程通过图像的方式呈现出来,是这类题目的最大特点。解答这类题目的关键:(1)读懂图像,明确图像所提供的信息;(2)根据图像提供的信息综合运用相关知识,分析、判断、计算。变式1 下图表示乙烷、二甲醚燃烧过程中的能量变化。n请回答下列问题:(1)a=________。(2)乙烷的燃烧热为________kJ·mol-1。(3)等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物时放出的热量________(填“多”或“少”)。(4)根据题图写出二甲醚完全燃烧时的热化学方程式:__________________________________________________________________________________________________。(5)从环保角度分析,放出相同的热量时选择__________(填“乙烷”或“二甲醚”)作为燃料产生的二氧化碳较少。答案 (1) (2)1560 (3)少(4)CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1[或CH3OCH3(g)+O2(g)===CO2(g)+H2O(l) ΔH=-485kJ·mol-1] (5)乙烷解析 先根据原子守恒确定a、b、c、d的值,然后依据燃烧热的概念等分析解答。(1)反应生成1molH2O(l),根据原子守恒可确定a=,b=,c=1,d=。(2)由图可得C2H6(g)+O2(g)===CO2(g)+H2O(l) ΔH=-520kJ·mol-1,所以乙烷的燃烧热为520kJ·mol-1×3=1560kJ·mol-1。(3)由于液态乙烷具有的能量小于气态乙烷具有的能量,故等物质的量时,液态乙烷完全燃烧生成稳定的氧化物时放出的热量较少。(5)由热化学方程式可知放出相同热量时,乙烷产生的二氧化碳较少。相关链接能量变化图像题的解题策略(1)根据下图(能量变化关系图)判断吸、放热反应:①A→B:ΔH>0;属于吸热反应。②B→C:ΔH<0;属于放热反应。n(2)注意活化能在图示中的意义。①从反应物至最高点的能量数值表示正反应的活化能;②从最高点至生成物的能量数值表示逆反应的活化能;③催化剂只影响正、逆反应的活化能,而不影响反应的ΔH。(3)进行反应热的有关计算时,要注意图示中反应物和生成物的物质的量。二、根据已知信息书写热化学方程式例2 燃烧ag液态乙醇生成二氧化碳气体和液态水,放出QkJ热量,经测定ag液态乙醇与足量钠反应生成标准状况下5.6L氢气。则液态乙醇燃烧的热化学方程式表示正确的是( )A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-QkJ·mol-1B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-2QkJ·mol-1C.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-2QkJ·mol-1D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=QkJ·mol-1答案 C解析 根据2C2H5OH+2Na―→2C2H5ONa+H2↑及生成标准状况下5.6LH2可求出ag液态乙醇的物质的量为0.5mol,根据0.5mol液态乙醇燃烧放出QkJ热量,可知1mol液态乙醇燃烧放出2QkJ热量,故可写出热化学方程式:C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-2QkJ·mol-1。根据已知信息书写热化学方程式的方法思路(1)根据题目给出的信息,确定反应物和生成物,写出化学方程式,并标明各物质的状态。(2)根据题中一定量反应物(或生成物)反应(或生成)时对应的热量变化,求出1mol反应物(或生成物)反应(或生成)时对应的热量变化,标明该反应的ΔH。(3)注意特殊要求。如表示中和热的热化学方程式中生成物H2O(l)的化学计量数必须是1。n变式2 写出下列反应的热化学方程式。(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为:______________________________________________________________________________________________。(2)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式为:_________________________________________________________________________________________________。(3)已知断开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:________________________________________________________________________________________________。(4)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________________________________________________________________________________。(5)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:2SO2(g)+O2(g)2SO3(g)ΔH1=-197kJ·mol-1;H2O(g)===H2O(l) ΔH2=-44kJ·mol-1;2SO2(g)+O2(g)+2H2O(g)2H2SO4(l)ΔH3=-545kJ·mol-1。则SO3(g)与H2O(l)反应的热化学方程式为:____________________________________________________________________________________________________________。答案 (1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1(2)4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s)ΔH=-177.6kJ·mol-1(3)N2(g)+3H2(g)2NH3(g)ΔH=-92kJ·mol-1(4)A2(g)+B2(g)===2AB(g)ΔH=(a-b)kJ·mol-1(5)SO3(g)+H2O(l)===H2SO4(l)ΔH=-130kJ·mol-1解析 (1)2gSiH4自燃放出热量89.2kJ,1molSiH4自燃放出热量1427.2kJ,故热化学方程式为SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1。n(2)由题意知,生成的黑色固体是氧化铜,根据得失电子守恒和原子守恒配平化学方程式。再根据反应每消耗1molCuCl(s)放热44.4kJ可写出该反应的热化学方程式:4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6kJ·mol-1。(3)N2(g)+3H2(g)2NH3(g) ΔH=(946+436×3-391×6)kJ·mol-1=-92kJ·mol-1。(4)由图可知,生成物总能量高于反应物总能量,故该反应为吸热反应,热化学方程式为A2(g)+B2(g)===2AB(g)ΔH=(a-b)kJ·mol-1。(5)2SO2(g)+O2(g)2SO3(g)ΔH1=-197kJ·mol-1①;H2O(g)===H2O(l) ΔH2=-44kJ·mol-1②;2SO2(g)+O2(g)+2H2O(g)2H2SO4(l)ΔH3=-545kJ·mol-1③。根据盖斯定律,由(③-①-②×2)×得SO3(g)+H2O(l)===H2SO4(l) ΔH=-130kJ·mol-1。相关链接(1)“五步法”书写热化学方程式一写方程式——写出配平的化学方程式。二标状态——用s、l、g、aq标明物质的聚集状态。三标条件——标明反应的温度和压强(101kPa、25℃时可不标注)。四标ΔH——在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”。五标数值——根据化学计量数计算并写出ΔH的值。(2)“五审法”判断热化学方程式的正误一审“+”“-”——放热反应ΔH一定为“-”,吸热反应ΔH一定为“+”。二审单位——单位一定为“kJ·mol-1”,易错写成“kJ”或漏写。三审状态——物质的状态必须正确,特别是溶液中的反应易写错。四审数值——反应热的数值必须与方程式中的化学计量数相对应,即ΔH与化学计量数成正比。当反应逆向进行时,其反应热与正反应的反应热值相等,符号相反。五审是否符合概念——如燃烧热(燃料的化学计量数为1,生成稳定的氧化物)、中和热(H2O的化学计量数为1)的热化学方程式。(3)热化学方程式的书写和判断不准确的常见原因:①忽略了同素异形体的名称的标注。②没有判断物质的聚集状态的标注是否正确。③忽略了可逆反应不能完全转化的判断。④ΔH的正、负及单位书写错误,放热反应的ΔH为“-”,吸热反应的ΔH为“+”。⑤ΔH与热化学方程式中化学计量数不对应,相同的反应,化学计量数不同时,ΔH不同。三、应用盖斯定律计算反应热(ΔH)例3 黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=xkJ·mol-1n已知:碳的燃烧热ΔH1=akJ·mol-1S(s)+2K(s)===K2S(s) ΔH2=bkJ·mol-12K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=ckJ·mol-1则x为( )A.3a+b-cB.c-3a-bC.a+b-cD.c-a-b答案 A解析 本题已知的三个热化学方程式为:①C(s)+O2(g)===CO2(g) ΔH1=akJ·mol-1②S(s)+2K(s)===K2S(s) ΔH2=bkJ·mol-1③2K(s)+N2(g)+3O2(g)===2KNO3(s)ΔH3=ckJ·mol-1由盖斯定律可推出,3×①+②-③可得热化学方程式S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=xkJ·mol-1=(3a+b-c)kJ·mol-1。思维模型——应用盖斯定律计算ΔH的一般步骤解题步骤解题思路第一步:观察对比已知的反应与需要求ΔH的反应,找出需要消去的物质第二步:思考怎样消去这些物质,是相加还是相减或需要乘以某一个数后再相加减,此过程中要特别注意“剔除无关反应”第三步:运算将热化学方程式按第二步的思路进行运算,得出新的热化学方程式第四步:计算列出算式,代入数据计算变式3 由盖斯定律结合下述反应方程式,回答问题:(1)已知:①C(s)+O2(g)===CO2(g) ΔH1;②2CO(g)+O2(g)===2CO2(g) ΔH2;③TiO2(g)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3。则TiO2(g)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=________________(列出关于ΔH1、ΔH2、ΔH3的表达式)。(2)已知:温度过高时,WO2(s)转变为WO2(g)。①WO2(s)+2H2(g)W(s)+2H2O(g)ΔH1=66.0kJ·mol-1②WO2(g)+2H2(g)W(s)+2H2O(g)ΔH2=-137.9kJ·mol-1则WO2(s)WO2(g)的ΔH=________________。答案 (1)2ΔH1-ΔH2+ΔH3 (2)203.9kJ·mol-1解析 (1)将热化学方程式①×2-②+③即得目标方程式,故ΔH=2ΔH1-ΔH2+ΔH3。n(2)由①-②可得WO2(s)WO2(g) ΔH=ΔH1-ΔH2=66.0kJ·mol-1-(-137.9kJ·mol-1)=203.9kJ·mol-1。相关链接运用盖斯定律计算反应热计算反应热最基本的方法是应用盖斯定律。其题目往往给出几个已知的热化学方程式,然后要求计算与之有关的目标热化学方程式的反应热,此时可应用盖斯定律进行计算。应用盖斯定律计算反应热的关键在于设计反应过程。计算时应注意以下几点:(1)参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个),进行合理“变形”,如热化学方程式颠倒或乘、除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式ΔH之间的换算关系。(2)当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;热化学方程式进行加、减运算时,ΔH也同样要进行加、减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。(3)将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但绝对值不变。(4)在设计反应过程时,会遇到同一物质三种状态(固、液、气)的相互转化,当物质的状态由固→液→气变化时,会吸热,反之会放热。其思维导图如下:四、反应热(ΔH)的大小比较方法例4 (2018·福州期中)下列各组热化学方程式的ΔH前者大于后者的是( )①C(s)+O2(g)===CO2(g) ΔH1C(s)+O2(g)===CO(g) ΔH2②S(s)+O2(g)===SO2(g) ΔH3S(g)+O2(g)===SO2(g) ΔH4③H2(g)+O2(g)===H2O(l) ΔH52H2(g)+O2(g)===2H2O(l) ΔH6④CaCO3(s)===CaO(s)+CO2(g) ΔH7CaO(s)+H2O(l)===Ca(OH)2(aq) ΔH8A.①②④B.①③④nC.②③④D.①②③答案 C解析 ①中第一个热化学方程式减去第二个热化学方程式可得CO(g)+O2(g)===CO2(g) ΔH=ΔH1-ΔH2,该反应为放热反应,即ΔH1-ΔH2<0,所以ΔH1<ΔH2;②固态硫变为气态硫时需要吸收热量,故固态硫和气态硫与O2反应产生同样多的SO2(g)时,气态硫放出的热量多,即ΔH3>ΔH4;③同一燃烧反应,其他条件相同时,参与反应的反应物的物质的量越大,放出的热量越多,故ΔH5>ΔH6;④碳酸钙分解吸收热量,ΔH7>0,CaO(s)与H2O(l)反应放出热量,ΔH8<0,显然ΔH7>ΔH8。(1)产物相同时,气态物质燃烧放出的热量比等量的同种固态物质燃烧放出的热量多;反应物相同时,生成液态物质放出的热量比生成等量的同种气态物质放出的热量多。(2)生成等量的水时,强酸和强碱的稀溶液反应比弱酸和强碱(或弱碱和强酸,或弱酸和弱碱)的稀溶液反应放出的热量多。(3)对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的反应热数值。变式4 已知有关甲烷燃烧的三个热化学方程式如下:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=akJ·mol-1②CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=bkJ·mol-1③CH4(g)+O2(g)===CO2(g)+H2O(l)ΔH=ckJ·mol-1下列判断正确的是( )A.甲烷的燃烧热为|a|kJ·mol-1B.b>aC.b=2cD.a>c答案 C解析 表示CH4燃烧热的热化学方程式中,水应为液态,故|b|kJ·mol-1为甲烷的燃烧热,A项错误;因a、b均为负值,放出的热量越多,值越小,故b<a,B项错误;热化学方程式中ΔH的大小与化学计量数成正比,故b=2c,C项正确。相关链接反应热的求算或大小比较方法(1)如果化学计量数加倍,ΔH的绝对值也要加倍n例如,H2(g)+O2(g)===H2O(l) ΔH1=-akJ·mol-1;2H2(g)+O2(g)===2H2O(l) ΔH2=-bkJ·mol-1,其中ΔH2<ΔH1<0,且b=2a。(2)同一反应,反应物或生成物的状态不同,反应热不同在同一反应里,反应物状态或生成物状态不同时,要考虑A(g)A(l)A(s),或者从三状态自身的能量比较:E(g)>E(l)>E(s),可知反应热大小亦不相同。如S(g)+O2(g)===SO2(g) ΔH1=-akJ·mol-1S(s)+O2(g)===SO2(g) ΔH2=-bkJ·mol-1(3)晶体类型不同,产物相同的反应,反应热不同如C(s,石墨)+O2(g)===CO2(g) ΔH1=-akJ·mol-1C(s,金刚石)+O2(g)===CO2(g) ΔH2=-bkJ·mol-1(4)根据反应进行的程度比较反应热大小①其他条件相同,燃烧越充分,放出热量越多,ΔH越小,如C(s)+O2(g)===CO(g) ΔH1;C(s)+O2(g)===CO2(g) ΔH2,则ΔH1>ΔH2。②对于可逆反应,由于反应物不可能完全转化为生成物,所以实际放出(或吸收)的热量小于相应的热化学方程式中的ΔH的绝对值。如:2SO2(g)+O2(g)2SO3(g)ΔH=-197kJ·mol-1,向密闭容器中通入2molSO2(g)和1molO2(g),发生上述反应,达到平衡后,放出的热量小于197kJ,但ΔH仍为-197kJ·mol-1。(5)中和反应中反应热的大小①浓硫酸和氢氧化钠固体反应生成1mol水时,放出的热量一定大于57.3kJ(浓硫酸稀释和氢氧化钠固体溶解时都会放出热量)。②醋酸和NaOH溶液反应生成1mol水时,放出的热量一定小于57.3kJ(醋酸电离会吸热)。③稀硫酸和Ba(OH)2溶液反应生成1mol水时,反应放出的热量一定大于57.3kJ(SO和nBa2+反应生成BaSO4沉淀会放热)。1.现有如下3个热化学方程式:H2(g)+O2(g)===H2O(g) ΔH1=-akJ·mol-1①H2(g)+O2(g)===H2O(l) ΔH2=-bkJ·mol-1②2H2(g)+O2(g)===2H2O(l) ΔH3=-ckJ·mol-1③则由下表所列的原因能推导出后面的结论的是( )选项原因结论AH2的燃烧是放热反应a、b、c均大于零B①和②中物质的化学计量数均相同a=bC①和③中H2O的状态不同,化学计量数不同a、c不会有任何关系D③的化学计量数是②的2倍ΔH2<ΔH3答案 A解析 ①②中由于产生的水的状态不同,故ΔH不同,即a、b也不同,B项错误;①③中由于气态水转化为液态水要放热,故c>2a,C错误;②③中因ΔH3=2ΔH2,且ΔH2、ΔH3均为负值,故ΔH2>ΔH3,D项错误。2.甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)===2CO(g)+2H2(g),1gCH4(g)完全反应可释放15.46kJ的热量,下图中能表示该反应过程的能量变化的是( )答案 Dn解析 1gCH4完全反应释放15.46kJ的热量,则1molCH4完全反应释放的热量为247.36kJ。3.在1200℃时,天然气脱硫工艺中会发生下列反应:①H2S(g)+O2(g)===SO2(g)+H2O(g) ΔH1②2H2S(g)+SO2(g)===S2(g)+2H2O(g) ΔH2③H2S(g)+O2(g)===S(g)+H2O(g) ΔH32S(g)===S2(g) ΔH4,则ΔH4的正确表达式为( )A.ΔH4=(ΔH1+ΔH2-3ΔH3)B.ΔH4=(3ΔH3-ΔH1-ΔH2)C.ΔH4=(ΔH1+ΔH2-3ΔH3)D.ΔH4=(ΔH1-ΔH2-3ΔH3)答案 A解析 根据盖斯定律,①×+②×-③×2得2S(g)===S2(g) ΔH4=(ΔH1+ΔH2-3ΔH3),A正确。4.(2018·宁波十校联考)已知:2H2(g)+O2(g)===2H2O(g)ΔH1=-483.6kJ·mol-12H2(g)+O2(g)===2H2O(l)ΔH2=-571.6kJ·mol-1据此判断,下列说法正确的是( )A.2H2O(l)===2H2(g)+O2(g) ΔH3=xkJ·mol-1,x小于571.6B.2mol氢气和1mol氧气的能量大于2mol液态水的能量C.1molH2O(l)转变成1molH2O(g)放出44.0kJ热量D.1molH2O(g)转变成1molH2O(l)放出88.0kJ热量答案 B解析 热化学方程式反向后,ΔH的数值不变,符号相反,x为571.6,A错误;氢气燃烧是放热反应,反应物的总能量大于生成物的总能量,B正确;由(第一个热化学方程式-第二个热化学方程式)/2可得H2O(l)===H2O(g) ΔH=kJ·mol-1=44kJ·mol-1,C、D错误。n5.(2018·苏州期初调研)现代火法炼锌过程中发生了以下三个主要反应:①2ZnS(s)+3O2(g)===2ZnO(s)+2SO2(g)ΔH1=akJ·mol-1②2C(s)+O2(g)===2CO(g) ΔH2=bkJ·mol-1③ZnO(s)+CO(g)===Zn(g)+CO2(g) ΔH3=ckJ·mol-1下列说法正确的是( )A.以上三个反应中,只有①是放热反应B.反应②的作用是仅为反应③提供还原剂C.反应ZnS(s)+C(s)+2O2(g)===Zn(g)+SO2(g)+CO2(g)的ΔH=kJ·mol-1D.用这种方法得到的是纯净的锌单质答案 C解析 碳的不完全燃烧也是放热反应,A错误;反应②既可以为反应③提供还原剂,同时又能提供能量,B错误;根据盖斯定律,由(①+②+2×③)/2即得到ZnS(s)+C(s)+2O2(g)===Zn(g)+SO2(g)+CO2(g) ΔH=kJ·mol-1,C正确;用题给方法得到的锌单质中含有杂质,D错误。6.(2018·河南豫南、豫北名校精英联赛)N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1molN—N键吸收193kJ能量,形成N2(g)中1molN≡N键放出941kJ能量。下列说法正确的是( )A.N4(g)比N2(g)更稳定B.N4(g)===2N2(g) ΔH=724kJ·mol-1C.形成1molN4(g)中的化学键放出193kJ的能量D.1molN2(g)完全转化为N4(g),体系的能量增加362kJ答案 D解析 N4(g)===2N2(g)的ΔH=6×193kJ·mol-1-2×941kJ·mol-1=-724kJ·mol-1,所以N2比N4稳定,故A、B错误;一个N4分子中含有6个N—N键,形成1molN4(g)中的化学键放出6×193kJ的能量,故C错误;根据上述分析,1molN2(g)完全转化为N4(g),需要吸收362kJ的热量,即体系的能量增加362kJ,D正确。7.利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )nA.该反应的ΔH=91kJ·mol-1B.加入催化剂,该反应的ΔH变小C.反应物的总能量大于生成物的总能量D.如果该反应生成液态CH3OH,则ΔH增大答案 C解析 根据图示,该反应反应物的总能量大于生成物的总能量,是放热反应,A错误、C正确;加入催化剂只能降低反应所需的活化能,而对反应热无影响,B错误;生成液态CH3OH时释放出的热量更多,ΔH更小,D错误。8.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O(g)===2HI(g)+H2SO4(l)ΔH=akJ·mol-12H2SO4(l)===2H2O(g)+2SO2(g)+O2(g)ΔH=bkJ·mol-12HI(g)===H2(g)+I2(g) ΔH=ckJ·mol-1则:2H2O(g)===2H2(g)+O2(g) ΔH=____________kJ·mol-1。(2)已知CO中的C与O之间为叁键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)CH3OH(g) ΔH。下表所列为常见化学键的键能数据:化学键C—CC—HH—HC—OC≡OH—O348414436326.81032464则该反应的ΔH=________kJ·mol-1。(3)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6kJ·mol-1n①写出硫燃烧的热化学方程式:________________________________________________________________________________________________________________________。②ΔH2=________kJ·mol-1。答案 (1)2a+b+2c (2)-128.8(3)①S(s)+O2(g)===SO2(g) ΔH=-297kJ·mol-1②-78.64解析 (1)将题给热化学方程式依次编号为Ⅰ、Ⅱ、Ⅲ,根据盖斯定律,由Ⅰ×2+Ⅱ+Ⅲ×2得2H2O(g)===2H2(g)+O2(g) ΔH=(2a+b+2c)kJ·mol-1。(2)ΔH=1032kJ·mol-1+2×436kJ·mol-1-3×414kJ·mol-1-326.8kJ·mol-1-464kJ·mol-1=-128.8kJ·mol-1。(3)①由图可知1molS(s)完全燃烧放出的热量为297kJ,故硫燃烧热的热化学方程式为S(s)+O2(g)===SO2(g) ΔH=-297kJ·mol-1。②由图可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据2SO2(g)+O2(g)2SO3(g) ΔH=-196.6kJ·mol-1,ΔH2=0.8××(-196.6kJ·mol-1)=-78.64kJ·mol-1。题组一 化学反应中能量变化及其图像1.下列说法或表示方法正确的是( )A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多B.由C(s,石墨)===C(s,金刚石) ΔH=1.9kJ·mol-1可知,金刚石比石墨稳定C.在25℃,100kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ答案 C解析 A项中硫粉变为硫蒸气要吸热,前者放出热量多,错误;B项中石墨能量低,更稳定,错误;D项中浓硫酸溶于水放热,放出的热量大于57.3kJ,错误。2.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)ΔH=49.0kJ·mol-1n②CH3OH(g)+O2(g)===CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1下列说法正确的是( )A.CH3OH的燃烧热为192.9kJ·mol-1B.①中的能量变化如下图所示C.CH3OH转变成H2的过程一定要吸收能量D.根据②推知反应CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9kJ·mol-1答案 D解析 ②中H2(g)不是稳定的氧化物,A项错误;①为吸热反应,而图示反应为放热反应,B项错误;据题给①②可知CH3OH转变成H2的过程可能吸收能量,也可能放出能量,C项错误;由于CH3OH在气态时的能量比液态时的高,可知等量CH3OH(l)比CH3OH(g)反应时放出热量少,D项正确。3.(2018·福州台江区校级月考)已知:2NO2(g)N2O4(g)ΔH1=akJ·mol-1,N2O4(l)2NO2(g) ΔH2=bkJ·mol-1,又知“2NO2(g)”的总能量高于“N2O4(g)”,下列有关这两个反应的说法错误的是( )A.ΔH1<0B.ΔH1=-ΔH2C.能量关系如图所示D.消耗2molNO2(g)生成1molN2O4(g)时,放出的热量为|a|kJ答案 B解析 反应物的总能量比生成物的高,故ΔH1<0,A项正确;由于两个反应中N2O4的状态不同,故ΔH1≠-ΔH2,B项错误;“2NO2(g)”的总能量高于“N2O4(g)”,气态N2O4的能量高于液态N2O4的能量,C项正确;由2NO2(g)N2O4(g) ΔH1=akJ·mol-1及A项中的分析可知,D项正确。题组二 判断热化学方程式正误4.下列热化学方程式书写正确的是( )nA.N2+3H22NH3 ΔH=-92.2kJ·mol-1B.H2(g)+O2(g)===H2O(l) ΔH=-285.8kJ·mol-1C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJD.C(石墨,s)+O2(g)===CO2(g) ΔH=393.5kJ·mol-1答案 B解析 A项,没有标出各物质的状态,错误;C项,ΔH的单位应为kJ·mol-1,错误;D项,C(石墨,s)的燃烧反应为放热反应,即ΔH为负值,错误。5.含NaOH20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是( )A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=28.7kJ·mol-1B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-28.7kJ·mol-1C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=57.4kJ·mol-1D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.4kJ·mol-1答案 D解析 含NaOH20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,则含1molNaOH的稀溶液与足量稀盐酸反应,放出57.4kJ的热量。A项,焓变的符号应为“-”、数值与化学计量数不对应,错误;B项,焓变的数值与化学计量数不对应,错误;C项,焓变的符号应为“-”,错误。6.已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2bkJ·mol-1B.C2H2(g)+O2(g)===2CO2(g)+H2O(l)ΔH=2bkJ·mol-1C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-4bkJ·mol-1D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=bkJ·mol-1答案 C解析 放热反应中ΔH<0,所以B、D错误;生成1molCO2时放出bkJ的热量,所以生成4molCO2时放出的热量为4bkJ。题组三 反应热的计算与大小比较7.已知:a.C2H2(g)+H2(g)===C2H4(g) ΔH<0;b.2CH4(g)===C2H4(g)+2H2(g) ΔH>0。以下三个热化学方程式:①C(s)+2H2(g)===CH4(g) ΔH1②C(s)+H2(g)===C2H2(g) ΔH2n③C(s)+H2(g)===C2H4(g) ΔH3ΔH1、ΔH2、ΔH3由大到小的顺序是( )A.ΔH2>ΔH3>ΔH1B.ΔH3>ΔH2>ΔH1C.ΔH3>ΔH1>ΔH2D.ΔH1>ΔH2>ΔH3答案 A解析 利用盖斯定律,(②-③)×2得出:C2H4(g)===C2H2(g)+H2(g) ΔH=2(ΔH2-ΔH3),根据反应a的逆过程为吸热反应,得ΔH2-ΔH3>0,ΔH2>ΔH3;(③-①)×2得出:2CH4(g)===C2H4(g)+2H2(g) ΔH=2(ΔH3-ΔH1),根据反应b,得ΔH3-ΔH1>0,ΔH3>ΔH1,故A项正确。8.已知:C(s)+O2(g)===CO2(g) ΔH1CO2(g)+C(s)===2CO(g) ΔH22CO(g)+O2(g)===2CO2(g) ΔH34Fe(s)+3O2(g)===2Fe2O3(s) ΔH43CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5下列关于上述反应焓变的判断正确的是( )A.ΔH1>0,ΔH3<0B.ΔH2>0,ΔH4>0C.ΔH1=ΔH2+ΔH3D.ΔH3=ΔH4+ΔH5答案 C解析 C或CO燃烧生成CO2均是放热反应,ΔH<0,A错误;C与CO2反应生成CO是吸热反应,则ΔH2>0,Fe与O2反应生成Fe2O3是放热反应,ΔH4<0,B错误;将第2个方程式和第3个方程式相加可得第1个方程式,所以由盖斯定律有ΔH1=ΔH2+ΔH3,C正确;由盖斯定律有ΔH3=ΔH4+ΔH5,D错误。9.已知下列反应的热化学方程式为①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)ΔH1=-870.3kJ·mol-1②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1③H2(g)+O2(g)===H2O(l) ΔH3=-285.8kJ·mol-1则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的ΔH为( )A.-488.3kJ·mol-1B.-191kJ·mol-1C.-476.8kJ·mol-1D.-1549.6kJ·mol-1答案 A解析 根据盖斯定律,反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)实质上是反应②×2+反应③×2-反应①,即所求的反应热ΔH=ΔH2×2+ΔH3×2-ΔH1n=[-393.5×2+(-285.8)×2-(-870.3)]kJ·mol-1=-488.3kJ·mol-1。10.通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。化学键Si—OSi—ClH—HH—ClSi—SiSi—C键能/kJ·mol-1460360436431176347工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)===Si(s)+4HCl(g),该反应的反应热ΔH为( )A.236kJ·mol-1B.-236kJ·mol-1C.412kJ·mol-1D.-412kJ·mol-1答案 A解析 反应热=反应物的键能之和-生成物的键能之和,即ΔH=360kJ·mol-1×4+436kJ·mol-1×2-176kJ·mol-1×2-431kJ·mol-1×4=236kJ·mol-1。11.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ·mol-1、1411.0kJ·mol-1和1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )A.-44.2kJ·mol-1B.44.2kJ·mol-1C.-330kJ·mol-1D.330kJ·mol-1答案 A解析 ①C2H4(g)+3O2(g)===2CO2(g)+2H2O(l)ΔH=-1411.0kJ·mol-1②C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-1366.8kJ·mol-1根据盖斯定律①-②得:C2H4(g)+H2O(l)===C2H5OH(l)ΔH=-44.2kJ·mol-1,故应选A。12.已知:C(s)+O2(g)===CO2(g) ΔH=-393.5kJ·mol-1;2H2(g)+O2(g)===2H2O(l) ΔH=-483.6kJ·mol-1。现有0.2mol的碳粉和氢气组成的悬浮气,该混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为( )A.1∶1B.1∶2C.2∶3D.3∶2答案 A解析 设混合物中碳粉的物质的量为xmol,氢气的物质的量为ymol,则解得:x=0.1mol,y=0.1mol,则混合物中C和H2的物质的量之比为1∶1。13.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中的ΔH表示生成1mol产物的数据)。n回答下列问题:(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式是________________________________________________________________________。(2)PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式是________________________________________________________________________。(3)P(s)和Cl2(g)分两步反应生成1molPCl5(g)的ΔH3=________________,P(s)和Cl2(g)一步反应生成1molPCl5(g)的ΔH4________(填“大于”“小于”或“等于”)ΔH3答案 (1)P(s)+Cl2(g)===PCl3(g)ΔH=-306kJ·mol-1(2)PCl5(g)===PCl3(g)+Cl2(g)ΔH=93kJ·mol-1(3)-399kJ·mol-1 等于解析 (1)反应热等于生成物的总能量减去反应物的总能量,结合题图可写出该反应的热化学方程式P(s)+Cl2(g)===PCl3(g) ΔH=-306kJ·mol-1。(2)根据题图可写出PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式PCl5(g)===PCl3(g)+Cl2(g) ΔH=93kJ·mol-1。(3)根据盖斯定律求得ΔH3=-399kJ·mol-1,且ΔH3=ΔH4。14.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。(1)上图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______________________________________________________________________________________________________________________________。(2)若已知下列数据:化学键H—HN≡Nn键能/kJ·mol-1435943试根据表中及图中数据计算N—H键的键能:________kJ·mol-1。(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:4NH3(g)+3O2(g)===2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①N2(g)+O2(g)===2NO(g) ΔH2=-bkJ·mol-1②若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________kJ·mol-1(用含a、b的式子表示)。(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)ΔH1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3请回答下列问题:ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。答案 (1)N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1 (2)390 (3) (4)2ΔH2-ΔH115.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+O2(g)===CO2(g)ΔH=-283.0kJ·mol-1②S(s)+O2(g)===SO2(g) ΔH=-296.0kJ·mol-1此反应的热化学方程式是_______________________________________________________。(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:CO(g)+NO2(g)===NO(g)+CO2(g)ΔH=-akJ·mol-1(a>0)2CO(g)+2NO(g)===N2(g)+2CO2(g)ΔH=-bkJ·mol-1(b>0)若用标准状况下3.36LCO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为________kJ(用含有a和b的代数式表示)。(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1①CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=?②若1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=______________。答案 (1)2CO(g)+SO2(g)===S(s)+2CO2(g)ΔH=-270kJ·mol-1n(2)0.3 (3)-1160kJ·mol-1解析 (1)依据题意知,处理烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质S,对照反应①和②,并根据盖斯定律将反应①×2-②可得答案。(2)假设两个反应分别为①、②,由①×2+②可得:4CO(g)+2NO2(g)===N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1,反应中转移电子为8e-。因此标准状况下的3.36LCO还原NO2时,转移电子为×8mol=0.3mol,放出的热量为×(2a+b)kJ=kJ。(3)CH4还原NO2至N2的热化学方程式为CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1,根据盖斯定律,ΔH=(ΔH1+ΔH2),解得ΔH2=-867kJ·mol-1×2-(-574kJ·mol-1)=-1160kJ·mol-1。查看更多