- 2022-04-09 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学阶段质量检测(一)物质结构元素周期律新人教版
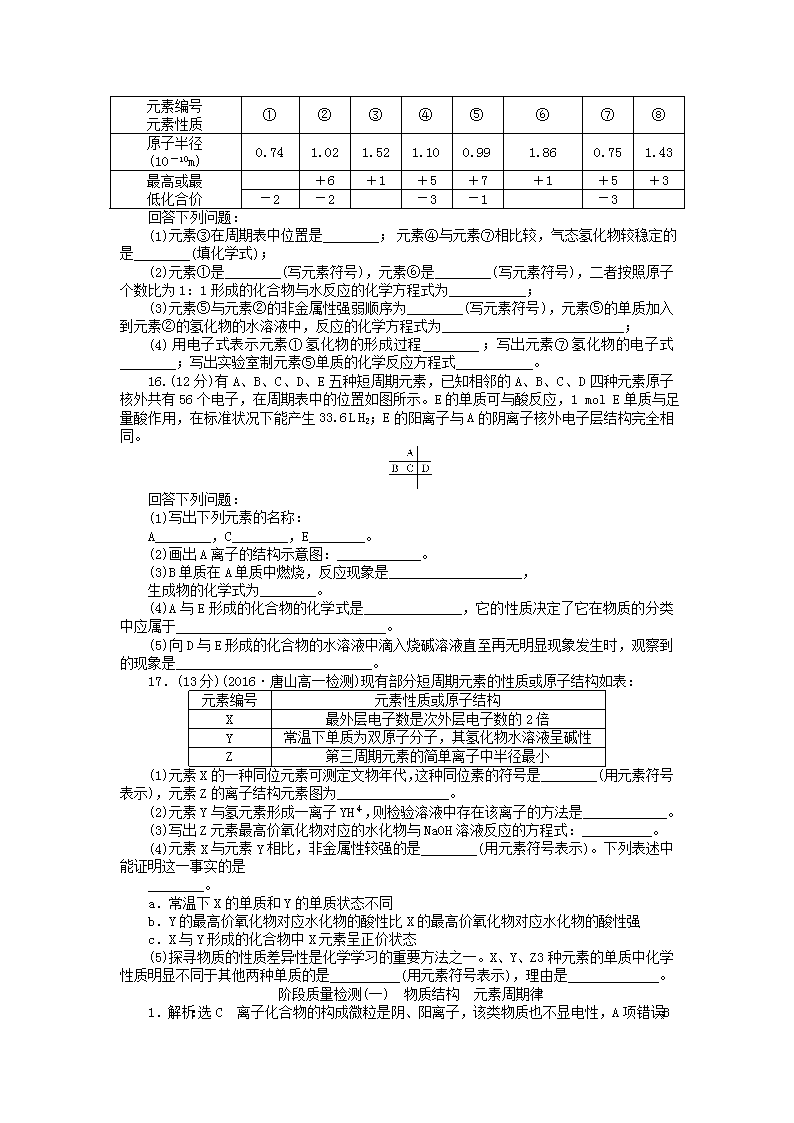
物质结构 元素周期律(时间:60分钟 满分:100分)一、选择题(本题包括12小题,每小题3分,共36分)1.下列说法正确的是( )A.宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子和分子B.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物C.利用化学方法,我们可以制造出新的分子,但不能制造出新原子D.由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子2.有5种单核粒子,它们分别是□、□、□+、□2+、□(“□”内元素符号未写出),则它们所属元素种类有( )A.2种 B.3种 C.4种 D.5种3.(2016·临沂高一检测)下列说法正确的是( )A.常温、常压下,只有一种元素的单质是液体B.元素周期表中的所有元素都是从自然界中发现的C.过渡元素不全是金属元素D.常温、常压下,气态单质的分子都是由非金属元素的原子形成的4.下列说法正确的是( )A.形成离子键的阴、阳离子间只存在静电吸引力B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱C.第三周期非金属元素含氧酸的酸性从左到右依次增强D.元素周期律是元素原子核外电子排布周期性变化的结果5.(2015·上海高考)将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )A.2种B.3种C.4种D.5种6.(2016·太原高一检测)下列说法一定不正确的是( )A.某些花岗石产生氡(Rn),从而对人体产生伤害,Rn的质量数是222B.Se是人体必需的微量元素,Se和Se互为同位素C.6C-NMR(核磁共振)可用于含碳化合物的结构分析,C的中子数为6D.原子结构示意图既可以表示16O,也可以表示18O7.(2016·宁波高一检测)根据元素周期表判断,下列叙述不正确的是A.周期表中第七周期共有32种元素B.周期表中共有18个列,其中形成化合物种类最多的在第14列C.除过渡元素外周期表中最外层电子数相同的元素都位于同一族中D.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等8.(2016·山东济南高一检测)目前人类已发现的非金属元素除稀有气体外,共16种。对这16种元素的相关判断:①都是主族元素,最外层电子数都大于4 ②单质在反应中都只作氧化剂 ③氢化物常温下都呈气态 ④氧化物常温下都可以与水反应生成酸,其中不正确的是( )A.只有①② B.只有①③C.只有③④D.①②③④9.(2016·南京高一检测)如图所示,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )abcdeA.元素b位于第ⅥA族,有+6、-2两种常见化合价B.五种元素中,元素e的性质最稳定nC.元素c和d的最高价氧化物对应的水化物的酸性:c>dD.元素c和e的气态氢化物的稳定性:c>e10.(2015·新课标全国卷)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )A.元素的非金属性次序为c>b>aB.a和其他3种元素均能形成共价化合物C.d和其他3种元素均能形成离子化合物D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、611.(2016·沈阳高一检测)X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )A.已知mXa+与nYb-,得m+a=n-bB.离子半径:Yb->Z(b+1)->Xa+C.Z(b+1)-的还原性一定大于Yb-D.气态氢化物的稳定性Hb+1Z一定大于HbY12.有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如表所示:①He-268.8(a)-249.5Ar-185.8Kr151.7②F2-187.0Cl2-33.6(b)58.7I2-184.0③(c)19.4HCl-84.0HBr-67.0HI-35.3④H2O100.0H2S-60.0(d)-42.0H2Te-1.8⑤CH4-161.0SiH4-112.0GeH4-90.0(e)-52.0对应表中内容,下列叙述中正确的是( )A.a、b、c代表的化学物中均含化学键B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸C.系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2TeD.表中物质HF和H2O,由于氢键的影响,其分子特别稳定二、非选择题(本题共5小题,共64分)13.(10分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。(1)W与Y可形成化合物W2Y,该化合物的电子式为________。(2)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___________。(3)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。14.(14分)(1)请用下列4种物质的序号填空:①O2 ②NH4NO3 ③K2O2 ④NH3,既有离子键又有极性键的是________。(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为__________________________。(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是_____________________。(4)现有a~g7种短周期元素,它们在元素周期表中的位置如图,请据此回答下列问题;①元素的原子间反应最容易形成离子键的是________。A.c和fB.b和gC.d和gD.b和e②d和g元素形成的分子中所有原子________(填“是”或“不是”)都满足最外层为8电子结构。15.(15分)现有下列短周期元素性质的数据:n元素编号元素性质①②③④⑤⑥⑦⑧原子半径(10-10m)0.741.021.521.100.991.860.751.43最高或最低化合价+6+1+5+7+1+5+3-2-2-3-1-3回答下列问题:(1)元素③在周期表中位置是________;元素④与元素⑦相比较,气态氢化物较稳定的是________(填化学式);(2)元素①是________(写元素符号),元素⑥是________(写元素符号),二者按照原子个数比为1:1形成的化合物与水反应的化学方程式为___________;(3)元素⑤与元素②的非金属性强弱顺序为________(写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为__________________________;(4)用电子式表示元素①氢化物的形成过程________;写出元素⑦氢化物的电子式________;写出实验室制元素⑤单质的化学反应方程式___________。16.(12分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:(1)写出下列元素的名称:A________,C________,E________。(2)画出A离子的结构示意图:____________。(3)B单质在A单质中燃烧,反应现象是___________________,生成物的化学式为________。(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________________________。(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是____________________________。17.(13分)(2016·唐山高一检测)现有部分短周期元素的性质或原子结构如表:元素编号元素性质或原子结构X最外层电子数是次外层电子数的2倍Y常温下单质为双原子分子,其氢化物水溶液呈碱性Z第三周期元素的简单离子中半径最小(1)元素X的一种同位元素可测定文物年代,这种同位素的符号是________(用元素符号表示),元素Z的离子结构元素图为________________。(2)元素Y与氢元素形成一离子YH,则检验溶液中存在该离子的方法是____________。(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的方程式:__________。(4)元素X与元素Y相比,非金属性较强的是________(用元素符号表示)。下列表述中能证明这一事实的是________。a.常温下X的单质和Y的单质状态不同b.Y的最高价氧化物对应水化物的酸性比X的最高价氧化物对应水化物的酸性强c.X与Y形成的化合物中X元素呈正价状态(5)探寻物质的性质差异性是化学学习的重要方法之一。X、Y、Z3种元素的单质中化学性质明显不同于其他两种单质的是__________(用元素符号表示),理由是_____________。阶段质量检测(一) 物质结构 元素周期律n1.解析:选C 离子化合物的构成微粒是阴、阳离子,该类物质也不显电性,A项错误;B项可能是同素异形体形成的混合物;原子是化学变化中的最小微粒,所以化学反应不能制造出新原子;属于电解质的共价化合物中不存在阴、阳离子,如HCl分子。2.解析:选B 有K、Ar、Ca等3种元素。3.解析:选D 常温、常压下,Br2、Hg是液体,气态单质的分子全部由非金属元素的原子形成,A错、D对;元素周期表中有些元素是人工合成的,B错;过渡元素都是金属元素,C错。4.解析:选D 离子键是阴、阳离子间通过静电作用形成的,静电作用包括静电吸引和静电排斥,A错误;同主族元素从上到下的非金属性减弱,故HF、HCl、HBr、HI的热稳定性依次减弱,但HF、HCl、HBr、HI的还原性依次增强,B错误;根据元素的非金属性越强,其对应的最高价含氧酸的酸性越强,C未指明是最高价含氧酸,C错误;元素周期律实质是元素原子核外电子排布周期性变化,D正确。5.解析:选C Na2O、NaOH、Na2S、Na2SO4都含有离子键,加热融化时,需要克服相同类型的作用力。6.解析:选C 6C的中子数为13-6=7。7.解析:选C 元素周期表中第七周期共有32种元素,A正确;周期表中共有18列,其中形成化合物种类最多的元素是碳元素,在第14列,即第ⅣA族,B正确;氦的最外层电子数是2,但不在第A族,而是在0族,C错误;L层电子为奇数的所有元素分别是锂、硼、氮、氟,所在族的序数与该元素原子的L层电子数相等,D正确。8.解析:选D 由氢、硼原子最外层电子数小于4,H2和C等单质常作还原剂,H2O常温下呈液态,SiO2不与水反应可判断①~④均错。9.解析:选D a必为He元素,则b是O,c是P,d是Cl,e是As元素,氧元素没有+6价,稀有气体的性质最稳定,酸性H3PO4查看更多