- 2022-04-09 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学第二章章末小结与测评讲义新人教版选修3
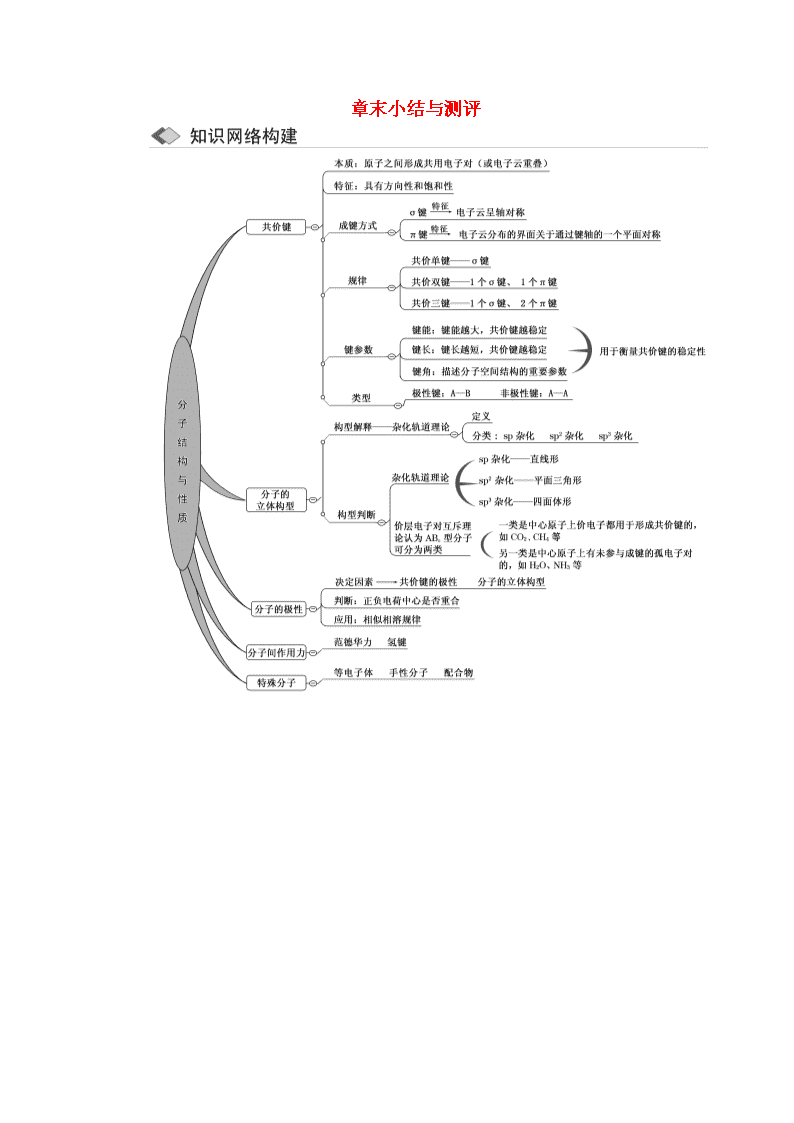
章末小结与测评n考点一 化学键与分子的立体构型考纲要求1.了解共价键的主要类型σ键和π键,说出σ键和π键的明显差别和一般规律。2.能应用键参数——键能、键长、键角说明简单分子的某些性质。3.结合实例说明等电子原理的应用。4.了解共价分子结构的多样性和复杂性。5.能应用有关理论判断简单分子或离子的立体构型。6.理解价层电子对互斥理论、杂化轨道理论和配合物理论。7.了解配位键和配合物,会判断简单配合物的成键情况。考纲说明 化学键的内容主要考查化学键类型、σ键、π键的判断,分子的立体构型主要考查价层电子对互斥理论、原子的杂化类型、粒子的立体构型等。分子构型的判断主要依据价层电子对互斥理论,杂化轨道理论是对分子结构的解释而不是判断的依据。杂化类型的判断要依据中心原子的价层电子对数。1.(1)(2016·全国甲卷)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。①[Ni(NH3)6]SO4中阴离子的立体构型是_______________。②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。(2)(2016·全国乙卷)①Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_____________________________。②比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_________________。GeCl4GeBr4GeI4熔点/℃-49.526146沸点/℃83.1186约400③光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________。④Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是_____________。解析:(1)①SO中,S原子的价层电子对数为=4,成键电子对数为4,故SO的立体构型为正四面体。②[Ni(NH3)6]2+中,由于Ni2+具有空轨道,而NH3中N原子含有孤电子对,两者可通过配位键形成配离子。③由于NH3分子间可形成氢键,故NH3的沸点高于PH3。NH3分子中,N原子形成3个σ键,且有1个孤电子对,N原子的轨道杂化类型为sp3,立体构型为三角锥形。由于空间结构不对称,NH3属于极性分子。(2)①锗虽然与碳为同族元素,但比碳多了两个电子层,因此锗的原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键。②由锗卤化物的熔沸点由Cl到I呈增大的趋势且它们的熔沸点较低,可判断它们均为分子晶体,而相同类型的分子晶体,其熔沸点取决于相对分子质量的大小,因为相对分子质量越大,分子间的作用力就越大,熔沸点就越高。③Zn和Ge为同周期元素,Ge在Zn的右边,因此Ge的电负性比Zn的强;O为活泼的非金属元素,电负性强于Ge和Zn,因此三者电负性由大至小的顺序为O、Ge、Zn。④Ge单晶为金刚石型结构,金刚石中碳原子的杂化方式为sp3,因此Ge原子的杂化方式也为sp3。微粒之间存在的作用力为共价键。答案:(1)①正四面体 ②配位键 N③高于 NH3分子间可形成氢键 极性 sp3(2)①Ge原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键n②GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强③O>Ge>Zn④sp3 共价键2.(2015·新课标全国卷Ⅰ节选)(1)碳在形成化合物时,其键型以共价键为主,原因是________。(2)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子________。解析:(1)在原子结构中,最外层电子小于4个的原子易失去电子,而碳原子的最外层是4个电子,且碳原子的半径较小,难以通过得或失电子达到稳定结构,所以通过共用电子对的方式,即形成共价键来达到稳定结构。(2)CS2分子中,C与S原子形成双键,每个双键都是含有1个σ键和1个π键,分子空间构型为直线形,则含有的共价键类型为σ键和π键;C原子的最外层形成2个σ键,无孤电子对,所以为sp杂化;O与S同主族,所以与CS2具有相同空间构型和键合形式的分子为CO2;与二氧化碳互为等电子体的离子有SCN-,所以SCN-的空间构型和键合方式与CS2相同。答案:(1)C有4个价电子且半径较小,难以通过得失电子达到稳定结构(2)σ键和π键 sp CO2、SCN-(或COS等)3.(2015·新课标全国卷Ⅱ节选)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:(1)C和D反应可生成组成为1∶3的化合物E,E的立体构型为________,中心原子的杂化轨道类型为________。(2)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______________________。解析:(1)C和D形成的物质为PCl3,其中P含有一对孤电子对,其价层电子对数是4,所以立体构型为三角锥形,中心原子为sp3杂化。(2)化合物Cl2O的中心原子O含有2对孤电子对,价层电子对数为4,所以立体构型为V形,Cl2和碳酸钠反应的化学方程式为2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl。答案:(1)三角锥形 sp3 (2)V形 4 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl4.(2015·山东高考节选)(1)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。(2)F2与其他卤素单质反应可形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) ΔH=-313kJ/mol,F—F键的键能为159kJ/mol,Cl—Cl键的键能为242kJ/mol,则ClF3中Cl—F键的平均键能为________kJ/mol。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。解析:(1)OF2分子中O与2个F原子形成2个σ键,O原子还有2对孤电子,所以O原子的杂化方式为sp3,空间构型为角形或V形。(2)根据焓变的含义可得:242kJ/mol+3×159kJ/mol-6×ECl—F=-313kJ/mol,解得Cl—F键的平均键能ECl—F=172kJ/mol;组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,所以ClF3的为熔、沸点比BrF3的低。答案:(1)角形或(V形) sp3 (2)172 低5.(1)(2014·新课标全国卷Ⅰ节选)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1mol乙醛分子中含有的σ键的数目为________。(2)(2014·山东高考节选)石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。n①图甲中,1号C与相邻C形成σ键的个数为________。②图乙中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。解析:(1)由乙醛的结构式知,—CH3、—CHO上的碳原子分别为sp3、sp2杂化。由于1个乙醛分子中含有4个CH键、1个CCS键、1个CO键,共有6个σ键,故1mol乙醛分子中含有6NA个σ键。(2)①图甲中,1号C与相邻的3个C形成1个碳碳双键和2个碳碳单键,即形成3个σ键和1个π键。②图乙中,1号C除与3个C形成化学键外,还与羟基氧原子形成化学键,故该C采取sp3杂化。答案:(1)sp3、sp2 6NA (2)①3 ②sp3 <考点二 分子的性质考纲要求1.说明化学键和分子间作用力的差别。2.说明分子间作用力对物质状态的影响。3.能应用分子结构的知识判断分子的极性、解释无机含氧酸分子的酸性。4.理解影响物质溶解性的因素及相似相溶规律。5.了解手性分子在生命科学等方面的应用。考纲说明 分子的性质主要包括氢键、分子间作用力、键的极性和分子的极性,键参数对分子结构和性质的影响及氢键、分子间作用力对物质熔、沸点的影响。高考对该部分以综合题考查,常与化学键的知识结合在一起。6.(2015·福建高考节选)(1)Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有________molσ键。(2)一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。参数分子分子直径/nm分子与H2O的结合能E/(kJ/mol)CH40.43616.40CO20.51229.91①“可燃冰”中分子间存在的2种作用力是_______________。②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。解析:(1)在1molNi(CO4)中,CO与Ni间的四个配位键属于σ键,在CO分子中C、O原子间存在一个σ键,可见1molNi(CO)4中含有8molσ键。(2)①在“可燃冰”中水分子间存在分子作用力(即范德华力),同时水分子间的H、O原子还可形成氢键。②利用表中数据知,CO2的分子直径小于笼状结构的空腔直径,可在笼中放入CO2分子;另外CO2与H2nO的结合能大于CH4,可用于置换CH4。答案:(1)8(2)①氢键,范德华力 ②CO2的分子直径小于笼状结构空腔直径且与H2O的结合能大于CH47.(上海高考)PH3是一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断错误的是( )A.PH3分子呈三角锥形B.PH3分子是极性分子C.PH3沸点低于NH3沸点,因为P—H键键能低D.PH3分子稳定性低于NH3分子,因为N—H键键能高解析:选C 因为NH3分子间可以形成氢键,所以PH3沸点低于NH3的沸点。8.(福建高考节选)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是______________。解析:分析图中曲线,随着相对分子质量增大,硅烷的沸点升高。答案:硅烷的相对分子质量越大,分子间的范德华力越大,沸点越高9.(1)(山东高考)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为________________________________________________________________________。的沸点比高,原因是________________________________________________________________________。(2)[双选](海南高考)下列分子中,属于非极性分子的是( )A.SO2 B.BeCl2C.BBr3D.COCl2解析:(1)化学键是强烈的相互作用;氢键的作用力比化学键弱,但比范德华力的作用力要强。可形成分子间的氢键,而形成的是分子内的氢键,故前者比后者的沸点要高。(2)根据价层电子对互斥理论(VSEPR)可得四种分子的结构如下:、、、。答案:(1)O—H键、氢键、范德华力 形成分子内氢键,而n形成分子间氢键,分子间氢键使分子间作用力增大(2)B、C查看更多