- 2021-11-12 发布 |
- 37.5 KB |
- 11页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏专版2020中考化学复习方案题型突破01图表类试题试题
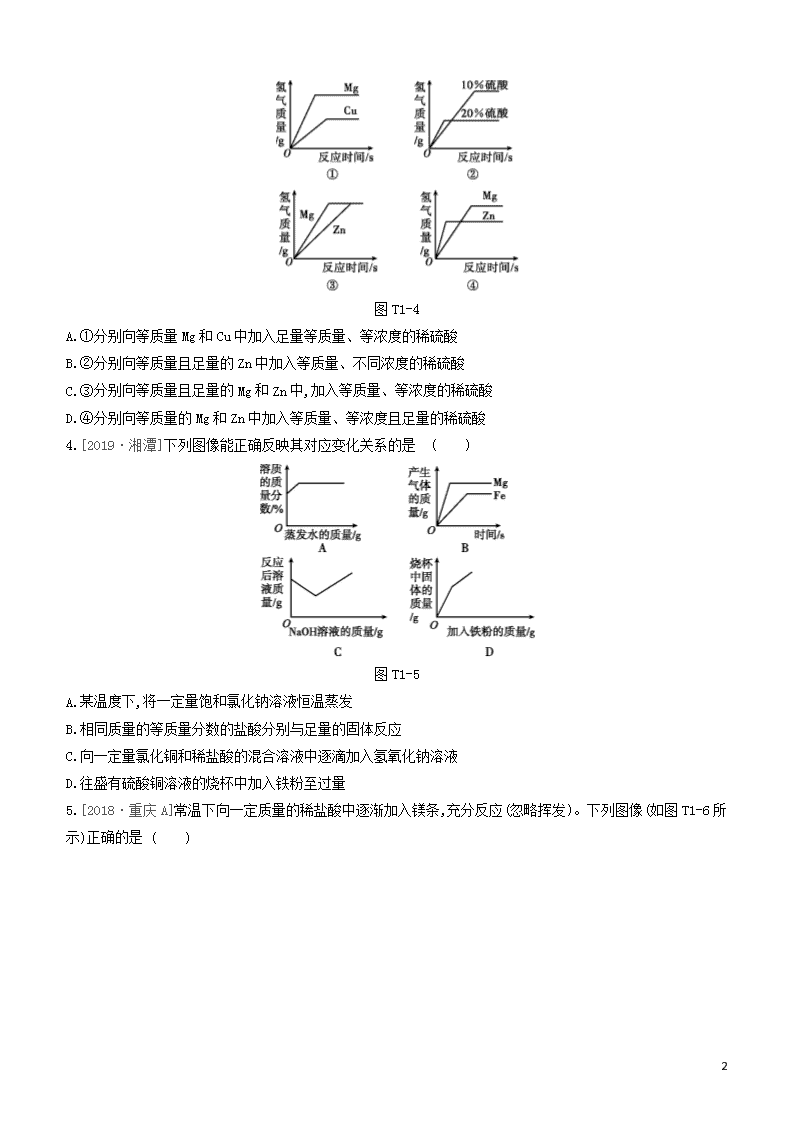
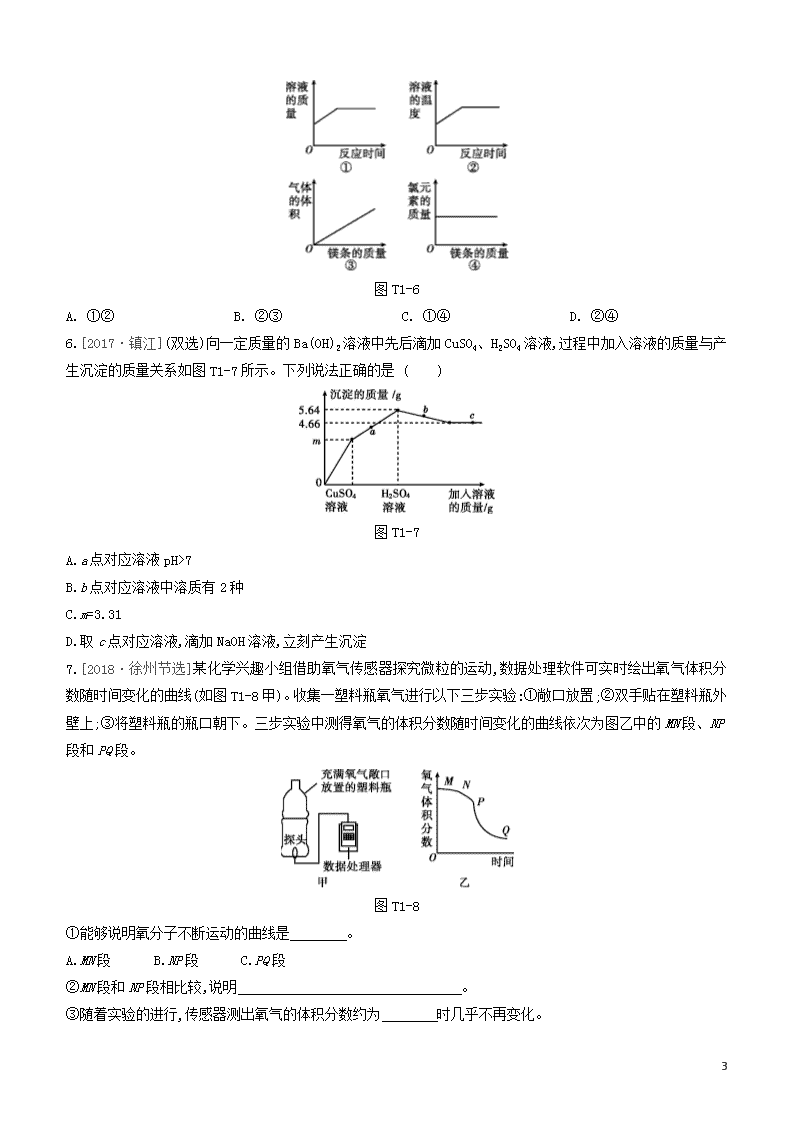
题型突破(一) 图表类试题 类型一 坐标曲线类 |针对训练| 1.[2017·淮安]下列四个图像中,能正确反映对应变化关系的是 ( ) A.用CuFe2O4-x作催化剂,光分解水生成氢气与氧气 B.向氯化钠的饱和溶液中加入硝酸钾 C.向混有少量硫酸的硫酸铜溶液中加入氢氧化钠溶液 D.向一定质量的碳酸钠溶液中加水 2.向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图T1-3所示。下列说法正确的是( ) 图T1-3 A.a点所得固体为银和铁 B.b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌 C.c点所得溶液中的溶质为硝酸亚铁和硝酸锌 D.d点所得固体为银、铁和锌 3.[2018·河北]图T1-4所示的四个图像,分别对应四种过程,其中正确的是 ( ) 11 图T1-4 A.①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸 B.②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸 C.③分别向等质量且足量的Mg和Zn中,加入等质量、等浓度的稀硫酸 D.④分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸 4.[2019·湘潭]下列图像能正确反映其对应变化关系的是 ( ) 图T1-5 A.某温度下,将一定量饱和氯化钠溶液恒温蒸发 B.相同质量的等质量分数的盐酸分别与足量的固体反应 C.向一定量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 D.往盛有硫酸铜溶液的烧杯中加入铁粉至过量 5.[2018·重庆A]常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图像(如图T1-6所示)正确的是 ( ) 11 图T1-6 A. ①② B. ②③ C. ①④ D. ②④ 6.[2017·镇江](双选)向一定质量的Ba(OH)2溶液中先后滴加CuSO4、H2SO4溶液,过程中加入溶液的质量与产生沉淀的质量关系如图T1-7所示。下列说法正确的是 ( ) 图T1-7 A.a点对应溶液pH>7 B.b点对应溶液中溶质有2种 C.m=3.31 D.取c点对应溶液,滴加NaOH溶液,立刻产生沉淀 7.[2018·徐州节选]某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可实时绘出氧气体积分数随时间变化的曲线(如图T1-8甲)。收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下。三步实验中测得氧气的体积分数随时间变化的曲线依次为图乙中的MN段、NP段和PQ段。 图T1-8 ①能够说明氧分子不断运动的曲线是 。 A.MN段 B.NP段 C.PQ段 ②MN段和NP段相比较,说明 。 ③随着实验的进行,传感器测出氧气的体积分数约为 时几乎不再变化。 11 8.[2018·常州]研究小组同学对铝和稀盐酸的反应进行了探究。如图T1-9甲所示实验,先检查装置气密性,再将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如图乙所示的气体压强与时间的关系曲线图。 图T1-9 (1)铝与稀盐酸反应的化学方程式为 。 (2)AB段气体压力变化不明显的原因是 ;CD段气体压力逐渐下降的原因是 。 (3)从BC段看反应的速率是先变快后变慢,导致变慢的因素有 (填序号)。 a.铝片的表面积 b.盐酸的浓度 c.温度 类型二 维恩图与数轴类 |针对训练| 1.[2018·深圳]归纳总结是学习化学的重要方法之一。下列排序正确的是 ( ) A.金属活动性顺序: B.溶液的pH: C.地壳中的元素含量: D.气体的密度: 2.[2018·巴中]建立模型是学习化学的重要方法。如图T1-12所示有关模型正确的是 ( ) 图T1-12 3.化学概念间有包含、并列、交叉等不同关系。下列选项符合图T1-13所示关系的是 ( ) 11 图T1-13 选项 A B C D X 化合反应 纯净物 物理变化 化学反应 Y 氧化反应 混合物 化学变化 化合反应 4.有A、B两种酸碱指示剂,它们显示的颜色与溶液pH的关系如图T1-14所示,它们在甲溶液和乙溶液中显示的颜色如下表。下列判断错误的是 ( ) 图T1-14 溶液指示剂 甲 乙 A 黄色 蓝色 B 无色 粉红色 A.甲溶液呈酸性 B.乙溶液的pH可能为11 C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体 D.在滴有A指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色 5.[2018·镇江]下列排序正确的是 ( ) A.利用金属的年代: B.铁元素质量分数: C.碳元素的化合价: D.物质在水中的溶解性: 6.[2019·无锡]下列有关X、Y表示的概念之间存在如图T1-15所示的包含关系的是 ( ) 图T1-15 选项 X Y A 氧化物 化合物 B 化合反应 分解反应 C 碱性溶液 碱溶液 D 饱和溶液 浓溶液 7.[2019·青岛]化学概念之间在逻辑上存在并列、交叉和包含等关系。图T1-16中概念之间关系正确的是 11 ( ) 图T1-16 类型三 微观模型类 |针对训练| 1.[2019·邵阳]“”和“”表示两种不同元素的原子,下列可能表示氧化物的是 ( ) 图T1-20 2.[2019·哈尔滨]丙烯是液化石油气的主要成分之一。下列有关叙述正确的是 ( ) 图T1-21 A.丙烯是有机高分子化合物 B.丙烯由碳、氢、氧三种原子构成 C.丙烯中碳元素的质量分数最大 D.丙烯分子中碳、氢元素的个数比为1∶2 3.[2018·盐城]如图T1-22为汽车尾气处理所涉及反应的微观过程,下列说法错误的是 ( ) 图T1-22 A.反应前后元素种类不变 B.反应前后原子数目没有增减 C.生成物的分子个数比为1∶1 D.该反应能减少有害气体排放 4.[2017·扬州] 某反应前后分子变化的微观示意图如下。下列说法正确的是 ( ) 11 图T1-23 A.反应物与生成物共有3种物质 B.反应后原子个数增多 C.该图可示意CO与O2的反应 D.反应物中元素的化合价都为0 5.某反应前后分子变化的微观示意图如图T1-24。下列说法正确的是 ( ) “”“”和“”分别表示不同元素的原子 图T1-24 A. 反应物中没有单质 B. 图中共表示了9种物质 C. 反应后元素种类增多 D. 反应前后原子个数不变 6.[2019·葫芦岛]如图T1-25为某化学反应的微观示意图。请回答: 图T1-25 (1)在上述反应中不变的粒子是 (填“分子”或“原子”)。 (2)在A、B、C、D中属于单质的是 (填字母)。 (3)一个D分子是由 构成的。 (4)写出该反应的化学方程式: 。 7.[2019·潍坊]在“宏观—微观—符号”之间建立联系是化学学科特有的思维方式,能帮助我们更好地认识物质变化的本质。请回答下列问题。 (1)晋代葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银”,丹砂指的是HgS,该反应的微观示意图可以表示为: 图T1-26 请写出该反应的化学方程式: ,微粒“”表示的物质属于 (填“单质”或“化合物”)。 (2)由初中学习可知:中和反应的微观实质是氢离子和氢氧根离子结合生成了水分子,即:H++OH-H2 11 O。像这种用实际参加反应的离子符号来表示化学反应的式子叫离子方程式。离子方程式的书写一般按以下步骤(以氯化镁溶液与氢氧化钾溶液反应为例): Ⅰ.写出氯化镁溶液与氢氧化钾溶液反应的化学方程式: 。 Ⅱ.把易溶于水、易电离的物质写成离子形式,难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:Mg2++2Cl-+2K++2OH-Mg(OH)2↓+2Cl-+2K+。 Ⅲ.删去两边不参加反应的离子,即得离子方程式:Mg2++2OH-Mg(OH)2↓。 请回答: ①如图T1-27是碳酸钠溶液和稀盐酸反应的微观示意图,请写出该反应的离子方程式: ; 图T1-27 ②写出一个与Fe+Cu2+Fe2++Cu相对应的化学方程式 。 ③下列各组离子,在pH=3的无色水溶液中能大量共存的是 (填序号)。 A.K+、Fe2+、Cl-、SO42- B.Na+、Ca2+、NO3-、OH- C.Na+、Ca2+、Cl-、CO32- D.NH4+、Ba2+、Cl-、NO3- 11 【参考答案】 类型一 针对训练 1.D [解析]水分解生成的氢气和氧气的体积比是2∶1,氢气和氧气的质量比为1∶8;向饱和的氯化钠溶液中加入硝酸钾,硝酸钾会继续溶解,溶液质量逐渐增加,但溶液中氯化钠的质量不变,氯化钠的质量分数会逐渐减小,直至硝酸钾溶解达到饱和;向混有少量硫酸的硫酸铜溶液中加入氢氧化钠溶液,氢氧化钠先与硫酸反应生成硫酸钠和水,所以,开始加入氢氧化钠溶液时,溶液中没有沉淀产生;碳酸钠的水溶液呈碱性,其溶液的pH>7,向一定量的碳酸钠溶液中加水稀释,溶液碱性减弱,pH逐渐减小,随着水量的增加,溶液的pH会无限接近于7。 2.D [解析]a点所得固体为硝酸银和锌反应生成的银;b点时硝酸银完全反应,所得溶液中的溶质为没有反应的硝酸亚铁和反应生成的硝酸锌;c点时硝酸亚铁完全反应,所得溶液中的溶质为反应生成的硝酸锌;d点所得固体为反应生成的银、铁和过量的锌。 3.C [解析]铜不能和稀硫酸反应生成氢气,故A选项错误;金属过量,酸完全反应,所以等质量的稀硫酸中,浓度大的产生氢气多,故B选项错误;等质量、足量的镁和锌与等质量、等浓度的稀硫酸反应,产生氢气的质量相同,消耗锌的质量大,且镁比锌活泼,所以镁反应速率较快,C选项正确;等质量的镁和锌与足量的等质量、等浓度的稀硫酸反应,镁产生的氢气较多,且镁反应的速率较快,故D选项错误。 4.D [解析]因为氯化钠溶液是饱和的,恒温蒸发的过程中溶液也一直处于饱和状态,所以溶质的质量分数不变;Mg比Fe活泼,Mg与盐酸反应生成氢气的速率比Fe与盐酸反应生成氢气的速率快,相同质量、等质量分数的盐酸分别与足量的固体反应会产生相同质量的氢气;向一定量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液时,稀盐酸会先与氢氧化钠溶液反应,故开始时溶液的质量增大;往盛有硫酸铜溶液的烧杯中加入铁粉时,铁粉将硫酸铜溶液中的铜置换出来,每56份质量的铁置换出64份质量的铜,析出铜的质量大于加入铁粉的质量,所以烧杯中固体的质量会快速增大,当反应结束,铁粉过量时,烧杯中增加的固体质量为铁粉的质量,增加幅度较小。 5.C [解析]①常温下向一定质量的稀盐酸中逐渐加入镁条,反应开始前溶液质量大于0,随着反应的进行,溶液质量不断增加,直至稀盐酸反应完,溶液质量达到最大,之后溶液质量不变;②镁与稀盐酸反应放热,随着反应的进行,温度不断升高,稀盐酸反应结束后,溶液温度开始下降;③镁与稀盐酸反应生成氢气,反应开始前氢气体积等于0,随着反应的进行,氢气体积不断增加,直至稀盐酸反应完,氢气体积达到最大,之后氢气体积不变;④根据质量守恒定律中元素守恒,故反应前后氯元素质量不变。 6.AC [解析]通过图像可以看出,a所处的图像表示在滴加硫酸的过程中,沉淀的质量继续增大,所以a点对应的溶液中含有氢氧化钡,溶液pH>7;b点所处的图像沉淀质量在减小,表示硫酸和氢氧化铜反应,此时溶液中的溶质是硫酸铜一种;由图像中的数据可知,生成的氢氧化铜的质量为5.64 g-4.66 g=0.98 g,设硫酸铜和氢氧化钡反应生成硫酸钡沉淀的质量为x。 CuSO4+Ba(OH)2Cu(OH)2↓+BaSO4↓ 98 233 0.98 g x 98233=0.98 gx 11 x=2.33 g 所以m=2.33 g+0.98 g=3.31 g;取c点对应溶液,硫酸过量,滴加NaOH溶液,不能立刻产生沉淀。 7.①AB ②温度越高,分子运动越快等 ③21% 8.(1)2Al+6HCl2AlCl3+3H2↑ (2)铝表面的氧化铝先与盐酸反应 温度逐渐降低,压力逐渐下降 (3)b 类型二 针对训练 1.A [解析]金属活动性由强到弱的顺序是K、Mg、Cu、Ag;溶液的pH由小到大的顺序是HCl、NaCl、NaOH;地壳中元素的含量由高到低的顺序是O、Si、Al、Fe;气体的密度由大到小的顺序是CO2、O2、H2。 2.D [解析]着火点是物质的固有属性,不能降低;原子核由质子和中子构成,模型中质子不在原子核内;纯净物包括化合物和单质,模型中化合物没包括在纯净物中;按体积计算空气由78%的N2和21%的O2还有1%的其他成分组成,模型描述与事实相符。 3.A 4.D 5.B 6.C 7.B [解析]化合物包含氧化物,不是交叉关系;化合物包括含碳化合物,含碳化合物包括有机物;复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应,没有化合价的变化;溶液分为饱和溶液和不饱和溶液,饱和溶液与浓溶液是交叉关系。 类型三 针对训练 1.D [解析] 图A表示由分子构成的单质,图B表示由原子构成的单质,图C表示两种分子构成的混合物;氧化物是指由两种元素组成的化合物,其中一种元素是氧元素,图D可能表示氧化物。 2.C [解析]丙烯属于有机物,但其相对分子质量比较小,属于有机小分子;丙烯是由丙烯分子构成的,丙烯分子由碳、氢两种原子构成,1个丙烯分子是由3个碳原子和6个氢原子构成的,其化学式为C3H6;丙烯中碳元素、氢元素的质量比为(12×3)∶(1×6)=6∶1,则丙烯中碳元素的质量分数最大;丙烯分子中碳、氢原子的个数比为1∶2,元素只讲种类,不讲个数。 3.C 4.A [解析]由图可知,图中共有3种分子,每种分子表示一种物质,故可表示3种物质;化学反应前后原子的种类、个数均不变;由图可知,该反应中反应物只有一种,与CO和O2反应不符;反应物为化合物,化合物中元素的化合价不为0。 5.D [解析]A中,由微粒的构成可知,反应物中“”是由同种原子构成的,属于单质;B中,由微粒的构成可知,图中共有4种不同分子,表示4种物质;C中,由微粒的变化可知,反应后,原子的种类没有变化,元素种类也没有变化;D中,由微粒的变化可知,反应前后原子个数不变。 6.(1)原子 11 (2)B (3)2个氢原子和1个氧原子 (4)2CO+4H2C2H5OH+H2O 7.(1)HgS+O2Hg+SO2(或HgS+O2Hg+SO2) 单质 (2)MgCl2+2KOHMg(OH)2↓+2KCl ①2H++CO32-H2O+CO2↑ ②Fe+CuSO4FeSO4+Cu(合理即可) ③D 11查看更多