- 2021-11-10 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省锦州市2013年中考化学模拟试卷2
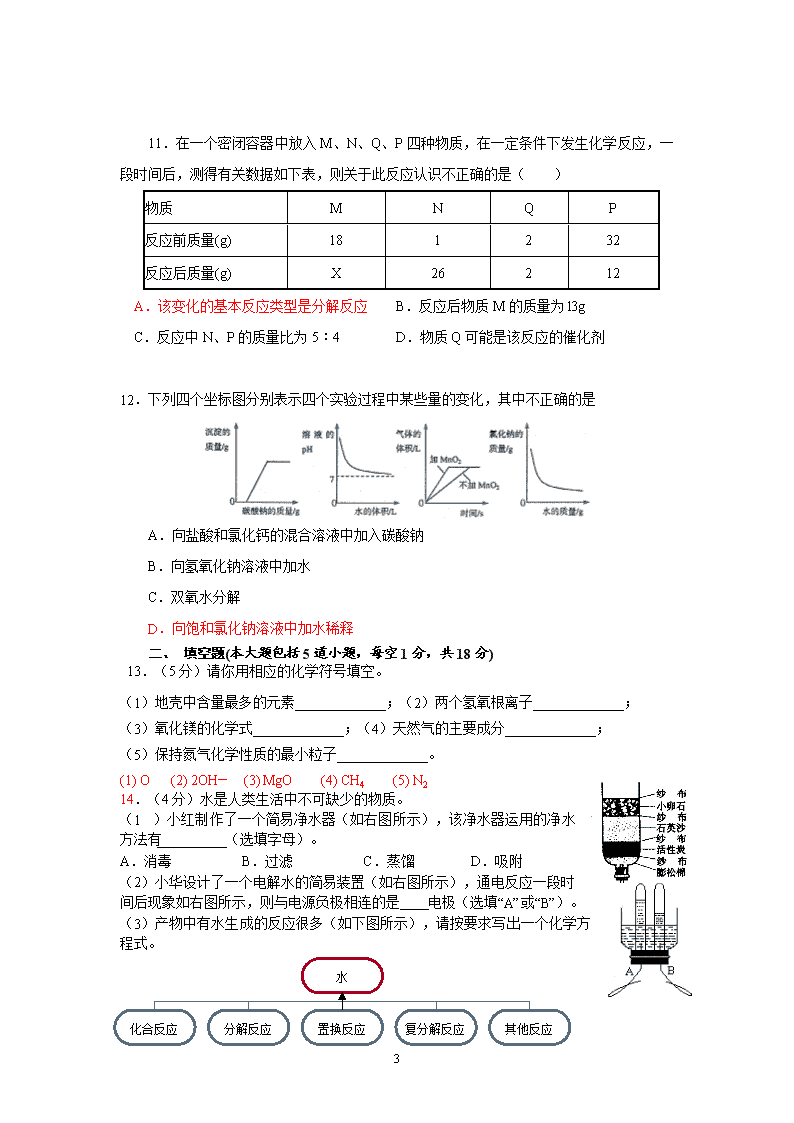
辽宁省锦州市2013年中考化学模拟试卷2 可能用到的相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 S—32 Fe—56 Zn—65 一、 选择题(本大题包括12道小题,共16分。其中1~8小题每小题1分,9~12小题每小题2分。每小题只有一个选项符合题意,请将符合题意选项前的字母填在下表内) 1.下列典故中,从物质变化的角度分析,主要体现化学变化的是( ) A.司马光砸缸 B.凿壁偷光 C.火烧赤壁 D.铁杵磨成针 2.“分类”是化学学习和研究的重要方法之一,下列分类中不正确的是( ) A.硫酸铜、食盐、纯碱— 盐 B.硫酸铵、硝酸钾、尿素—氮肥 C.空气、煤气、碘酒—混合物 D.硫元素、氧元素、氦元素—非金属元素 3.下面是4位同学对“化学与健康”这一话题发表的见解,其中正确的是 ( B ) 4.下列说法中,错误的是 ( ) A.羊毛属于天然纤维 B .尼龙衣料比纯棉衣料透气性好 C.合成橡胶可用于制作汽车轮胎 D.大量使用塑料制品易造成白色污染 5.下列应用及相应原理(用化学方程式表示)都正确的是( ) A.用稀盐酸除铁锈 Fe2O3+6HCl=2FeCl2+3H2O B.用二氧化碳制碳酸饮料 CO2+H2O=H2CO3 C.用电解水的方法测定水的组成 2H2O=2H2↑+O2↑ D.用氢氧化钠制碳酸钠 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 6.2011年3月,日本福岛发生了核泄漏事故,核电站泄漏出来的放射性物质中含有铯—137,过量摄入铯—137会使人的造血系统和神经系统受到损伤。已知铯—137的质子数为55,中子数为82,下列有关铯—137的说法正确的是 ( ) A.铯—137原子的核外电子数为82 B.铯—137的相对原子质量为137 g C.铯—137原子的核电荷数为55 D.铯—137属于非金属元素 7.正确的化学实验操作对实验结果、人身安全都非常重要。在下图所示实验操作中正确的是 9 A.闻气体气味 B.存放氢气 C.倾倒液体 D.稀释浓硫酸 8.目前,科学家提出了一种最经济最理想的获得氢能源的循环体系(如右图)。下列说法错误的是 A.燃料电池能够使化学反应产生的能量转化为电能 B.该氢能源的循环体系能够实现太阳能转化为电能 C.在此循环中发生了反应:2H2O 电解 2H2↑+O2↑ D.目前化学家急需解决的问题是寻找合适的光照条件 9.通过实验可以得出的结论,其中实验结论正确的是 ① ② ③ ④ ⑤ 甲 ① 既可说明甲烷具有可燃性,又说明了甲烷是由氢元素和碳元素组成 ② 既可说明二氧化碳的密度比空气大,又说明了二氧化碳不能燃烧也不支持燃烧 ③ 既可说明水是由氢、氧元素组成,又说明了水分子中氢原子和氧原子个数之比为2:1 ④ 既可探究可燃物的燃烧条件,又说明了白磷的着火点比红磷低 ⑤ 既可说明二氧化碳易溶于水,又说明了二氧化碳具有酸性 A.①②③④ B.②③④⑤ C.②③④ D.①②③④⑤ 10.除去下列物质中混有的少量杂质,所用试剂或操作(括号内)不正确的是…………( ) A.氯化钙中混有少量的碳酸钙 (盐酸) B.盐酸中混有少量的硫酸(硝酸钡溶液) C.熟石灰中混有生石灰(水) D.氧化铜中混有少量的木炭粉 (在空气中灼烧) 9 11.在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( ) 物质 M N Q P 反应前质量(g) 18 1 2 32 反应后质量(g) X 26 2 12 A.该变化的基本反应类型是分解反应 B.反应后物质M的质量为l3g C.反应中N、P的质量比为5︰4 D.物质Q可能是该反应的催化剂 12.下列四个坐标图分别表示四个实验过程中某些量的变化,其中不正确的是 A.向盐酸和氯化钙的混合溶液中加入碳酸钠 B.向氢氧化钠溶液中加水 C.双氧水分解 D.向饱和氯化钠溶液中加水稀释 二、 填空题(本大题包括5道小题,每空1分,共18分) 13.(5分)请你用相应的化学符号填空。 (1)地壳中含量最多的元素_____________;(2)两个氢氧根离子_____________; (3)氧化镁的化学式_____________;(4)天然气的主要成分_____________; (5)保持氮气化学性质的最小粒子_____________。 (1) O (2) 2OH— (3) MgO (4) CH4 (5) N2 14.(4分)水是人类生活中不可缺少的物质。 (1)小红制作了一个简易净水器(如右图所示),该净水器运用的净水方法有 (选填字母)。 A.消毒 B.过滤 C.蒸馏 D.吸附 (2)小华设计了一个电解水的简易装置(如右图所示),通电反应一段时间后现象如右图所示,则与电源负极相连的是 电极(选填“A”或“B”)。 水 化合反应 分解反应 置换反应 复分解反应 其他反应 (3)产物中有水生成的反应很多(如下图所示),请按要求写出一个化学方程式。 9 产物中有水生成的化合反应: ; 产物中有水生成的复分解反应: 。 (1)BD(此空错选不给分,漏选给0.5分) (2)B (3)2H2+O2点燃2H2O NaOH+HCl===NaCl+H2O(或CuO+2HCl===CuCl2+H2O,或CaCO3+2HCl===CaCl2+CO2↑+H2O)(合理答案均可) 15.(6分)小明同学绘制了如右图所示A、B两种固体物质的溶液度曲线: (1)当温度为 ℃时,A物质与B物质的溶解度相等。 (2)若将B物质从溶液中结晶析出,宜采用的方法是 。 (3)我国有许多盐碱湖,湖中溶有大量的NaCl和Na2CO3,那 里的人们“冬天捞碱,夏天晒盐。”据此你认为图中 (填 “A”或“B”)物质的溶解度曲线与纯碱的相似。 15.(3分)(1)40 (2)加热蒸发 (3)A 16.(6分)元宵节是我国的重要传统节日,“接汉疑星落,依楼似月悬。”是唐代著名诗人卢照邻对其盛况的写照,我国许多地方至今仍保留着燃灯放焰、共吃元宵的风俗。 (1)某红焰烟花的配方中包括硫、木炭粉、硝酸锶【Sr(NO3)2】等。 ①硝酸锶中Sr的化合价为: ; ②写出硫燃烧的化学方程式: ; (2)燃放孔明灯(如右图)祈福成为了元宵节的新风尚。小新同学想自制孔明灯,为了使它能飞得更高、更远、更安全,选择作为灯罩的材料应质轻且 ;选择的燃料应燃烧热值大且 ; (3)我市已禁止燃放孔明灯,因为孔明灯燃烧时外焰温度高达300多度,一旦飘落到加油站、液化气站、油库等地,孔明灯会 而引发火灾。(填序号) A.提供可燃物 B.供给氧气 C.使温度达到可燃物的着火点 ) (1)①+2(1分) ②S+O2 点燃 SO2 (2分) (2)不易燃烧 燃烧时间长(各1分) (3)C(1分) 三、 简答题(本大题包括3道小题,共18分) 17.(4分)小思实验操作考试的题目是探究金属的化学性质,内容包括:铜在空气中灼烧、锌与稀硫酸反应、铝丝与硫酸铜溶液反应。下图是他实验操作考试中的部分情景。 (1)上图中有一处错误的操作,该操作是 9 (填序号);正确的操作方法是 (2)操作A的现象是 ; (3)他讲铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是 。 (1)B 试管横放,将锌放在管口,再将试管慢慢竖立起来(2)铜丝表面变黑(3)可能是铝丝表面的氧化氧化膜没有除去 18.(7分)2010年6月5日,世界环境日中国主题为“低碳减排,绿色生活”,旨在传递低碳生活理念,提高公众环保意识。该主题倡导减少二氧化碳的排放,低能量、低消耗的生活方式,从而减少对大气的污染,减缓生态恶化。 (1)下列做法中不符合“低碳绿色生活”理念的是(填序号) ____________。 ①节约用水、用电 ②废物分类回收、利用 ③坚持每天测量空气中二氧化碳的含量 ④减少一次性餐具的使用 (2)任何事物都有其两面性,二氧化碳在生活、生产中也有着广泛的应用。例如: ①日常生活中做灭火剂,这是利用了二氧化碳 和____________ 的性质。 ②工业上用二氧化碳为原料制备纯碱。请写出检验纯碱中CO32一的方法:________________________________________________。 (3)大气中的二氧化碳利用植物光合作用能生成氧气,请写出实验室中制取氧气的化学反应方程式________________________。 (4)开发和利用清洁而高效的新能源替代传统能源: ①氢气是未来最理想的能源,理想的制氢方法 。 ②开发太阳能、风能、海水热能等能源。目前,烟台太阳能热水器的应用达到总户数的48%以上;风电装机容量已达到37.4千瓦,居全省第一;并正在尝试利用海水热能来取暖。这些新能源的利用,除了能减少CO2的排放外,还有哪些好处? 。(请列举一条) (7分)(1)③ (2)①密度比空气大 不燃烧、不支持燃烧 ②取少量纯碱,配成溶液,向其中加入少量稀盐酸,产生一种能使澄清石灰水变浑浊的气体,则证明含有CO32一(试剂、现象合理就得分,试剂、现象各0.5分) (3)2H2O2 H2O+O2↑ (4)①利用太阳能分解水制氢气 ②节约煤、石油等不可再生的能源(或降低对环境的污染等其它合理答案也可) 19.(7 9 分)A、B、C、D、E、F、G、H、I都是初中化学学过的物质。其中B为红色固体单质,D为混合物,E、H均为黑色固体,F是一种无色气体。它们之间有下图的转化关系(部分生成物已省去)。 △ (1)用化学式表示D的组成 、 。 (2)F→G的反应类型 。 (3)写出以下三个反应的化学方程式: ①F→E ②H→C ③G→I (4)指出B的一种用途 。 (1)BaSO4 Cu (OH)2 (2) 化合反应 (3)①Fe2O3 + 3CO 高温 2Fe + 3CO2 ②CuO + H2SO4 = CuSO4 + H2O ③CO2 + Ca(OH)2 = CaCO3↓+ H2O (4)做导线等 四、 实验题(本大题包括4道小题,共20分) 20.(4分)某学生学习了双氧水制氧气的实验后,想起自己家里也有一瓶消毒 用双氧水,但由于标签已部分受损无法判断其是否变质,所以他将该瓶溶液带到学 校,进行了如图所示的研究。 试回答 (1)放入二氧化锰的作用是____________。 (2)如果该溶液未变质,应该观察到的现象是________________________________。 样品中发生反应的化学方程式是_________________________________________。 (3)达到环保要求,试验后二氧化锰的处理是 。 (4)参加动物体内化学反应所起作用与二氧化锰作用相同的有机物叫 。 (1)催化作用 (2)试管内有气泡产生,带火星的木条复燃 MnO2 2 H2O2 ====2 H2O +O2↑ 9 (3)过滤、晾干备用,不能随意倒掉。 (4)酶或生物催化剂 21.(7分)实验室摆放着如下一排仪器,根据图示,按要求回答下列问题: (1)仪器C为集气瓶,写出仪器A的名称_____________;在B、D、E中选择一种仪器,该仪器在实验室主要用于___________________________________________,使用该仪器时应当注意的问题是__________________________________(写一点)。 (2)按实验原理和气体的性质选择实验装置,可用上图中的仪器组装成实验室制取二氧化碳气体的发生和收集装置,你选择的仪器是___________(填仪器编号),制取二氧化碳气体的反应原理是____________________________ _(写化学方程式)。 (3)理论上,上述装置也可用于在二氧化锰作催化剂的条件下,分解过氧化氢水溶液制取氧气;但实验室用该反应制取氧气时,一般不在是试管中而是在锥形瓶先加入二氧化锰,且要通过分液漏斗逐滴滴入过氧化氢水溶液,请你说出这样操作的原因_______________________________________________________________________。 (1)水槽;仪器B,用作少量试剂的反应容器;加热后不能骤冷;仪器D,用作配制溶液和较多量试剂的反应容器;加热时应放置在石棉网上;仪器E,用于加热;用外焰加热;要用火柴点燃;不能用嘴吹灭 (2)B、C、G、H;CaCO3+2HClCaCl2+H2O+CO2↑ (3)过氧化氢在二氧化锰作催化剂的条件下,反应速度极快,滴加可以控制生成氧气的速率;如果在试管这样小的空间内,迅速产生大量的气体,易引起瓶塞冲出,液体喷出伤人 22.(6分)实验助手小娟走进实验室和老师一起检查每个 实验桌上的药品、仪器是否齐备,走到某组的时候, 看到了一个不和谐的“音符”(如右图): ⑴此情此景你首先想到的是它可能变质了, 该变质反应的化学方程式为: ; ⑵围绕此瓶NaOH溶液是否变质的问题,小娟利用实验室的三种试剂(氯化钙溶液、稀盐酸、酚酞试液)展开了探究活动。①取少量溶液于试管中,滴加某种试剂,有气泡产生,由此证明NaOH溶液已经变质。你认为小娟所加的试剂是 ; ②欲证明变质的溶液中尚存NaOH,请你帮助小娟完成以下探究方案: 探究目的 探究步骤 预计现象 除尽溶液中的CO32- ①:取少量溶液于试管中,滴加足量的 试剂 有白色沉淀产生 证明溶液中尚存NaOH ②:向实验①所得溶液中滴加酚酞试液 ⑶通过上述探究,说明氢氧化钠溶液暴露在空气中容易变质,故应 保存。 9 ⑴2NaOH+CO2=Na2CO3+H2O(2分) ⑵①稀盐酸②氯化钙,酚酞变红 ⑶密封 23.(4分)整理实验室时,小明发现实验台上有一瓶失落标签的白色粉末,可能是碳酸钠,也可能是氢氧化钙。白色粉末是哪种物质呢?请你提出猜想并设计实验进行探究。(设计一种即可) 我的猜想 操作步骤 实验现象 结论 (答出一种情况合理即可得分) 是碳酸钠 取少量粉末于试管中,滴加稀盐酸 有气泡产生 该白色粉末是碳酸钠 是氢氧化钙 取少量粉末溶于水,取上层清夜,通入CO2 有混浊 该白色粉末是氢氧化钙 五、 计算题(本大题包括2道小题,共8分) 24. 25.(6分)化学小组的同学为了测定某铜矿中碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]的质量分数,称取该铜矿样品30g,加入132.2g稀盐酸时恰好完全反应,共生成CO2气体4.4g。反应的化学方程式如下: Cu2(OH)2CO3 +4HCl=2CuCl2+3H2O +CO2↑ 请你计算: ⑴铜矿样品中碱式碳酸铜的质量是多少克?其质量分数是多少? ⑵反应后所得溶液中溶质质量分数是多少? (假设铜矿中的杂质不与稀盐酸反应,也不溶于水。) 解:设铜矿中碱式碳酸铜的质量是为x,生成氯化铜的质量为y。 Cu2(OH)2CO3 +4HCl=2CuCl2 + 3H2O+ CO2↑ 222 270 44 x y 4.4g (1分) = x =22.2g (1分) = y =27g (1分) 铜矿样品中碱式碳酸铜的质量分数为 ×100%=74% (1分) 反应后所得氯化铜溶液的质量为 22.2g+132.2g-4.4g=150g (1分) 9 反应后所得氯化铜溶液中溶质的质量分数为 ×100%=18% (1分) 答:铜矿样品中碱式碳酸铜的质量是22.2g ,其质量分数是74%。反应后所得氯化铜溶液中溶质的质量分数是18%。 9查看更多