- 2021-11-10 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新人教版九年级化学上册例题精讲:第6单元课题2二氧化碳制取的研究
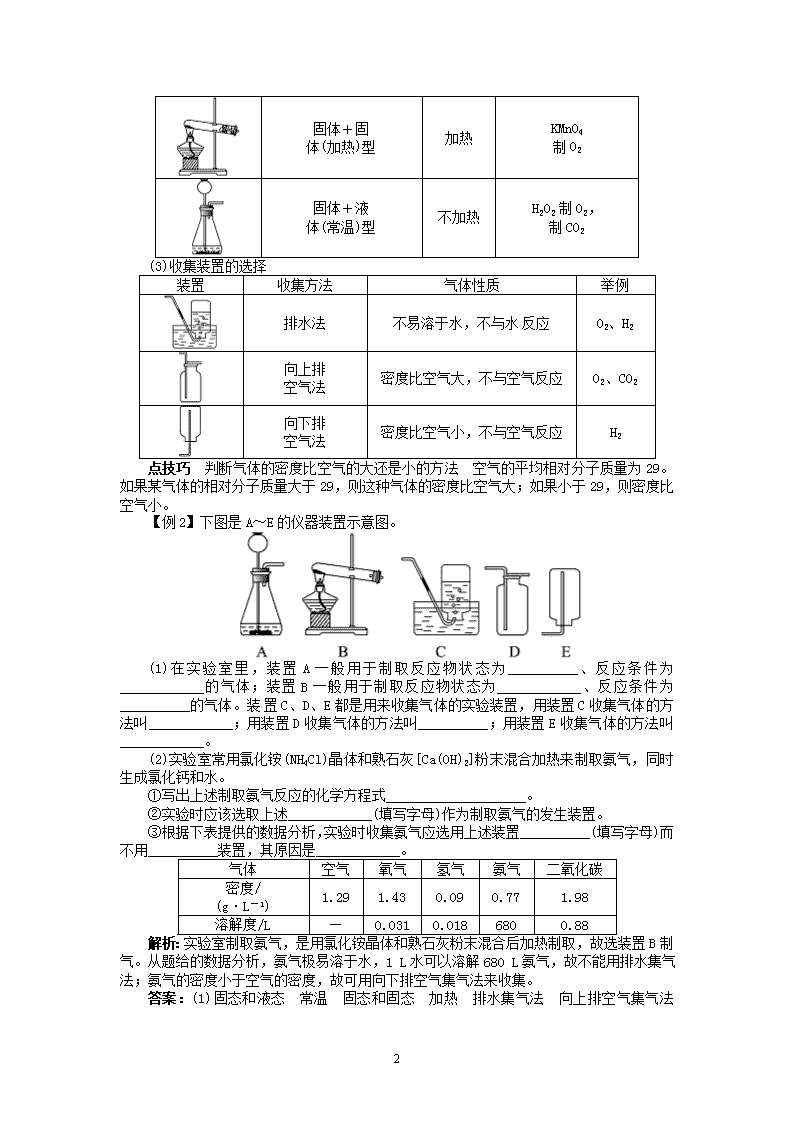
1 课题 2 二氧化碳制取的 研究 答案: (1)CaCO3+2HCl===CaCl2+H2O+CO2↑ (2)将生成的气体通入澄清石灰水,若石灰水变 浑浊,证明气体是二氧化碳 (3)口 (4)熄灭 (5)反应物的状态 (6)反应条件 (7)密度 (8)是否溶于水,是否与水反 应 1.实验室制取二氧化碳的反应原理 (1 )药品 大理石(或石灰石)和稀盐酸 大理石或石灰石的主要成分是碳酸钙,化学式是 CaCO3。 (2)反应原理 CaCO3+2HCl===CaCl2+H2CO3 碳酸钙 氯化钙 碳酸 碳酸不稳定,容易分解生成二氧化碳和水。 H2CO3===H2O+CO2↑ 总的化学方程式是: CaCO3+2HCl===CaCl2+H2O+CO2↑ 释疑点 实验室制取 CO2 时不用稀硫酸、浓盐酸的原因 ①实验室制取二氧化碳不用稀 硫酸,因为稀硫酸与石灰石反应生成的硫酸钙微溶于水,覆盖在石灰石表面,阻碍石灰石与 硫酸接触,使反应中断。②不用浓盐酸。浓盐酸易挥发出氯化氢气体,导致二氧化碳不纯。 【例 1】在实验室里 制取二氧化碳气体,可选择的药品是( ) A.碳酸钠粉末与浓盐酸 B.块状石灰石与稀硫酸 C.石灰石 D.块状大理石和稀盐酸 解析: A × 碳酸钠粉末与浓盐酸反应过快,且浓盐酸易挥发,碳酸钠价格贵 B × 不能用稀硫酸,因为反应生成的硫酸钙会阻止反应继续进行 C × 高温分解石灰石是二氧化碳的工业制法 D √ 反应速率适中,易于操作和收集,是合适的药品 答案:D 2.制取气体的一般思路 (1)制取装置的选择 实验室制取气体的装置包括发生装置和收集装置。发生装置主要由反应物的状态、反应 条件决定,收集装置主要考虑生成气体的物理性质(溶解性、密度大小)。 (2)发生装置的选择 装置 反应类型 反应条件 举例 2 固体+固 体(加热)型 加热 KMnO4 制 O2 固体+液 体(常温)型 不加热 H2O2 制 O2, 制 CO2 (3)收集装置的选择 装置 收集方法 气体性质 举例 排水法 不易溶于水,不与水 反应 O2、H2 向上排 空气法 密度比空气大,不与空气反应 O2、CO2 向下排 空气法 密度比空气小,不与空气反应 H2 点技巧 判断气体的密度比空气的大还是小的方法 空气的平均相对分子质量为 29。 如果某气体的相对分子质量大于 29,则这种气体的密度比空气大;如果小于 29,则密度比 空气小。 【例 2】下图是 A~E 的仪器装置示意图。 (1)在实验 室里,装置 A 一般用 于制取反应物 状态为__________、反应 条件为 ____________的气体;装置 B 一般用于制取反应物状态为____________、反应条件为 __________的气体。装 置 C、D、E 都是用来收集气体的实验装置,用装置 C 收集气体的方 法叫____________;用装置 D 收集气体的方法叫__________;用装置 E 收集气体的方法叫 ____________。 (2)实验室常用氯化铵(NH4Cl)晶体和熟石灰[Ca(OH)2]粉末混合加热来制取氨气,同时生 成氯化钙和水。 ①写出上述制取氨气反应的化学方程式____________________。 ②实验时应该选取上述____________(填写字母)作为制取氨气的发生装置。 ③根据下表提供的数据分析,实验时收集氨气应选用上述装置__________(填写字母) 而不用__________装置,其原因是____________。 气体 空气 氧气 氢气 氨气 二氧化碳 密度/ (g·L-1) 1.29 1.43 0.09 0.77 1.98 溶解度/L — 0.031 0.018 680 0.88 解析:实验室制取氨气,是用氯化铵晶体和熟石灰粉末混合后加热制取,故选装置 B 制气。从题给的数据分析,氨气极易溶于水,1 L 水可以溶解 680 L 氨气,故不能用排水集 气法;氨气的密度小于空气的密度,故可用向下排空气集气法来收集。 答案:(1)固态和液态 常温 固态和固态 加热 排水集气法 向上排空气集气法 3 向下排空气集气法 (2)①2NH4Cl+Ca(OH)2=====△ 2NH3↑+2H2O+CaCl2 ②B ③E C 和 D 氨气的密度比空气的密度小,而且氨气极易溶于水 3.实验室制取二氧化碳 (1)发生装置:实验室制取二氧化碳是固体和液体反应,不需加热,因此可任意选择下 列发生装置: 谈重点 制取 CO2 的不同装置 A 装置为简易装置,不便于加液体;B、C 装置使用了长 颈漏斗,便于添加液体,使用 B、C 装置时应注意,长 颈漏斗下端管口应伸入液面以下,防 止产生的气体从长颈漏斗逸出;D 装置使用了分液漏斗,便于加液体,还可以利用活塞控制 滴液的快慢,便于控制反应速率。 (2)收集装置:二氧化碳能溶于水,所以不能用排水法收集,其密度比空气大,所以只 能采用向上排空气法收集。如图。 (3)实验步骤 ①组装仪器;②检查装置的气密性;③将大理石或石灰石放入反应容器内;④塞紧双孔 塞;⑤由长颈漏斗加稀盐酸;⑥用向上排 空气法收集。 (4)检验 通入澄清的石灰水,石灰水变浑浊,证明 是二氧化碳。 (5)验满、存放 将燃着的木条放于瓶口,若木条熄灭证明已集满。收集满二氧化碳的集气瓶要用玻璃片 盖住并正放在桌面上。 【例 3】如图所示是制取并收集二氧化碳的装置。 (1)当发生装置连接好后,接着进行的实验 步骤是__________________________。 (2) 实 验 时 应 怎 样 加 试 剂 ? ___________________________________________________。 (3)收集气体时,导管为什么要伸入集气瓶底部?__________________________。 (4)长颈漏斗的下端要伸到液面以下,原因是__________________________。 解析:制取气体以前,先检查装置是否漏气,装药品时先加固体,再加液体;为了防止 产生的 CO2 从长颈漏斗逸出,长颈漏斗下端必须插到液面以下。用排空气法收集气体时,导 管伸到集气瓶底部便于将瓶中空气排尽。 答案:(1)检查装置的气密性 (2)先向锥形瓶中加入大理石或石灰石,再从长颈漏斗处 加入稀盐酸 (3)便于排尽集气瓶内的空气,收集到纯 CO2 (4)防止产生的 CO2 从长颈漏斗 逸出 4 4.比较 O2、CO2 的实验室制法 比较 O2 CO2 发生 装置 收集 装置 实验 原理 药品① 方程式③ 药品② 方程式④ 检验 方法 带火星的木条放入瓶内 通入澄清石灰水 验满 方法 带火星的木条放在瓶口 燃着的木条放在瓶口 注:①:过氧化氢与二氧化锰; 高锰酸钾;氯酸钾与二氧化锰 ②石灰石(或大理石)与稀盐酸 ③2KClO3=====MnO2 △ 2KCl+3O2↑; 2KMnO4=====△ K2MnO4+MnO2+O2↑; 2H2O2=====MnO2 2H2O+O2↑ ④CaCO3+2HCl===CaCl2+H2O+CO2↑ 【例 4】(实验综合题)实验室制取气体所需装置如下图所示。 请回答以下问题: (1)装置中标“a”的仪器名称是______________。 (2)用高锰酸钾制取氧气时,所选用的发生装置是__________(填字母序号,下同),收 集装置是 C 或____________________。 (3)用大理石与稀盐酸制取二氧化碳时,所选用的发生装置是__________________,其 反应的化学方程式为______________________。该装置还可用于制氧气,其反应的化学方程 式为_____________ ___________。 解析:本题考查实验室制取气体时,实验装置的选择。发生装置的选择考虑反应物状态 和反应条件,如反应物是固体,反应需要加热,用 A 装置;反应物是固体和液体,反应不需 要加热,用 B 装置。收集装置的选择一般考虑气体的性质,如果气体不易溶于水,也不与水 反应,首先考虑用排水法;若不能用排水法,密度比空气大的,用向上排空气法;密度比空 气小的,用向下排空气法。 答案:(1)集气瓶 (2)A D (3)B CaCO3+2HCl===CaCl2+H2O+CO2↑ 2H2O2=====MnO2 2H2O +O2↑ 5.实验室制取气体时应考虑哪些因素 5 (1)选择反应速度适中、价格便宜、来源广泛、 污染少、实验安全,所制气体纯净或易 分离的药品。例如,实验室制取二氧化碳时,不用浓盐酸制取,因易挥发;不用碳酸钠制取, 因其价格贵且反应太快;不用稀硫酸制取,因其与石灰石反应生成微溶物硫酸钙,使反应难 以继续进行。 (2)选择原理科学、节能、操作简便的反应。例如,高温分解石灰石也能产生二氧化碳, 但需消耗燃料,不节能,且操作麻烦,不适合实验室制取。 【例 5】(探究题)下列反应都能生成二氧化碳: ①人和动物的呼吸作用 ②木炭在空气中燃烧 ③蜡烛燃烧 ④碳和氧化铜反应 ⑤石灰石(块状)与硫酸 ⑥碳酸钙粉末与稀盐酸 ⑦石灰石(块状)与浓盐酸 ⑧石灰石(块状)与稀盐酸 其中可用于实验室制 CO2 的是( ) A.⑥⑧ B.⑧ C.⑥⑦⑧ D.①②③④⑤⑥⑦⑧ 解析:⑥反应太快,不易收集;⑦用浓盐酸制取,得到的二氧化碳不纯,混有从发生装 置中挥发出来的氯化氢气体,故不选 A、C、D;⑧反应符合实验室制取气体选用药品的原则, 故选 B。 答案:B查看更多