- 2021-09-29 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学 每日一题之快乐暑假 第14天 海水资源的开发利用(含解析)新人教版
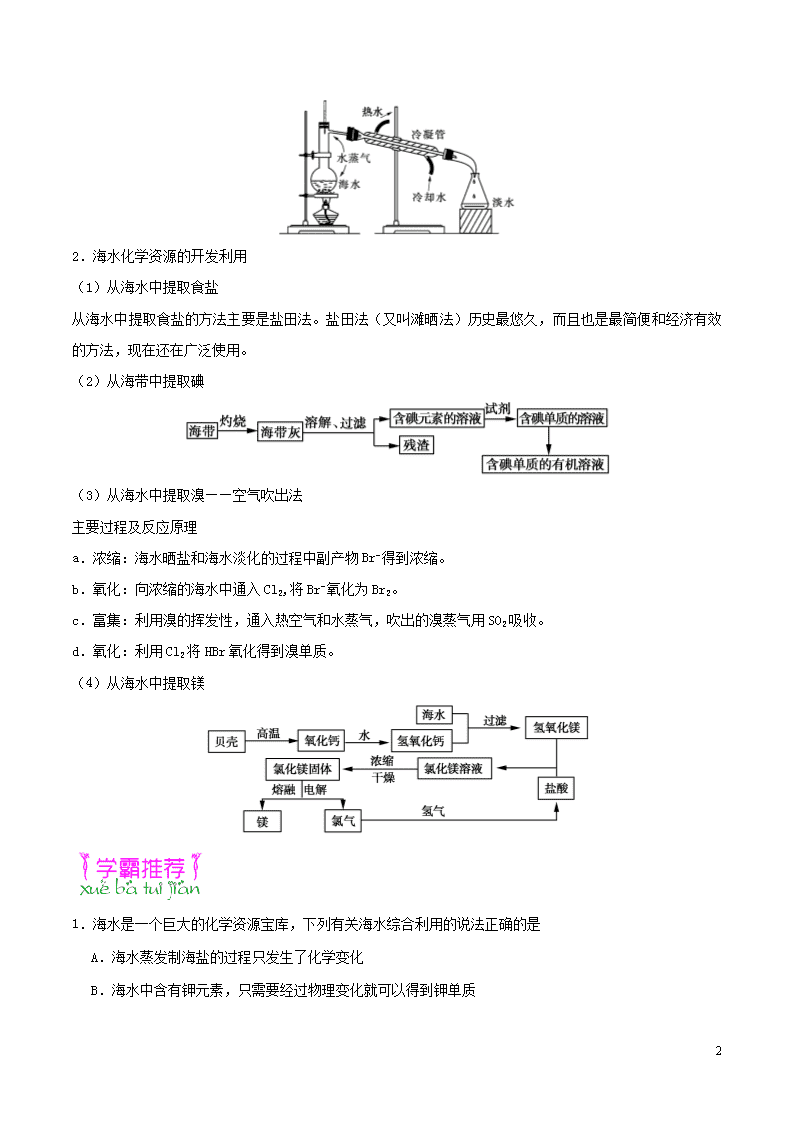
第14天 海水资源的开发利用 高考频度:★★★☆☆ 难易程度:★★☆☆☆ 海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是 A.蒸发海水可以生产单质碘 B.蒸馏海水可以得到淡水 C.电解海水可以得到单质镁 D.电解海水可以制得金属钠 【参考答案】B 1.海水水资源的开发利用 (1)海水的淡化:通过从海水中提取淡水或从海水中分离出盐分,可以达到淡化海水的目的。 (2)海水淡化的方法及原理 淡化方法 原理 蒸馏法 将海水加热蒸发汽化,然后冷凝水蒸气得到蒸馏水 电渗析法 利用阴、阳离子交换膜对水中阴离子、阳离子的选择透过性,在外加直流电场作用下,使水中的一部分离子转移入另一部分水中而达到除盐目的 离子交换法 用阳离子交换树脂和阴离子交换树脂除去海水中的阳离子和阴离子,得到去离子水的方法 (3)海水蒸馏原理示意图 5 2.海水化学资源的开发利用 (1)从海水中提取食盐 从海水中提取食盐的方法主要是盐田法。盐田法(又叫滩晒法)历史最悠久,而且也是最简便和经济有效的方法,现在还在广泛使用。 (2)从海带中提取碘 (3)从海水中提取溴——空气吹出法 主要过程及反应原理 a.浓缩:海水晒盐和海水淡化的过程中副产物Br−得到浓缩。 b.氧化:向浓缩的海水中通入Cl2,将Br−氧化为Br2。 c.富集:利用溴的挥发性,通入热空气和水蒸气,吹出的溴蒸气用SO2吸收。 d.氧化:利用Cl2将HBr氧化得到溴单质。 (4)从海水中提取镁 1.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是 A.海水蒸发制海盐的过程只发生了化学变化 B.海水中含有钾元素,只需要经过物理变化就可以得到钾单质 5 C.利用潮汐发电是将化学能转化为电能 D.从海水中提取溴单质的过程涉及氧化还原反应 2.海洋是非常巨大的资源宝库,下列有关海洋资源开发利用的说法,不正确的有 A.海洋约占地球表面积的71%,水储量达1.3×109亿吨,人类不存在缺水问题 B.海水资源的利用包括水资源的利用和化学资源的利用,二者可以综合进行 C.海水中除H2O外,还含有Cl、Na、K、Mg、Ca、S、F等多种元素的化学资源 D.从海水中获取食盐的过程属于物理变化 3.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如图所示,其中不正确的是 A.溴在周期表中位于第四周期第ⅦA族 B.步骤③说明溴具有挥发性 C.步骤④的离子方程式为Br2+SO2+H2O2H++2Br−+ D.步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 4.从海水中提取镁的流程如图所示(框图中是主要产物): 请回答相关问题。 (1)下列说法不正确的是 (填序号)。 A.上述方法的优点之一是原料取自大海 B.进行①②③步骤的目的是富集MgCl2 C.工业上也可用电解熔融氧化镁的方法制取镁 D.电解法冶炼金属要消耗大量的电能 (2)海水进入沉淀池前,对海水进行处理有以下两种方案。 5 方案一:将晒盐后的卤水通入沉淀池。 方案二:将加热蒸发浓缩后的海水通入沉淀池。 你认为方案 更合理,理由是 ___________________________。 (3)步骤③中发生反应的离子方程是 _____________________________。 步骤④中发生反应的化学方程式是 _____________________________。 5.空气吹出法是目前海水提溴的主要方法之一。海水提溴的流程如图所示: (1)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 _______________________________________。 (2)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因: 。 (3)步骤⑧中蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。所用主要仪器的名称是 。 (4)步骤①、②之后并未直接用含Br2的海水进行蒸馏得到液溴,而是经过“空气吹出”、“SO2水溶液吸收”、“Cl2氧化”后再蒸馏,这样操作的原因是 ____________________________________________________。 1.【答案】D 2.【答案】A 5 【解析】A项,海洋中的水成分复杂,含盐量高,无法直接使用,有限的淡水资源日益减少,错误。B项,海水经处理可得淡水、海水中的一些金属和非金属元素经一系列的物理和化学变化得到金属或非金属单质等,正确。C项,海水中含有H、O、Cl、Na、K、Mg、Ca、S、F等80多种元素,正确。D项,海水蒸发,析出NaCl晶体,属于物理变化,正确。 3.【答案】C 【解析】A项,Br的原子序数为35,其核外有4个电子层,位于第四周期,最外层有7个电子,位于第ⅦA族,正确。B项,含Br2的海水中通入空气,Br2被吹出,说明Br2具有挥发性,正确。C项,步骤④的离子方程式为Br2+SO2+2H2O2Br-+4H++,错误。D项,溴在水中溶解度不大,液溴在下层,溴水在上层,可分液得到液溴,正确。 4.【答案】(1)C (2)一 加热海水需要大量的能源,浪费了能源,增加了生产成本 (3)Mg(OH)2+2H+Mg2++2H2O MgCl2Mg+Cl2↑ 5.【答案】(1)酸化可抑制Cl2、Br2与水反应 (2)温度过高,产生大量水蒸气,溴蒸气中水蒸气增多;温度过低,溴不能完全蒸出 (3)分液漏斗 (4)“空气吹出”、“SO2水溶液吸收”、“Cl2氧化”的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,蒸馏含溴的溶液效率更高,消耗能量更少,成本降低 【解析】(1)步骤①中用硫酸酸化可提高Cl2的利用率,是因为在酸性溶液中Cl2、Br2与水的反应受到抑制。(2)步骤⑥的蒸馏过程中,温度过高,会产生大量水蒸气,溴蒸气中水蒸气含量增加;温度过低,溴不能完全蒸出。(4)步骤③、④、⑤的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,蒸馏含溴的溶液效率更高,消耗能量更少,成本降低,效益更高。 你正走在学霸的路上 5查看更多