- 2021-08-24 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年安徽省黄山市屯溪一中高二下学期入学考试化学试题 Word版
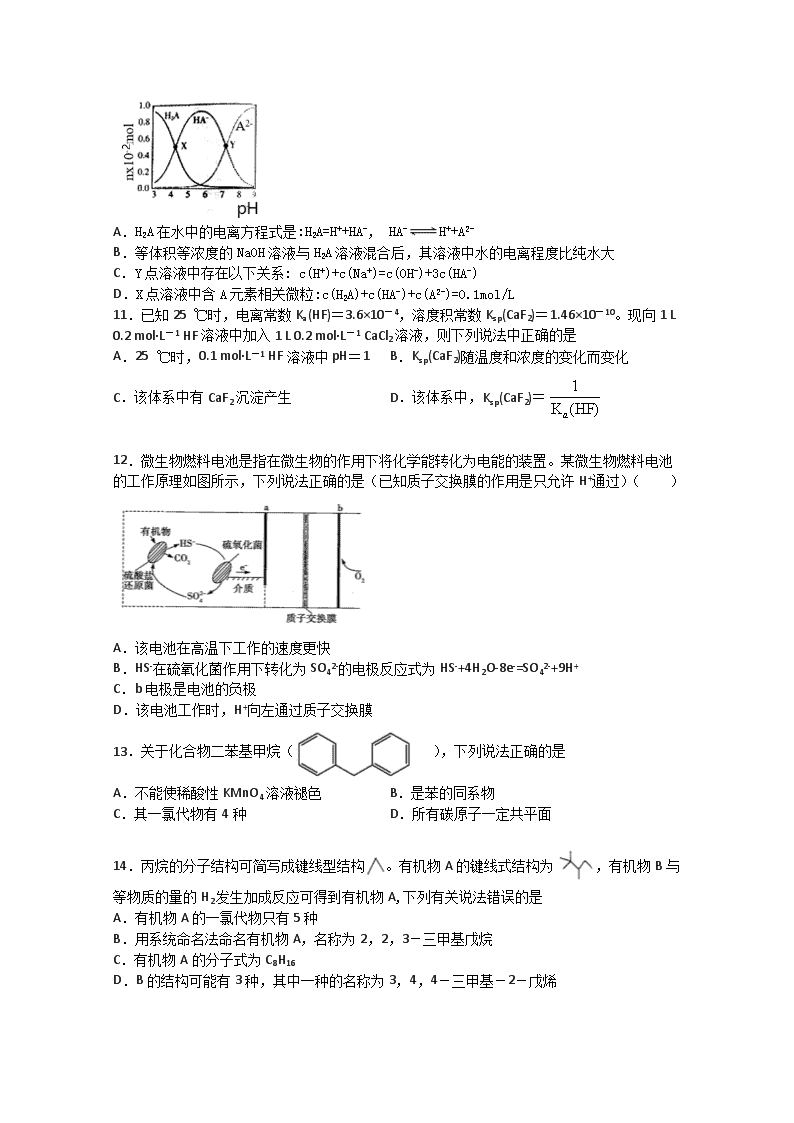
安徽省黄山市屯溪一中2019-2020学年高二下学期入学考试化学试题 考试时间:90分钟;总分100分 注意事项: 1.I卷用2B铅笔涂到答题卡上 2.II卷将答案填写在答题卡上相应位置 可能用到的相对原子质量: H-1. C-12. O-16. Na-23. Ba-137. S -16. Fe-56 第I卷(选择题) 一、选择题(16小题,每题3分,共48分) 1.化学创造了丰富的物质世界,指导着我们的生产、生活。下列说法正确的是 A.超级电容器材料石墨烯属于烯烃 B.钙钛矿太阳能电池和锂离子电池的工作原理相同 C.服用阿司匹林()出现水杨酸反应时用小苏打解毒 D.利用双氧水和75%乙醇的强氧化性消杀新冠病毒 2.在298K、100kPa时,已知: 2H2O(g)=2H2(g)+O2(g) △H1 H2(g)+Cl2(g)=2HCl(g) △H2 2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3 则△H3与△H1和△H2间的关系正确的是: A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2 3.CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图: 下列说法不正确的是( ) A.合成气的主要成分为CO和H2 B.①→②过程可表示为CO2+NiC=2CO+Ni C.①→②过程吸收能量 D.Ni在该反应中做催化剂 4.298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是 A.溶液的pH不再变化 B.2v正(I-)=v逆(AsO33-) C.c(AsO43-)/c(AsO33-)不再变化 D.c(I-)=2ymol·L-1 5.反应A(g) + 3B(g) 2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的 . A B C D 6.已知反应,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( ) A.若实验②、④只改变一个条件,则由实验②、④得出结论:升高温度,化学反应速率加快 B.若实验①、②只改变一个条件,则由实验①、②得出结论:增大反应物浓度,化学反应速率加快 C.若实验②、③只改变一个条件,则实验③使用了催化剂 D.0~10min内,实验③的平均速率v(Y)=0.04 mol/(L·min) 7.COCl2(g)⇌CO(g)+Cl2(g) ΔH>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( ) A.①②④B.①④⑥C.②③⑥D.③⑤⑥ 8.等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3 ③NaHSO4 ④NaHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列正确的是( ) A.⑤③①④② B.⑤③①②④ C.②④③①⑤ D.②④①③⑤ 9.用物质的量都是0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-) 小于c(Na+),则下列判断正确的是( ) A.c(H+)>c(OH-) B.c(HCN)>c(CN-)=0.2mol/L C.c(HCN)>c(CN-) D.c(CN-)>c(OH-)=0.1mol/L 10.常温下,向100mL 0.1mol/L的H2A溶液中滴加0.1mol/LNaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是 A.H2A在水中的电离方程式是:H2A=H++HA-, HA-H++A2- B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 C.Y点溶液中存在以下关系: c(H+)+c(Na+)=c(OH-)+3c(HA-) D.X点溶液中含A元素相关微粒:c(H2A)+c(HA-)+c(A2-)=0.1mol/L 11.已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是 A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化 C.该体系中有CaF2沉淀产生 D.该体系中,Ksp(CaF2)= 12.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是(已知质子交换膜的作用是只允许H+通过)( ) A.该电池在高温下工作的速度更快 B.HS-在硫氧化菌作用下转化为SO42-的电极反应式为HS-+4H2O-8e-=SO42-+9H+ C.b电极是电池的负极 D.该电池工作时,H+向左通过质子交换膜 13.关于化合物二苯基甲烷( ),下列说法正确的是 A.不能使稀酸性KMnO4溶液褪色 B.是苯的同系物 C.其一氯代物有4种 D.所有碳原子一定共平面 14.丙烷的分子结构可简写成键线型结构。有机物A的键线式结构为,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是 A.有机物A的一氯代物只有5种 B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 C.有机物A的分子式为C8H16 D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯 15.C8H8分子呈正六面体 结构(如图所示),因而称为“立方烷”,它的二氯代物共有( ) A.3种 B.6种 C.12 种 D.24 种 16.有人认为CH2 = CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2 = CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2 = CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是 A.BrCH2CH2Br B.BrCH2CH2Cl C.BrCH2CH2I D.ClCH2CH2Cl 第II卷(非选择题) 本题包括小四题(共52分) 17.建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题: (1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下: ①N2(g)+O2(g)=2NO(g) ∆H1=+180.5kJ/mol ②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ∆H2= -574kJ/mol ③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) ∆H3= -1160kJ/mol 则表示甲烷燃烧热的热化学反应方程式是 。 (2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示: ①甲容器中,平衡时NO2的转化率为____; ②T1___T2(填“>”或“<”);△H___0(填“>”或“<”),判定的依据是____; ③T2温度时,该反应的平衡常数K=____; ④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___v(逆)(填“>”“<”或“=”)。 18.钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示: 回答下列问题: (1) LiFePO4中Fe的化合价是_______________________。 (2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。 (3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。 (4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。 (5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。 (6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。 19.硫代硫较钠 (Na2S2O3)在生产生活中具有广泛应用。硫化碱法是工业上制取硫代硫酸钠的方法之一。实验室模拟工业生产装置如图所示: (1)利用如图装置进行实验,为保证硫酸顺利滴下的操作是_______。 (2)装置B中生成的Na2S2O3同时还生成CO2,反应的离子方程式为_______;在该装置中使用多孔球泡的目的是_____。 (3)装置C的作用是检验装置B中SO2的吸收效果,C中可选择的试剂是__(填字母)。 a.H2O2溶液 b.溴水 c.KMnO4溶液 d.BaCl2溶液 (4)Na2S2O3溶液常用于测定废水中Ba2+浓度。 ①取废水20.00mL,控制适当的酸度,加入足盐K2Cr2O7溶液,得到 BaCrO4 沉淀,过滤洗涤后用适量稀酸溶解,此时 CrO42-全部转化为Cr2O72-;再加过量 KI溶液,将Cr2O72- 充分反应;然后加入淀粉溶液作指示剂,用0.100 mol/L的Na2S2O3 溶液进行滴定:(I2 +2 S2O32-= S4O62-+ 2I-),滴定终点的现象为__________。平行滴定3次,消耗Na2S2O3 溶液的平均用量为18.00mL。则该废水中Ba2+ 的物质的量浓度为____mol/L, ②在滴定过程中,下列实验操作会造成实验结果偏高的是______(填字母)。 a.滴定管未用Na2S2O3溶液润洗 b.滴定终点时俯视读数 c.锥形瓶用蒸馏水洗涤后未进行干燥处理 d.滴定管尖嘴处滴定前无气泡,滴定终点发现有气泡 20.(15分)按要求回答下列问题: (1)中含有的官能团名称为 。 (2)的系统命名为___________ (3)的同类同分异构体有 种,其中分子中有两个甲基且苯环上一硝基代物有三种的有机物的结构简式为 (4)在下列有机物①(CH3)2CHCH3 ②CH3CH=CH2 ③CH3COOH ④ ⑤ ⑥ ⑦ ⑧ ⑨CH3CH2Cl, 其中属于饱和烃的是___________,互为同系物的是___________, ⑦的同分异构体中属于芳香化合物的有__________种。 写出③与⑦发生反应的化学方程式 , 反应类型为 题号 1 2 3 4 5 6 7 8 答案 C A C B C D B D 题号 9 10 11 12 13 14 15 16 答案 C C C B C C A D 高 17.(12分) (1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=−799kJ/mol (2分) (2) ① (2分) ② > (1分) < (1分) 温度升高,c(CO2)低,平衡逆向移动,正反应为放热反应(2分) ③16 (2分) ④ = (2分) 18(14分) (1)+2 (1分) (2) 增加钛铁矿与硫酸按触面积,增大酸溶速率 (2分) (3)2H++Fe==H2↑+Fe2+、Fe+2Fe3+==3Fe2+ (2分) 蒸发皿 (1分) (4) TiO2++2H2OTiO(OH)2+2H+ (2分) 促进水解( 或加快水解反应速率) (2分) (5) 1.0×10-5 (2分) (6) 20:9 (2分) 19.(12分) (1)打开分液漏斗上口的玻璃塞或者将活塞上凹槽对准漏斗颈上的小孔 (2分) (2) 4SO2+2S2-+CO32-=3S2O32-+CO2 (2分) 增大SO2与溶液的接触面积,使反应充分 (1分) (3) bc (2分) (4)① 滴入最后一滴Na2S2O3 溶液蓝色褪去且在半分钟内不恢复 (1分) 0.03mol/L (2分) ② a (2分) 20.(14分) (1)羟基、羧基 (2分) (2) 2,4,4-三甲基-2-己烯 (1分) (3) 7 (2分) (2分) (4) ①和④; (1分) ②和⑤ (1分) 4 (2分) (2分) 取代反应(1分) 化学答题纸 题号 1 2 3 4 5 6 7 8 答案 题号 9 10 11 12 13 14 15 16 第II卷(非选择题) 17.(1) 。 (2) ① ; ② ; , ; ③ ;④ 18. (1) ____________ 。 (2) _______________________________。 (3) 。 。 (4) ; (5) (6) 。 19.(1) 。 (2) ; (3) 。 (4) ① 。 , ② ______ 。 20. (1) 。 (2) (3) , (4) ___________, ___________, __________。 , 。 查看更多