- 2021-08-24 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高三化学下学期质量调查试题一 人教 新目标版
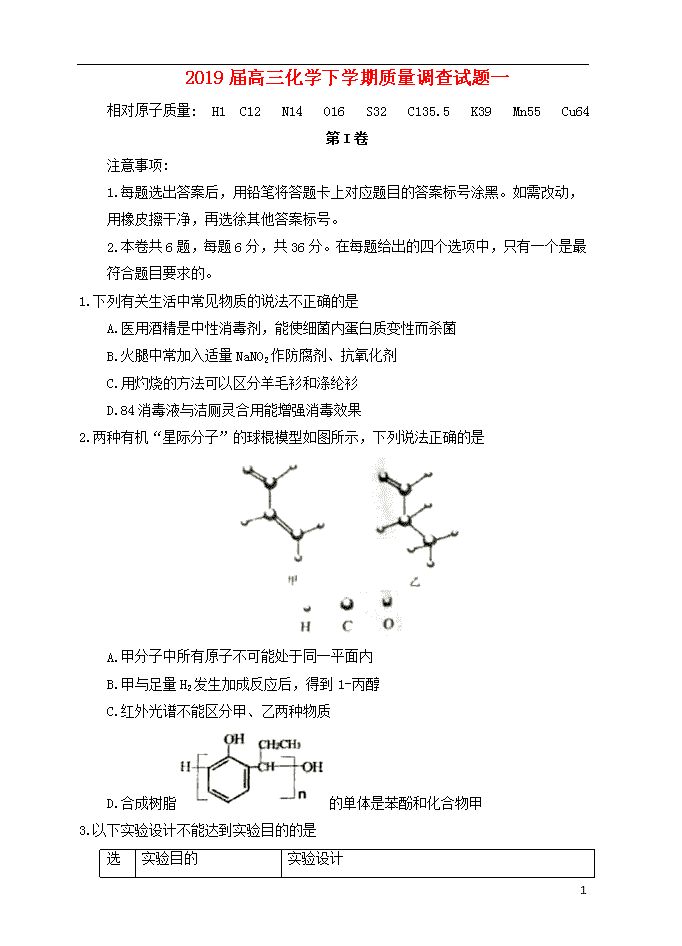
2019届高三化学下学期质量调查试题一 相对原子质量: H1 C12 N14 O16 S32 C135.5 K39 Mn55 Cu64 第I卷 注意事项: 1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净,再选徐其他答案标号。 2.本卷共6题,每题6分,共36分。在每题给出的四个选项中,只有一个是最符合题目要求的。 1.下列有关生活中常见物质的说法不正确的是 A.医用酒精是中性消毒剂,能使细菌内蛋白质变性而杀菌 B.火腿中常加入适量NaNO2作防腐剂、抗氧化剂 C.用灼烧的方法可以区分羊毛衫和涤纶衫 D.84消毒液与洁厕灵合用能增强消毒效果 2.两种有机“星际分子”的球棍模型如图所示,下列说法正确的是 A.甲分子中所有原子不可能处于同一平面内 B.甲与足量H2发生加成反应后,得到1-丙醇 C.红外光谱不能区分甲、乙两种物质 D.合成树脂的单体是苯酚和化合物甲 3.以下实验设计不能达到实验目的的是 实验目的 实验设计 10 选项 A 制备TiO2 向TiCl4中加入大量水,同时加热,过滤,经焙烧得TiO2 B 比较醋酸与硼酸的酸性强弱 分别向0.1mol/L醋酸和饱和硼酸溶液中加等浓度碳酸氢钠溶液,前者生成气体而后者不能 C 检验蔗糖的水解产物中是否含有葡萄糖 先加3~5滴稀硫酸,煮沸,冷却,再加几滴银氨溶液,水浴加热 D 除去氯化镁酸性溶液中的Fe3+ 在加热搅拌条件下加入MgCO3,过滤后,再向滤液中加入适量盐酸 4.原子序数依次增大的短周期主族元素a、b、c、d,其中a元素在周期表中位于第二周期第IVA族,一个ab2分子中含有22个质子,c为金属元素且c原子的核外电子数是a、d 原子核外电子数之和的一半。下列说法正确的是 A.a 的最高价氧化物对应的水化物是弱酸 B.四种原子中d 原子的半径最大 C.b 与c形成的化合物中一定不存在共价键 D.在周期表中,117 号元素(Uus)与d 同主族 5.工业上常用隔膜电解法将乙醛转化为乙醇和乙酸来处理高浓度乙醛废水。探究性学习小组用如图所示装置电解一定浓度的乙醛-Na2SO4溶液,模拟乙醛废水的处理过程。下列说法正确的是 A.a 为直流电源的负极 B.阳极的电极反应为:CH3CHO-2e-+H2O=CH3COOH+2H+ C.电解过程中,阴极区的pH逐渐减小 D.理论上阳极区处理废水的能力是阴极区的两倍 10 6.已知25℃时,几种常见弱电解质的电离平衡常数如下表所示: 电解质 H3PO4 NH3·H2O C6H5OH 电离平衡常数 K1=7.5×10-3 K2=7.5×10-8 K3=7.5×10-13 1.7×10-5 1.1×10-10 下列说法正确的是 A.NaH2PO4溶液呈碱性 B.25℃时,0.1moL/L氨水的pH=11+½lg1.7 C.足量C6H5OH与Na3PO4反应的离子方程式为:2C6H5OH+PO43-=H2PO4-+2C6H5O- D.25℃时,将等体积等浓度的苯丽游液与氨水混合,混合溶液中各离子浓度关系: c(C6H5O-)>c(NH4+)>c(OH-)>c(H+) 第II卷 注意事项: 1.用黑色基水的钢笔或签字笔将答案写在答题卡上。 2.本卷共4题,共64分。 7.(14分) KMnO4在生产、生活中用途广泛。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚中混合均匀,小火加热至熔融,可得到K2MnO4,再用镍片(不参与反应) 作阳极,铁片作阴极,电解K2MnO4溶液即可制备KMnO4。上述过程用流程图表示如下: 10 (1) 制备K2MnO4用铁坩埚不用瓷坩埚的原因是_______,电极室阳离子的迁移方向是_____(填“左侧向右侧迁移”或“右侧向左侧迁移”),阳极室电极反应式为_________,熔融池中的化学方程式为___________。 (2) 如下流程也可以制备KMnO4,调节pH用CO2不用HCl的原因是_________,当pH为10~11时,停止通入CO2,原因是_______。(己知:①20℃时,溶解度:K2CO3 111g;KHCO333.7g;KMnO46.3g ②温度高于120℃时KMnO4会发生分解反应) (3) 控制烘干温度不能过高的主要原因是_____________。 (4) 制得KMnO4的同时会有副产物MnO2生成。副产物MnO2与锂在锂高子有机高聚物中构成原电池。每消耗87gMnO2转移1mole-,则反应后Mn元素的化合价为_______。 8.(18分) 芳香族化合物E 是合成某种香料的中间体,以苯为原料合成E流程如下: 己知:CH3BrCH3MgBrCH3CH2CH2OH 10 (1) 写出反应①所需的试剂和条件_____________。 (2) 化合物A的名称是________,分子中不同化学环境的氢原子共有_____种,共面的碳原子数目最多有_______个。 (3) D中含氧官能团的名称是________。 (4) 写出反应⑨的化学方程式________,该反应的反应类型是________ 。 (5) 化合物C能与Na2CO3溶液反应生成CO2,符合a、b条件的C的同分异构体有多种,其中存在乙基(-CH2CH3),且苯环上的一氯取代物只有两种的同分异构体与足量NaOH溶液反应的化学方程式为___________。 a.属于芳香族化合物 b.能发生银镜反应,也能发生水解反应 (6) 在方框中写出以为主要原料,合成的流程。 9.(18分) 硫代硫酸钠(Na2S2O3)是重要的含硫化合物,常用作分析滴定剂。某化学兴趣小组进行了以下有关实验。 实验一: 硫代硫酸钠的制备 硫化破法是工业上制备Na2S2O3的方法之一,反应原理为: Na2S+Na2CO3+SO2→Na2S2O3+CO2(未配平) 利用如图所示装置可以制取硫代硫酸钠。回答下列问题: 10 (1) 仪器a的名称为_________。 (2) 装置C的作用有________、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是______________。 (3) 为提高Na2S2O3纯度,应使装置D中Na2S和Na2CO3恰好完全反应,则装置D 中 Na2S 和Na2CO3物质的量之比为___________。 (4) 制得Na2S2O3后,关闭K2和仪器a的活塞,打开K1。装置A 的作用是_______。 (5) 待D 中溶液冷却后,经过蒸发浓缩、冷却结晶可获得硫代硫酸钠晶体,所得晶体中可能含有Na2CO3、Na2S、Na2SO4等杂质。用实验证明产品中存在Na2SO4。完成下列表格: 实验 结论 取少量产品于试管中,加适量水溶解,加入足量_____,振荡、静置,取上层清液,滴加____溶液,产生白色沉淀。 产品中存在Na2SO4 实验二: 用硫代硫酸钠溶液测定KI 溶液浓度 ①取待测KI 溶液100mL,通入Cl2将I-氧化为IO3-,除去多余Cl2。 ②再向溶液中加入足量KI,将IO3-还原为I2。该过程中发生反应的离子方程式为_______。 ③用移液管取25.00mL步骤②后的溶液于锥形瓶中,加入几滴______溶液作指示剂,用0.01mol/L的硫代硫酸钠标准溶液滴定(2S2O32-+I2=S4O62-+2I-),至滴定终点共消耗标准液24.00mL,待测KI 溶液的物质的量浓度为______mol/L。 10 若实验中未用硫代硫酸钠标准液润洗滴定管,对测定结果造成的影响是__________。 10.(14 分) 用化学反应原理研究氮及其化合物意义重大。请回答下列问题: (1) 已知: N2(g)+3H2(g)2NH3(g) △H=-92.4 kJ/mol N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol 若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_______。 (2)T1温度时,在容积为2 L 的恒容密闭容器中发生反应: 2NO(g)+O2(g)2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示: ①下列说法能表明该反应已达到平衡状态的是______(填序号)。 A.混合气体的密度不变 B.混合气体的颜色不变 C. k正、k逆不变 D.2v正(O2)= v逆(NO2) ②化学平衡常数K与速率常数k正、k逆的数学关系是K=_______。 ③T1温度时,化学平衡常数K=______。将容器的温度改变为T2时,若k正=k逆 ,则T2___T1 (填“>”、“<”或“=”)。 (3) 亚硝酸是氨元素重要的含氧酸之一。25℃,测得amol/LHNO2稀溶液的pH=b,该温度下HNO2电离平衡常数的精确计算表达式为K=______(用含a、b的代数式表示)。将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合后,测得溶液pH=7,则溶液中=_____(用含a 的代数式表示)。 10 10 参考答案 1.D 2.B 3.C 4.A 5.B 6.B 7.(14分) (1)瓷坩埚含有二氧化硅, 能与碱反应 (2 分);左侧向右侧迁移(1 分); MnO42-―e-=MnO4- (2 分);2MnO2+4KOH+O22K2MnO4+2H2O (2 分) (2)Cl-具有还原性,可将 KMnO4 和 K2MnO4 还原 (2 分) 二氧化碳和碳酸钾反应生成碳酸氢钾, 碳酸氢钾溶解度不高, 会和高锰酸钾一起析出, 产品纯度降低 (2 分) (3)温度过高, KMnO4 会受热分解(2 分) (4) +3(1 分) 8.(18 分) (1) 液 Br2/Fe(或液 Br2/FeBr3) (1 分) (2) 2-苯乙醇(2 分) 6 (2 分) 8(2 分) (3) 羰基(2 分) (4)(2分);加成(或还原反应) (1 分) (5)(2分) (6) 10 (4分,每步1分。步骤合理即可) 9.(18 分) 实验一: (1) 分液漏斗 (1 分) (2) 安全瓶, 防止装置内压强过大(2 分) 减缓滴加浓硫酸的速度(2 分) (3) 2∶1(2 分) (4) 吸收装置 B 中的二氧化硫(2 分) (5) 稀盐酸(1 分) BaCl2 溶液(1 分, 答案合理即可) 实验二: ②5I-+IO3-+6H+=3I2+3H2O(2 分) ③淀粉(1 分) 1.6×10-3(2 分);所测浓度偏大(2 分) 10. (14 分) (1) 452.5 kJ (2 分) (2) ①B、 D (2 分)。;② k 正/k 逆 (2 分);③160 (2 分); > (2 分) (3)(2分);1 /(100a-1) (2 分) 10查看更多