- 2021-08-24 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习常考题型大通关13水溶液中的离子平衡含解析
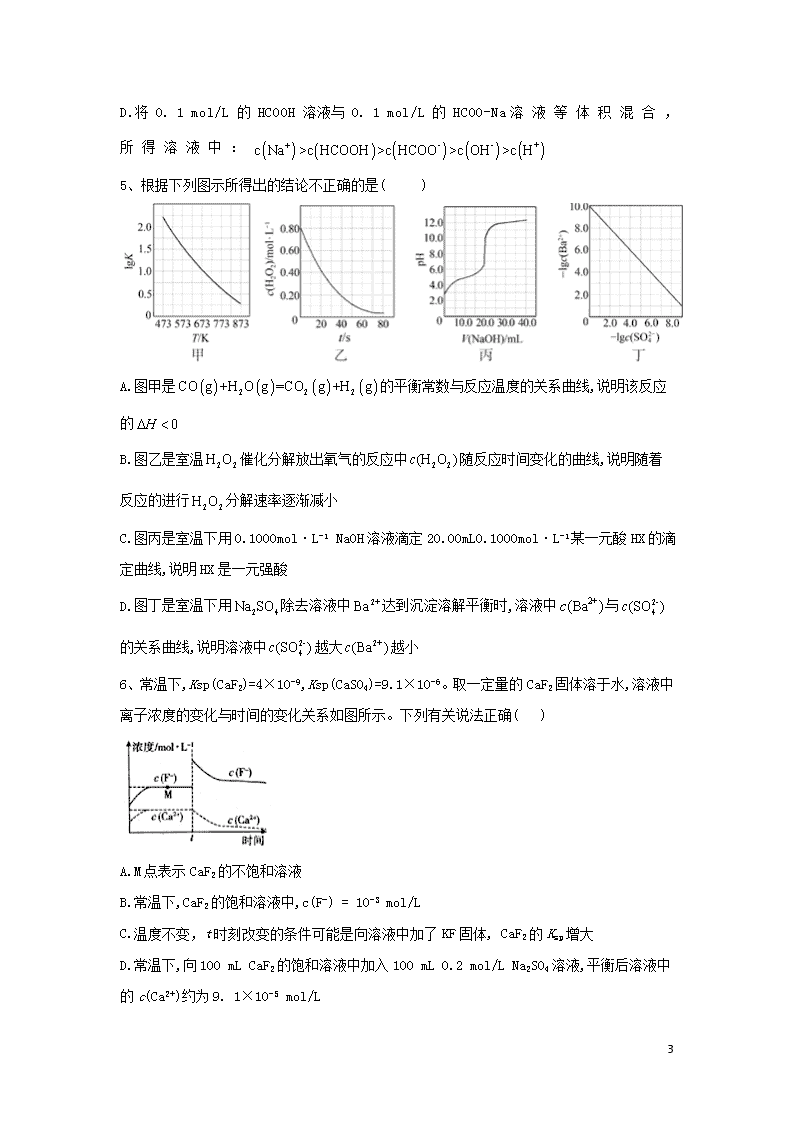
水溶液中的离子平衡 1、固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253K冰表面吸附和溶解过程的示意图,下列叙述错误的是( ) A.冰表面第一层中,HCl以分子形式存在 B.冰表面第二层中,浓度为(设冰的密度为) C.冰表面第三层中,冰的氢键网络结构保持不变 D.冰表面各层之间,均存在可逆反应 2、25 °C 时,,的,。室温下向10 mL0. 1中逐滴加入0. 1 HCl。图是溶液中含C微粒物质的量分数随pH降低而变化的图像(因有逸出未画出)。下列说法错误的是( ) A.A点溶液的pH<11 B.B 点溶液: C.A→B的过程中,离子反应方程式为: D.分步加入酚酞和甲基橙,用中和滴定法可测定,与,混合物组成 3、实验测得0.5mol·L−1CH3COONa溶液、0.5mol·L−1 CuSO4溶液以及H2 17 O的pH随温度变化的曲线如图所示。下列说法正确的是( ) A. 随温度升高,纯水中c(H+)>c(OH−) B. 随温度升高,CH3COONa溶液的c(OH−)减小 C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果 D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO−、Cu2+水解平衡移动方向不同 4、25 °C时,改变0. 1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数随之改变[已知],甲酸与丙酸溶液中与pH的关系如图所示。下列说法正确的是( ) A.图中M、N两点对应溶液中的比较:前者>后者 B.丙酸的电离常数K= C.等浓度的HCOONa和两种榕液的pH比较:前者 > 后者 17 D.将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na溶液等体积混合,所得溶液中: 5、根据下列图示所得出的结论不正确的是( ) A.图甲是的平衡常数与反应温度的关系曲线,说明该反应的 B.图乙是室温催化分解放出氧气的反应中随反应时间变化的曲线,说明随着反应的进行分解速率逐渐减小 C.图丙是室温下用0.1000mol·L-1 NaOH溶液滴定20.00mL0.1000mol·L-1某一元酸HX的滴定曲线,说明HX是一元强酸 D.图丁是室温下用除去溶液中达到沉淀溶解平衡时,溶液中与的关系曲线,说明溶液中越大越小 6、常温下,Ksp(CaF2)=4×10-9,Ksp (CaSO4)=9.1×10-6。取一定量的CaF2固体溶于水,溶液中离子浓度的变化与时间的变化关系如图所示。下列有关说法正确( ) A.M点表示CaF2的不饱和溶液 B.常温下,CaF2的饱和溶液中,c(F-) = 10-3 mol/L C.温度不变,t时刻改变的条件可能是向溶液中加了KF固体, CaF2的Ksp增大 D.常温下,向100 mL CaF2的饱和溶液中加入100 mL 0.2 mol/L Na2SO4溶液,平衡后溶液中的c(Ca2+)约为9. 1×10-5 mol/L 17 7、常温下将NaOH溶液滴加到己二酸()溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( ) A.的数量级为 B.曲线N表示pH与的变化关系 C.NaHX溶液中 D.当混合溶液呈中性时, 8、常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lg c(OH-)]。下列说法正确的是( ) A.曲线N表示1g与pOH的变化关系 B.常温下,Ka2(H2XO3)=10-10 17 C.当pOH=2时;NaHXO3溶液中:=10-8 D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c()+2c() 9、常温下,向20 mL 0. 1 mol •L-1 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( ) A.常温下,0.1 mol • L-1氨水中NH3 • H2O的电离常数K约为1×10-5 B.a、b 之间的点一定满足:c()>c(Cl- )>c(OH- )>c(H+ ) C.c 点溶液中c()=c(Cl- ) D.d点代表两溶液恰好完全反应 10、根据下列各图曲线表征的信息。得出的结论正确的是( ) A.图1表示常温下向体积为10 mL 0.1 mol•L-1 NaOH溶液中逐滴加入0.1 mol•L-1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)c(OH-) B.图2表示用水稀释pH相同的盐酸和NH4Cl溶液时,溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH4Cl溶液,且溶液导电性:b>c>a C.图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+ D.由图4得出若除去Fe2(SO4)3溶液中的Cu2+,可采用向溶液中加入适量Fe2O3,调节溶液的pH至4左右 11、下列说法正确的是( ) A.ph=1的溶液: 17 B.室温下,Ph=3的溶液与pH=11的NaOH溶液等体积混合后,因生成的水解,所以由水电离出的 C.已知常温下,则等体积等浓度的NaCN和溶液中,溶液所含的离子数比NaCN溶液多 D.室温下,pH=11和pH=13的NaOH溶液等体积混合后,则混合后的溶液中 12、已知是一种三元中强酸。25 °C时,向某浓度溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数随溶液pH的变化曲 线如右图所示。下列说法正确的是( ) A.曲线2和曲线4分别表示和s变化 B.25 ℃时, 的电离常数 C.pH = 7. 2 时,浴液屮由水电离出的mol/L D.PH = 12. 3 时, 13、常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示。下列说法不正确的是( ) 17 A.曲线表示与pH的变化关系 B. C.a点时两溶液中水的电离程度相同 D.0.01 MA溶液中存在: 14、pH相等的NaOH溶液与溶液,分别加热到相同的温度后 溶液的pH NaOH溶液的pH(填“>”“=”或“<”)。 (2)将物质的量浓度相同的盐酸与氨水混合后,溶液中的,则盐酸的体积 氨水的体积(填“>”“=”或“<”)。 (3)将溶液与 NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中,则: ①混合溶液中, (填“>”<”或“=”,下同)。 ②混合溶液中, (4)常温时,取溶液与 NaOH溶液等体积混合,测得混合溶液的pH=8 ①混合溶液中由水电离出的与 NaOH溶液中由水电离出的之比为 ②已知溶液呈中性,又知将HX溶液加入溶液中有气体放出,试推断溶液的Ph 7(填“>”“<”或“=”)。 15、砷是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。 17 1.将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂,吸附剂中含有,其中原因是________ . 2. 和水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与的关系分别如图-1和图-2所示。 ①以酚酞为指示剂(变色范围8.0~10.0),将溶液逐滴加入到溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______. ②第一步电离方程式的电离常数为,则_______. 3.溶液的对吸附剂表面所带电荷有影响. 时,吸附剂表面不带电荷; 时带负电荷, 越高,表面所带负电荷越多; 时带正电荷, 越低,表面所带正电荷越多. 不同时吸附剂对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂吸附砷的质量)如图-3所示. ①在7~9之间,吸附剂对五价砷的平衡吸附量随升高而迅速下降,其原因是_____. ②在4~7之间,吸附剂对水中三价砷的去除能力远比五价砷的弱,这是因为_____。提高吸附剂对三价砷去除效果可采取的措施是_____. 17 答案以及解析 1答案及解析: 答案:D 解析:A对,由图示可知,第一层中,HCl以分子形式存在。B对,第二层中,已知, ,和的物质的量是相同的,设的物质的量为1mol,则,,故。C对,第三层中,只有分子存在,所以冰的氢键网络结构保持不变。D错,由A项、C项分析可知,第一层和第三层中的物质均以分子形式存在,故均不存在可逆反应。 2答案及解析: 答案:B 解析:A.A 点,所以,所以,查看更多