- 2021-08-24 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习课时提升作业三十五物质的定量分析含解析苏教版
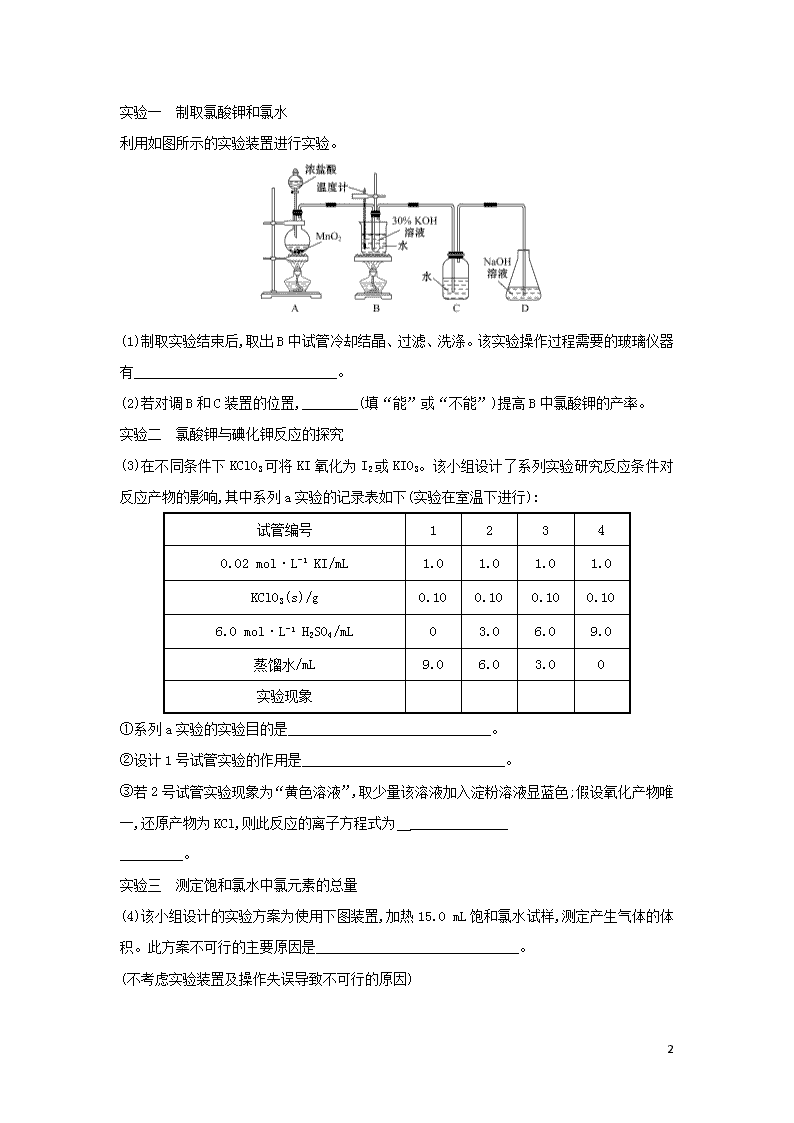
物质的定量分析 1.下列技术手段或仪器在化学研究中的应用的说法中不正确的是 ( ) A.用电子天平可直接称出某个分子或原子的质量 B.用pH计测定溶液的pH C.用移液管量取25.00 mL溶液 D.用25.00 mL碱式滴定管量取14.80 mL NaOH溶液 【解析】选A。单个分子或原子的质量极小,难以用电子天平直接称出。 2.用基准物质标定氢氧化钠标准溶液浓度时,不正确的是 ( ) A.测定食醋中醋酸的浓度时,需要用浓度约为0.100 0 mol/L NaOH标准溶液,可以直接取NaOH固体配制0.100 0 mol/L NaOH溶液进行滴定 B.标定碱液的基准物质很多,如草酸、苯甲酸、邻苯二甲酸氢钾等,其中最常用的是邻苯二甲酸氢钾 C.在酸碱滴定中,每次指示剂的用量很少,仅用1~2滴或2~3滴,不可多用 D.若邻苯二甲酸氢钾加水后加热溶解,不等其冷却就进行滴定,对标定结果有影响 【解析】选A。由于NaOH固体易吸收空气中的CO2和水分,不能直接配制碱标准溶液,而必须用标定法,A项错误。作为定量分析用的基准物质应具有摩尔质量较大的特性,邻苯二甲酸氢钾的摩尔质量大,且不易吸收水分,是标定碱的一种良好的基准物质,B项正确。指示剂本身呈弱酸性或碱性,若使用较多指示剂势必对实验结果造成影响,C项正确。终点是根据酚酞的变色来判定的,酚酞的变色范围是pH=8.2~10,因此,如果在热的溶液中滴定影响酚酞指示剂的变色范围,D项正确。 3.用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是 ( ) A.滴定前酸式滴定管需用盐酸标准液润洗 B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 C.往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 D.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液 【解析】选D。锥形瓶不能用待测液润洗,否则会使测定结果偏高。 4.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。 10 实验一 制取氯酸钾和氯水 利用如图所示的实验装置进行实验。 (1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有_____________________________。 (2)若对调B和C装置的位置,________(填“能”或“不能”)提高B中氯酸钾的产率。 实验二 氯酸钾与碘化钾反应的探究 (3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行): 试管编号 1 2 3 4 0.02 mol·L-1 KI/mL 1.0 1.0 1.0 1.0 KClO3(s)/g 0.10 0.10 0.10 0.10 6.0 mol·L-1 H2SO4/mL 0 3.0 6.0 9.0 蒸馏水/mL 9.0 6.0 3.0 0 实验现象 ①系列a实验的实验目的是_____________________________。 ②设计1号试管实验的作用是_____________________________。 ③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为 ______________ _________。 实验三 测定饱和氯水中氯元素的总量 (4)该小组设计的实验方案为使用下图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是_____________________________。 (不考虑实验装置及操作失误导致不可行的原因) 10 (5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节): ___________________________ __。 资料:ⅰ.次氯酸会破坏酸碱指示剂; ⅱ.次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。 【解析】(1)制取实验结束后,由取出B中试管进行的操作(冷却结晶、过滤、洗涤)可知,该实验操作过程中需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管;(2)Cl2与热的KOH溶液反应生成KClO3、KCl和H2O,与冷的KOH溶液反应生成KClO、KCl和H2O。因此,若将装置B、C的位置对调,可以除去Cl2中的杂质气体HCl,故能提高B中KClO3的产率。(3)①根据表格中的数据可知:KI、KClO3的物质的量及浓度不变,改变的是硫酸溶液的体积和水的多少,二者的总体积相等,由此可见系列a实验的目的是研究反应体系中硫酸浓度对反应产物的影响;②设计1号试管实验的作用是作对照实验,比较影响结果。③根据2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色,证明生成了I2;若氧化产物唯一,还原产物为KCl,根据氧化还原反应中电子守恒、电荷守恒及元素原子守恒可知该反应的离子方程式为Cl+6I-+6H+Cl-+3I2+3H2O。(4)该小组设计的实验方案不可行的主要原因是溶液中存在Cl2的重新溶解以及HClO分解生成HCl和O2等,无法测定试样含氯总量。(5)由于HClO具有强氧化性会破坏酸碱指示剂,因此实验设计时不能用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的H2O2溶液,H2O2把氯元素完全还原为Cl-,H2O2被氧化成O2,然后加热除去过量的H2O2,冷却,再加入足量的AgNO3溶液,过滤、洗涤生成的AgCl沉淀,干燥后称量沉淀质量,结合氯原子守恒即可确定其中含有的氯元素的质量。 答案:(1)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可) (2)能 (3)①研究反应体系中硫酸浓度对反应产物的影响 ②硫酸浓度为0的对照实验 ③Cl+6I-+6H+Cl-+3I2+3H2O 10 (4)因存在Cl2的重新溶解,HClO分解等,此方案无法测定试样含氯总量(或其他合理答案) (5)量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量(或其他合理答案) 5.K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)是制备负载型活性铁催化剂的主要原料。它是翠绿色晶体,溶于水,难溶于乙醇,110 ℃下失去结晶水,230 ℃分解,可以铁屑为原料制备,相关反应的化学方程式为 Fe(s)+H2SO4FeSO4+H2↑ FeSO4+H2C2O4+2H2O FeC2O4·2H2O↓+H2SO4 2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O42K3[Fe(C2O4)3]+6H2O 制备流程如下: (1)步骤①加入稀硫酸要过量,其目的是 _____________________________。 (2)步骤③操作为在沉淀中加入饱和K2C2O4溶液,并用40 ℃左右水浴加热,再向其中慢慢滴加足量的30% H2O2溶液,此过程中水温需保持40 ℃左右,可能的原因是_____________________________。 (3)步骤④煮沸的目的是_____________________________。 (4)步骤⑤操作包括_______________、过滤、洗涤、干燥。 (5)步骤⑤操作中所用洗涤剂最合适的是 ____ (填选项字母)。 A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl溶液 (6)为测定产品的纯度,用酸性KMnO4标准溶液进行滴定,反应如下:2Mn+ 5C2+16H+2Mn2++10CO2↑+8H2O 称取5.00 g产品溶于水,配制成100 mL溶液,取出20 mL于锥形瓶中,用 10 0.100 0 mol·L-1酸性KMnO4标准溶液滴定,滴定终点时,消耗KMnO4标准溶液 24.00 mL。 ①滴定过程中发现,开始滴入一滴KMnO4标准溶液,紫红色褪去很慢,滴入一定量后紫红色很快褪去,其原因是 _______________。 ②计算得产品中K3[Fe(C2O4)3]·3H2O(M=491.0 g·mol-1)的百分含量为______ __________(假设产品中的杂质不与KMnO4反应)。 ③下列操作会引起滴定结果偏高的是_______。 A.滴定管用蒸馏水洗涤后,立即装入标准溶液 B.滴定前尖嘴部分无气泡,滴定后有气泡 C.摇动锥形瓶过程中有液体溅出 D.接近终点时,用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴 【解析】以铁屑为原料制备三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O的流程:铁和硫酸反应:Fe+H2SO4FeSO4+H2↑,硫酸亚铁和草酸反应:FeSO4+H2C2O4+2H2O FeC2O4·2H2O↓+H2SO4,加入草酸钾、双氧水生成K3[Fe(C2O4)3]·3H2O。 (1)添加过量稀硫酸,可使铁粉完全溶解,同时还能抑制溶液中Fe2+的水解。 (2)温度保持40℃左右,可防止温度过高过氧化氢分解,温度太低影响反应速率。 (3)为防止过量过氧化氢对产品纯度的影响,需要借助煮沸除去。 (4)通过将浓缩后的溶液冷却结晶、过滤、洗涤、干燥后得到产品。 (5)为减小三草酸合铁酸钾晶体的溶解,提高产品的量,步骤⑤可选择乙醇作洗涤剂。 (6)①滴定过程中发现,随着滴入KMnO4标准溶液,反应速率逐渐加快,可能原因是反应中生成的Mn2+起催化作用,加快反应速率; ②设产品中K3[Fe(C2O4)3]·3H2O的物质的量为x 5K3[Fe(C2O4)3]·3H2O~15C2~6Mn 5 6 x 24.00×10-3× 0.100 0(mol) = x=2×10-3 mol 10 K3[Fe(C2O4)3]·3H2O的质量为2×10-3×491.0=0.982 (g) K3[Fe(C2O4)3]·3H2O的质量分数×100%=98.2%, ③由c(待测)=可知,酸式滴定管要用标准液润洗,滴定管用蒸馏水洗涤后,立即装入标准液,标准液浓度减小,消耗标准液体积增大,测定结果偏高,故A符合;滴定前滴定管尖嘴处无气泡,滴定后有气泡,读取标准溶液体积减小,测定结果偏低,故B不符合;摇动锥形瓶过程中有液体溅出,说明消耗标准液减少,测定结果偏低,故C不符合;接近终点时,用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴,导致消耗标准液增多,测定结果偏高,故D符合。 答案:(1)使铁屑充分利用,同时制得的FeSO4溶液呈酸性,防止Fe2+的水解 (2)温度太高双氧水容易分解,温度太低反应速率太慢(答案合理即可) (3)除去过量的双氧水 (4)冷却结晶 (5)C (6)①生成的Mn2+起催化作用 ②98.2% ③A、D 1.中和滴定是一种操作简单、准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点。下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是 ( ) A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:KMnO4——浅红色 B.利用“Ag++SCN-AgSCN↓”原理,可用标准KSCN溶液测量AgNO3溶液浓度:Fe(NO3)3——红色 C.利用“2Fe3++2I-I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量:淀粉——蓝色 D.利用OH-+H+H2O来测量某盐酸的浓度时:酚酞——浅红色 【解析】选C。滴定反应一旦开始就有I2生成,溶液就呈现蓝色,故无法判断终点。 2.某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案: 10 方案Ⅰ:铜铝混合物测定生成气体的体积 方案Ⅱ:铜铝混合物测定剩余固体的质量 下列有关判断中不正确的是 ( ) A.溶液A和B均可以是盐酸或NaOH溶液 B.溶液A和B均可以选用稀硝酸 C.若溶液B选用浓硝酸,则测得铜的质量分数偏小 D.实验室中方案Ⅱ更便于实施 【解析】选B。因铝具有两性,而铜不能与碱、无氧化性酸反应,所以A和B是盐酸或氢氧化钠时,都与铝反应,故A项正确;又因测固体质量比测气体体积易进行,故D正确;若A和B都是稀硝酸时则方案Ⅰ、Ⅱ均无法实施,故B错;若B是浓硝酸时则铝钝化,导致剩余固体质量增加,所以测得铜的质量分数偏小,故C正确。 3.实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4 石蕊: 5.0~8.0 酚酞:8.2~10.0 用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是 ( ) A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂 【解析】选D。NaOH溶液和CH3COOH溶液恰好完全反应时生成CH3COONa,由于CH3COO-水解显碱性,而酚酞的变色范围为8.2~10.0,比较接近。因此答案为D。 4.某实验小组利用反应2CuO+2Cl22CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。 10 方案一:通过测定反应物CuO的质量m(CuO)和产物O2的体积V(O2)来测定铜的近似相对原子质量。 (1)按气流方向从左到右用胶管(图中未画出)将选择的仪器组合成一套实验装置,连接顺序为a→( )( )→( )( )→( )( )→( )( )→b。 (2)装置B是由干燥管和碱式滴定管改造而成的测量气体体积的装置,实验前滴定管液面初读数为V1 L,实验后恢复至室温,调节装置两侧液面相平后得到终读数为V2 L,设室温时气体摩尔体积为Vm L·mol-1,且E装置中CuO的质量为m1 g,充分反应后生成CuCl2的质量为m2 g,则铜的近似相对原子质量的表达式为 _____ [用含m1、V1、V2的代数式表示]。 (3)若氧化铜中混有铜,则测定结果________(填“偏大”“偏小”或“无影响”)。 (4)装置E在实验过程中的主要现象是 _____________________________。 方案二:利用A、D、E、F四套装置(尾气由其他的装置处理)完成测定任务。 (5)你认为需要测定的物理量有 __________________(写出一组),按你测定的物理量,写出铜的近似相对原子质量的表达式:_ ___________________。 【解析】方案一:通过测定反应物CuO的质量m(CuO)和产物O2的体积V(O2)来测定铜的近似相对原子质量;方案二:通过测定反应物CuO的质量和产物CuCl2的质量来测定铜的近似相对原子质量。实验前要设计得到纯净的Cl2,装置 A:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,得到的Cl2中含有HCl和水蒸气,用装置D来除去HCl,用装置F干燥Cl2。在装置E中发生反应2CuO+2Cl22CuCl2+O2。当用方案一时,先用装置C(碱石灰)除去多余的氯气,再用装置B测量V(O2),因此方案一仪器连接顺序为a→ef→ij→gh→cd→b。 2CuO ~ O2 2M(Cu)+32 Vm m1 V1-V2 10 =,M(Cu)=-16。 CuO ~ CuCl2 M(Cu)+16 M(Cu)+71 m1 m2 =,M(Cu)=。 答案:(1)e f i j g h c d (2)-16 (3)偏大 (4)固体由黑色变成棕黄色 (5)E装置中CuO的质量m1 g,充分反应后生成CuCl2质量m2 g 5.我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量。通常把1升水中含有10 mg CaO称为1度。某化学实验小组对本地区地下水的硬度进行检测,实验过程如下: 实验中涉及的部分反应: M2+(金属离子)+ M2+(金属离子)+Y4-(EDTA)MY2- MEBT+Y4-(EDTA)MY2-+EBT(铬黑T) (1)取地下水样品25.0毫升进行预处理。已知水中由Ca2+、Mg2+和HC所引起的硬度称为暂时硬度,可通过加热减小硬度,写出加热时所发生反应的化学方程式 _____________________________(任写一个)。 预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是_________。 (2)将处理后的水样转移到250 mL的锥形瓶中,加入氨水-氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 0 mol·L-1的EDTA标准溶液进行滴定,滴定时眼睛应________, 10 滴定终点时的实验现象是__ ___________。 (3)滴定终点时共消耗EDTA溶液15.0 mL,则该地下水的硬度=________。 (4)若实验时装有EDTA标准液的滴定管只用蒸馏水润洗而未用标准液润洗,则测定结果将________(填“偏大”“偏小”或“无影响”)。 【解析】(3)25.0 mL地下水样品中含Ca2+、Mg2+的总量为n(M2+)=0.010 0 mol· L-1×15.0×10-3 L=1.5×10-4 mol,地下水的硬度=1.5×10-4 mol×× 56 g·mol-1×=33.6度。 (4)若实验时装有EDTA标准液的滴定管只用蒸馏水润洗而未用标准液润洗,则导致滴定终点时消耗EDTA标准液增多,最终使所测水的硬度偏大。 答案:(1)Ca(HCO3)2CaCO3↓+CO2↑+H2O [或Mg(HCO3)2MgCO3↓+CO2↑+H2O] 除去溶解的CO2 (2)注视锥形瓶中溶液颜色的变化 溶液由酒红色变为蓝色且半分钟不褪色 (3)33.6度 (4)偏大 10查看更多