四川省成都市蓉城名校联盟2021届高三第一次联考试题 化学 Word版含答案
www.ks5u.com
蓉城名校联盟2018级高三第一次联考
理科综合能力测试 化学
注意事项:
1.答题前,考生务必在答题卡,上将自己的学校、姓名、班级、准考证号用0.5毫米黑色签字笔填写清楚,考生考试条形码由监考老师粘贴在答题卡上的“条形码粘贴处”。
2.选择题使用2B铅笔填涂在答题卡上对应题目标号的位置上,如需改动,用橡皮擦擦干净后再填涂其它答案;非选择题用0.5毫米黑色签字笔在答题卡的对应区域内作答,超出答题区域答题的答案无效;在草稿纸上、试卷上答题无效。
3.考试结束后由监考老师将答题卡收回。
可能用到的相对原子量:H1 C12 N14 O16 P31 S32 Ni59
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与人类生活、生产和社会可持续发展密切相关,下列有关说法错误的是
A.N95口罩的主要材质是聚丙烯,工业上利用丙烯加聚合成
B.中国华为自主研发的5G芯片巴龙5000的主要材料是Si
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.硒是人体必需的微量元素,但不宜摄入过多
8.阿司匹林是家中常备药,它对血小板的聚集有抑制作用,早在1853年夏尔·弗雷德里克·热拉尔(Gerhardt)就用水杨酸与乙酸酐合成了乙酰水杨酸(阿司匹林),原理如下:
下列说法正确的是
A.该合成原理发生的是取代反应
B.水杨酸的所有原子一定共平面
C.乙酰水杨酸分子中含有三种官能团
D.从乙酰水杨酸和乙酸的混合液中分离出乙酰水杨酸可以通过加入饱和Na2CO3溶液后分液
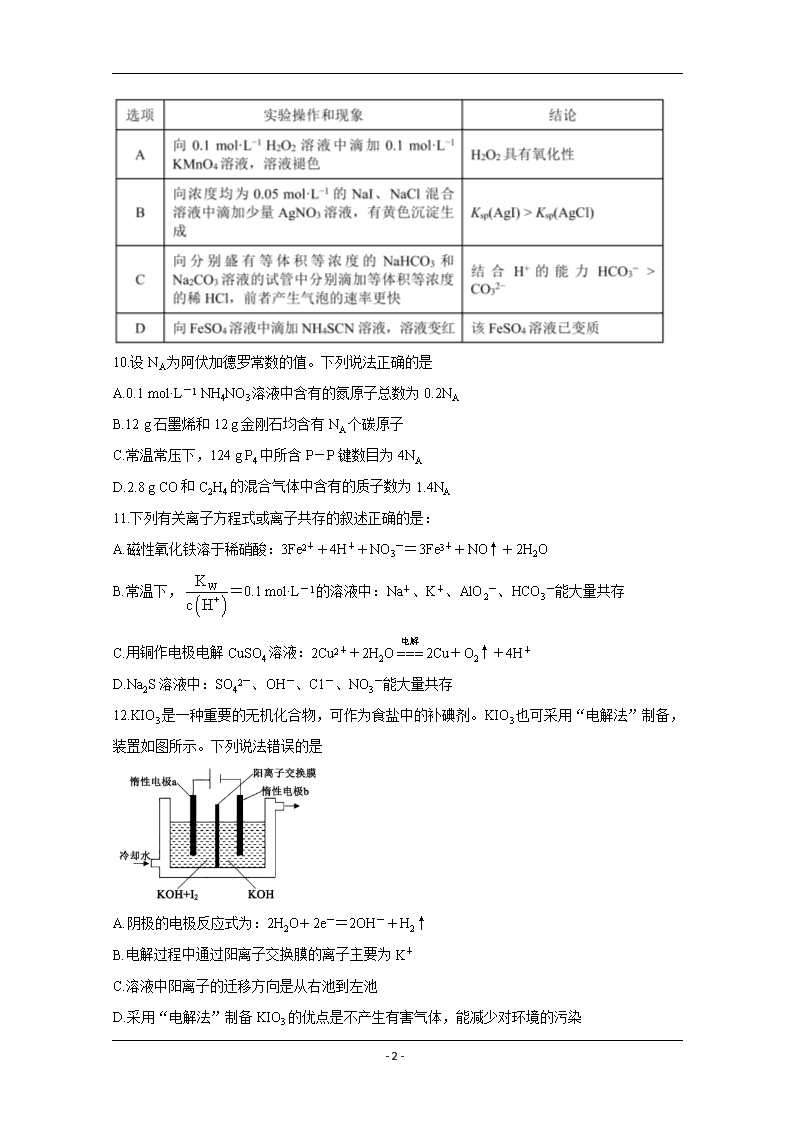
9.根据下列实验操作和现象得出的结论正确的是
- 10 -
10.设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol·L-1 NH4NO3溶液中含有的氮原子总数为0.2NA
B.12 g石墨烯和12 g金刚石均含有NA个碳原子
C.常温常压下,124 g P4中所含P-P键数目为4NA
D.2.8 g CO和C2H4的混合气体中含有的质子数为1.4NA
11.下列有关离子方程式或离子共存的叙述正确的是:
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B.常温下,=0.1 mol·L-1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
D.Na2S溶液中:SO42-、OH-、C1-、NO3-能大量共存
12.KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。KIO3也可采用“电解法”制备,装置如图所示。下列说法错误的是
A.阴极的电极反应式为:2H2O+2e-=2OH-+H2↑
B.电解过程中通过阳离子交换膜的离子主要为K+
C.溶液中阳离子的迁移方向是从右池到左池
D.采用“电解法”制备KIO3的优点是不产生有害气体,能减少对环境的污染
- 10 -
13.A、B、C、D、E五种短周期元素,原子序数依次增大。A原子核外的最外层电子数是次外层的两倍,C原子核外的最外层中只有两对成对电子,D在元素周期表的各元素中非金属性最强,E和C同主族。下列说法错误的是
A.原子半径:D
a2 ②a1b2 ④b1t2 ⑥t1=t2 ⑦t10,△S<0)来消除CO的污染。请你判断该方法是否可行 (填“可行”或“不可行”),并说出理由 。
27.(14分)
某化学兴趣小组同学选用下图所示装置进行铜与浓硫酸反应的实验,并对其产物的部分性质进行探究。
查阅相关资料知:
a.酒精灯火焰温度通常在500℃左右,外焰温度最高可达800℃;
b.98.3%的浓硫酸密度为1.84 g·cm-3,沸点为338℃,沸腾时分解生成SO3和H2O。
该小组同学按①⑤③②的顺序连接好装置后,进行下列操作:
i. ;
ii.加入药品;
ii.打开分液漏斗旋塞向圆底烧瓶中加入过量浓硫酸;
iv.点燃酒精灯。
随着反应的进行,该小组同学观察到:装置①中铜片表面有气泡产生,铜片不断溶解,烧瓶底部出现灰色固体物质;装置⑤中有白色沉淀生成;装置③中溶液的紫色逐渐褪色;当铜片完全溶解后,继续加热几分钟,灰色固体变白,同时有气泡产生;实验完成后,将反应得到的固体投入盛有适量蒸馏水的烧杯中,得到蓝色澄清溶液。
针对上述观察到的现象,甲、乙、丙、丁四位同学提出自己的观点进行讨论:
(1)操作i为 。
(2)装置③中溶液褪色,体现了SO2的 性。
(3)甲同学认为:烧瓶底部出现的灰色固体物质中主要成分是CuSO4。
请写出装置①中生成CuSO4的化学反应方程式 ;
- 10 -
甲同学为了证明自己的观点正确,设计了下列实验操作,其中可行的是 (填正确答案标号)。
A.取下反应后的圆底烧瓶,向其中加入适量蒸馏水,边加边振荡
B.将反应后的圆底烧瓶中,上层溶液倒入烧杯中,加入适量水蒸馏,边加边用玻璃棒搅拌
C.将反应后的圆底烧瓶中上层溶液缓缓倒入装有蒸馏水的烧杯中,边加边用玻璃棒搅拌.
D.将上层溶液全部倒入烧杯中,向剩余的固体中加入适量蒸馏水,边加边振荡
(4)乙同学认为烧瓶底部的“灰色固体物质”中可能含有CuS,因为CuS为黑色固体,与白色CuSO4混合呈灰色。如果有CuS生成,则实验中生成CuS的化学方程式为 ;实验中“继续加热几分钟,灰色固体变白,同时有气泡产生”说明黑色的CuS与浓硫酸发生了反应,根据实验现象写出CuS与浓硫酸反应的化学方程式 。
(5)丙同学认为装置⑤中“有白色沉淀生成”说明SO2能与BaCl2溶液反应。
你认为丙同学的观点 (填“正确”或“不正确”),装置⑤中有白色沉淀生成的原因可能是 (任写两种)。
28.(14分)
化工催化剂中往往含有大量有用成分,其回收利用具有重要意义。以某种废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍和重铬酸钾晶体的工业流程如下图:
已知:
①NiS、Ni(OH)2、Cr(OH)3均难溶于水;
②Cr(OH)3是两性氢氧化物,碱性溶液中以Cr(OH)4-形式存在,酸性溶液中以Cr3+形式存在;
③Ni(OH)2能溶于氨水生成[Ni(NH3)6]2+。
根据上述信息回答下列问题:
(1)滤渣I和滤渣II的主要成分分别为 、 。
(2)“碱析”中Cr元素转化的离子反应方程式为 。
- 10 -
(3)“氧化I”的离子方程式为 。
(4)进行“氧化II”时,所加KMnO4溶液须过量,原因是 。
(5)“系列操作b”包括 、 、过滤、洗涤、干燥。为了减少K2Cr2O7晶体的损耗,最好选用下列物质中的 作洗涤剂。
A.酒精 B.饱和氯化钠溶液 C.20℃蒸馏水 D.40℃蒸馏水
(6)用1吨该废镍催化剂(NiCO3含量为75%)为原料通过以上方法制取NiSO4·7H2O晶体,制取过程中Ni的损失率为4.8%,可以制得NiSO4·7H2O晶体的质量为 kg。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一道题计分。
35.[化学——选修3:物质结构与性质](15分)
据古文献《事物绀珠》记载:“宣窑之青,乃苏勃泥青”,说明元宣德时期青花瓷使用的颜料是“苏勃泥青”,它是从一种进口钴毒矿(主要成分:(FeCo)xAsS)中提取出来的。
(1)Co的外围电子排布式为 ,r(Co3+) r(Co2+)(填“大于”“小于”或“等于”)。
(2)[Co(NH3)6]3+是一种土黄色的配离子,其中心离子的配位数是 ,每个[Co(NH3)6]3+所含共价键的数目是 ;形成该配离子的NH3的中心原子的杂化轨道是由 轨道(填轨道的名称和数目,下同)和 轨道杂化而成的。
(3)硝酸钴晶体[Co(NO3)2·6H2O]是一种红色棱形晶体,形成该晶体的化学键除σ键外还有 。
(4)已知:三元弱酸砷酸(H3AsO4)是一种无色透明斜方晶系细小板状结晶,具有潮解性,剧毒。砷酸属于 晶体(填“分子”“原子”或“离子”);砷酸分子中As原子的杂化方式为 杂化;砷酸根离子的空间构型为 。
36.[化学——选修5:有机化学基础](15分)
有机物P是一种重要的功能高分子,其合成方式有多种,以下是P的一种合成路线:
已知:试剂a是浓硝酸和浓硫酸形成的混酸;G能使溴水因反应而褪色。
- 10 -
(1)分子A最多有 个原子共面。反应①的化学方程式为 。
(2)试剂b是 ;H的分子式是 。
(3)E中含有的官能团名称为 。
(4)反应④、⑤的反应类型分别是 、 。反应⑥的化学方程式为 。
(5)任写三种符合下列条件的F的同分异构体的结构简式 。
①能与碳酸钠溶液反应 ②不能使酸性高锰酸钾溶液褪色
- 10 -
- 10 -
- 10 -