2017-2018学年四川省宜宾市高二下学期第一次月考化学试题(Word版)
四川省宜宾市2017-2018学年高二化学下学期第一次月考试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共8页。考试时间:90分钟,满分100分。
注意事项:
(1)答题前,考生务必将自己的姓名、考号、班级涂写在答题卡上;
(2)第Ⅱ卷必须使用0.5毫米黑色签字笔在答题卡上题目所指示的答题区域内作答;
(3)所有答案一律填涂或写在答题卡上,考试结束,只收答题卡,不收试题卷。
部分元素相对原子质量:H—1,C—12,N—14,O—16,Cu—64。
第I卷 (选择题 共45分)
一、选择题(本大题共20小题,1——15题每小题2分,16——20题每小题3分,共计45分。在每小题列出的四个选项中,只有一项符合题意。)
1.下列有关电化学原理的说法错误的是( )
A.可将河道中的钢铁闸门与外加直流电源的负极相连以保护其不受腐蚀
B.在钢铁表面镀锌属于牺牲阳极的阴极保护法
C.金属的导电是物理变化,电解质溶液的导电是化学变化
D.电镀过程相当于金属的“迁移”,可视为物理变化
2.下列说法正确的是( )
A.异丁烷的结构简式: CH3CH2CH2CH3 B.乙烯的官能团是:
C.二氧化碳的比例模型: D.过氧化钠的分子式: Na2O2
3.下列说法中错误的是( )
①分子组成相差一个或几个CH2原子团的有机物是同系物;②符合通式CnH2n+2的烃,它们必定互为同系物;③相对分子质量相同,结构不同的纯净物互称为同分异构体;④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似。
A. ①②③ B. ②③ C. ③④ D. ①②③④
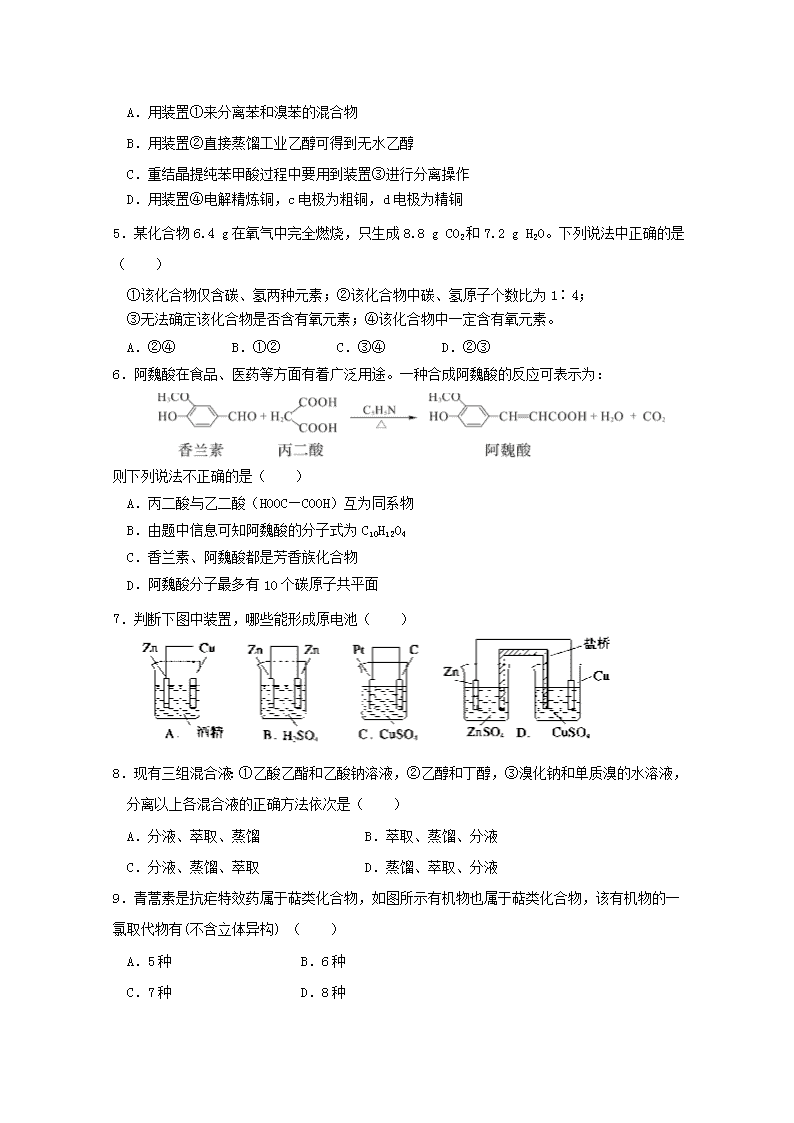
4.下列有关分离提纯的实验操作的叙述正确的是( )
A.用装置①来分离苯和溴苯的混合物
B.用装置②直接蒸馏工业乙醇可得到无水乙醇
C.重结晶提纯苯甲酸过程中要用到装置③进行分离操作
D.用装置④电解精炼铜,c电极为粗铜,d电极为精铜
5.某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素;②该化合物中碳、氢原子个数比为1∶4;
③无法确定该化合物是否含有氧元素;④该化合物中一定含有氧元素。
A.②④ B.①② C.③④ D.②③
6.阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为:
则下列说法不正确的是( )
A.丙二酸与乙二酸(HOOC—COOH)互为同系物
B.由题中信息可知阿魏酸的分子式为C10H12O4
C.香兰素、阿魏酸都是芳香族化合物
D.阿魏酸分子最多有10个碳原子共平面
7.判断下图中装置,哪些能形成原电池( )
8.现有三组混合液:①乙酸乙酯和乙酸钠溶液,②乙醇和丁醇,③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
9.青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构) ( )
A.5种 B.6种
C.7种 D.8种
10.下列物质的类别与所含官能团都正确的是( )
A. 酚类 –OH B. 羧酸 –CHO
C. 醛类 –CHO D. CH3-O-CH3 醚类
11.如图所示的各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①
12.以NA表示阿伏加德罗常数,下列说法错误的是( )
A.1 mol化学式为CnH2n+2的烷烃分子中共价键数目为(3n+1)NA
B.1 mol乙烯分子含σ键数目为5 NA
C.1 mol —OH中的电子总数为10 NA
D.1 mol—CH3中的电子总数为9NA
13.X、Y、Z、M、N代表五种金属,有以下化学反应:
(1)水溶液中X+Y2+===X2++Y;
(2)Z+2H2O(冷水)===Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,电极反应为M-2e-===M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化。
则这五种金属的活动性由弱到强的顺序是( )
A.M
0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
A.在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B.在反应器恒温下,向甲中通入惰性气体,乙中x、y 的转化率增大
C.在反应器绝热下,向乙中通入z气体,反应器中温度升高
D.在反应器绝热下,向甲中通入惰性气体,c 的物质的量不变
第Ⅱ卷 (非选择题 共55分)
二、非选择题(本大题共5小题,共55分)
21.按要求,完成下列各小题
(1) 中含有的官能团的名称为 , 。
(2)1,4-二甲苯的结构简式 。
(3)有机物CH3CH(C2H5)CH(CH3)2的名称是 。
(4) 的分子式 ;名称是 。
22.A、B、C、D、E、F是原子序数依次增大的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层电子均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为 。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为 。
(3)C、D、E元素的第一电离能由大到小排序 。(用元素符号表示)
(4)A和D形成的18电子化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,
相应的离子方程式为 。
(5)F与C形成化合物的晶胞如图所示,该化合物的化学式为 ,C离子的配位数是 。此立方晶体的边长为a cm,则该晶体密度为 g/cm3。
23.化学上常用燃烧法确定有机物的组成。下图是用燃烧法确定有机物化学式常用的装置,该方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中发生反应的化学方程式为______________________________________,
(2)C装置(燃烧管)中CuO的作用是_______________________________________,
(3)写出E装置中所盛放试剂的名称_____________,
(4)将4.6 g有机物M进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质的实验式是________。
(5)经测定,有机物M的核磁共振氢谱示意图如图,则M的结构简式为_________________。
24.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
温度
250 ℃
300 ℃
350 ℃
KⅠ
2.0
0.27
0.012
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,
计算可得此段时间的反应速率(用H2表示)为 mol·L-1·min-1。
(2)由表中数据判断ΔH1______(填“>”“<”或“=”)0;
反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=_________(用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是______(填序号)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=__________________;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡_______(填“正向”“逆向”或“不”)移动,平衡常数KⅡ__________(填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是______(填“Ⅰ”或“Ⅱ”)。
25.CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
(1) 图一是根据反应Zn + CuSO4 == Cu + ZnSO4 设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)一段时间后,燃料电池的电解质溶液完全转化为K2CO3,以下关系正确的是 。
A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(K+)>c(CO32-)>c(H+)>c(OH-)
D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-)
E.c(K+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)
化学参考答案
一、选择题(1——15题每小题2分,16——20题每小题3分,共计45分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
C
A
B
D
C
C
D
题号
11
12
13
14
15
16
17
18
19
20
答案
A
C
C
C
C
A
C
A
B
D
二、非选择题(共55分)
21.(每空1分,共6分)
(1)羟基 酯基 (2)
(3)2,3-二甲基戊烷 (4)C7H14 3,3-二甲基-1-戊烯
22.(每空2分,共14分)
(1)1s22s22p63s23p63d9或[Ar]3d9 (2)V形
(3)N>O>S (4)H2O2+CN-+OH- = CO32-+NH3
(5)Cu3N 6 206/(a3NA)
23.(每空2分,共10分)
(1)2H2O2 = 2H2O + O2↑ (2)作氧化剂,确保有机物充分转化为CO2和H2O
(3)碱石灰或生石灰 (4)C2H6O (5)CH3CH2OH
24.(前3空每空1分,其余各题每空2分,共13分)
(1)0.24 (2)< ΔH2-ΔH1 (3)b
(4) 正向 不变 (5)Ⅰ
25.(每空2分,共12分)
(1)Cu2++2e- = Cu 乙
(2)O2 CH4-8e-+10OH- = CO32- +7H2O 0.28 (3)BD