- 2021-08-24 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江西省宜丰中学高二上学期期末考试化学试题 Word版
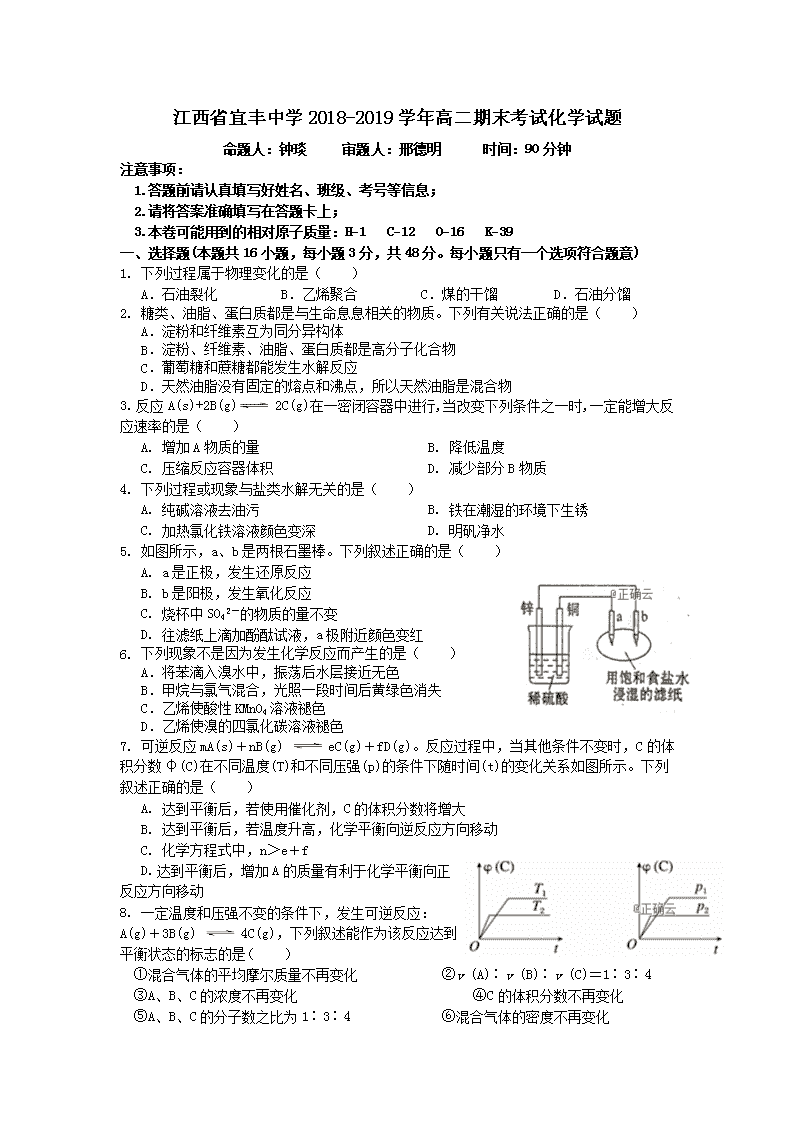
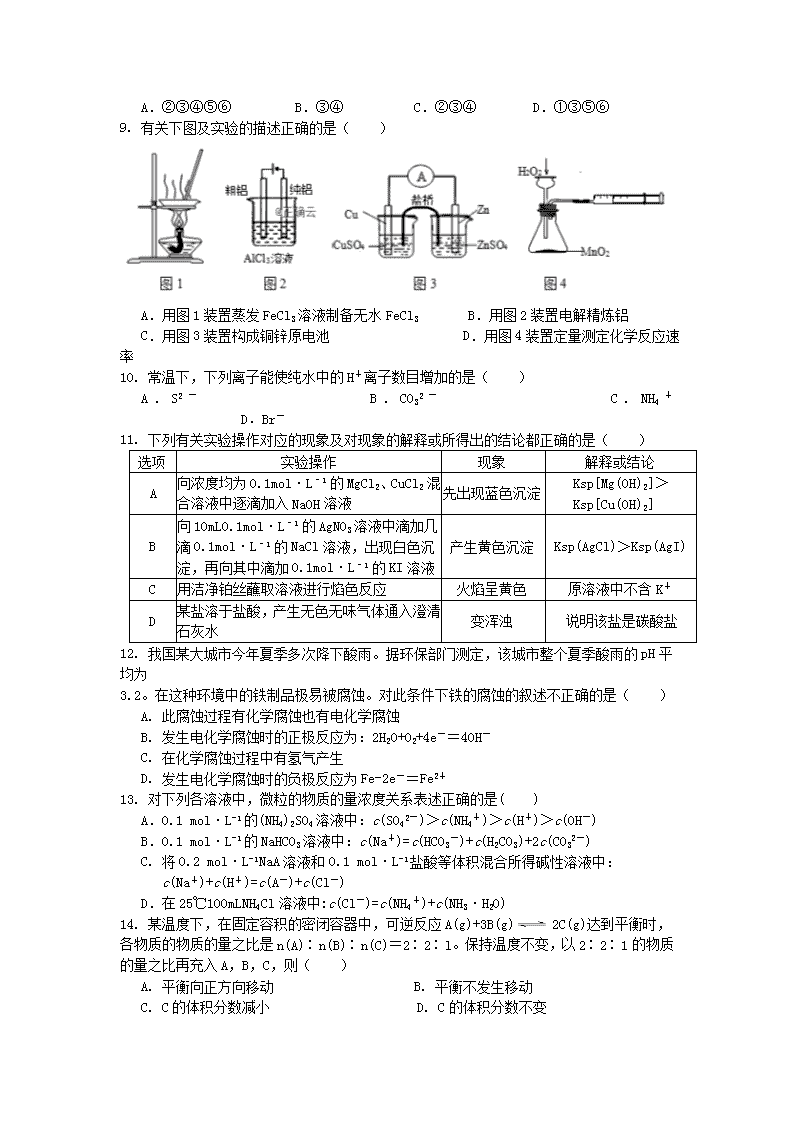
江西省宜丰中学2018-2019学年高二期末考试化学试题 命题人:钟琰 审题人:邢德明 时间:90分钟 注意事项: 1.答题前请认真填写好姓名、班级、考号等信息; 2.请将答案准确填写在答题卡上; 3.本卷可能用到的相对原子质量:H−1 C−12 O−16 K−39 一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意) 1. 下列过程属于物理变化的是( ) A.石油裂化 B.乙烯聚合 C.煤的干馏 D.石油分馏 2. 糖类、油脂、蛋白质都是与生命息息相关的物质。下列有关说法正确的是( ) A.淀粉和纤维素互为同分异构体 B.淀粉、纤维素、油脂、蛋白质都是高分子化合物 C.葡萄糖和蔗糖都能发生水解反应 D.天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 3. 反应A(s)+2B(g)2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是( ) A. 增加A物质的量 B. 降低温度 C. 压缩反应容器体积 D. 减少部分B物质 4. 下列过程或现象与盐类水解无关的是( ) A. 纯碱溶液去油污 B. 铁在潮湿的环境下生锈 C. 加热氯化铁溶液颜色变深 D. 明矾净水 5. 如图所示,a、b是两根石墨棒。下列叙述正确的是( ) A. a是正极,发生还原反应 B. b是阳极,发生氧化反应 C. 烧杯中SO42-的物质的量不变 D. 往滤纸上滴加酚酞试液,a极附近颜色变红 6. 下列现象不是因为发生化学反应而产生的是( ) A.将苯滴入溴水中,振荡后水层接近无色 B.甲烷与氯气混合,光照一段时间后黄绿色消失 C.乙烯使酸性KMnO4溶液褪色 D.乙烯使溴的四氯化碳溶液褪色 7. 可逆反应mA(s)+nB(g) eC(g)+fD(g)。反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度(T)和不同压强(p)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( ) A. 达到平衡后,若使用催化剂,C的体积分数将增大 B. 达到平衡后,若温度升高,化学平衡向逆反应方向移动 C. 化学方程式中,n>e+f D. 达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 8. 一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g) 4C(g),下列叙述能作为该反应达到平衡状态的标志的是( ) ①混合气体的平均摩尔质量不再变化 ②v (A)∶v (B)∶v (C)=1∶3∶4 ③A、B、C的浓度不再变化 ④C的体积分数不再变化 ⑤A、B、C的分子数之比为1∶3∶4 ⑥混合气体的密度不再变化 A.②③④⑤⑥ B.③④ C.②③④ D.①③⑤⑥ 9. 有关下图及实验的描述正确的是( ) A.用图1装置蒸发FeCl3溶液制备无水FeCl3 B.用图2装置电解精炼铝 C.用图3装置构成铜锌原电池 D.用图4装置定量测定化学反应速率 10. 常温下,下列离子能使纯水中的H+离子数目增加的是( ) A.S2- B.CO32- C.NH4+ D.Br- 11. 下列有关实验操作对应的现象及对现象的解释或所得出的结论都正确的是( ) 选项 实验操作 现象 解释或结论 A 向浓度均为0.1mol·L﹣1的MgCl2、CuCl2混合溶液中逐滴加入NaOH溶液 先出现蓝色沉淀 Ksp[Mg(OH)2]> Ksp[Cu(OH)2] B 向10mL0.1mol·L﹣1的AgNO3溶液中滴加几 滴0.1mol·L﹣1的NaCl溶液,出现白色沉 淀,再向其中滴加0.1mol·L﹣1的KI溶液 产生黄色沉淀 Ksp(AgCl)>Ksp(AgI) C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中不含K+ D 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 变浑浊 说明该盐是碳酸盐 12. 我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为 3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( ) A. 此腐蚀过程有化学腐蚀也有电化学腐蚀 B. 发生电化学腐蚀时的正极反应为:2H2O+O2+4e-=4OH- C. 在化学腐蚀过程中有氢气产生 D. 发生电化学腐蚀时的负极反应为Fe-2e-=Fe2+ 13. 对下列各溶液中,微粒的物质的量浓度关系表述正确的是( ) A.0.1 mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) C. 将0.2 mol·L-1NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A-)+c(Cl-) D.在25℃100mLNH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O) 14. 某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B)∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( ) A. 平衡向正方向移动 B. 平衡不发生移动 C. C的体积分数减小 D. C的体积分数不变 15. 芬兰籍华人科学家张霞昌研制的“超薄型软电池”获2009年中国科技创业大赛最高奖。被称之为“软电池”的纸质电池总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是( ) A. 该电池中Zn作负极,发生还原反应 B. 该电池反应中MnO2起催化作用 C. 该电池工作时电流由Zn经导线流向MnO2 D. 该电池正极反应式为:2MnO2+2e-+2H2O=2MnOOH+2OH- 16. 实验室采用下图所示装置制备乙酸乙酯。实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入石蕊溶液1毫升,发现石蕊溶液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管)。下列有关该实验的描述不正确的是( ) A.制备的乙酸乙酯中混有乙酸和乙醇杂质 B.该实验中浓硫酸的作用是催化和吸水 C.饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇和乙酸 D.石蕊层为三层,由上而下是蓝、紫、红 二、非选择题(共52分) 17.(16分)请回答下列问题: (1)氯化铝水溶液呈 (填“酸”、“中”或“碱”)性,原因是(用离子方程式表示) ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (填化学式)。 (2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 (填化学式)。 (3)已知纯水在T℃时,pH=6,该温度下某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)= mol·L-1。 (4)常温下,向一定体积的0.1 mol/L的醋酸溶液中加水稀释后,溶液的pH将 (填“增大”、“不变”或“减小”)。关于该稀释过程下列说法正确的是 。 A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)也增大 C.溶液中不变 D.溶液中增大 (5)常温下,浓度均为0.1 mol/L的五种溶液的pH如下表所示。 溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN pH 8.8 9.7 11.6 10.3 11.1 根据表中数据,回答问题: ①若分别稀释等浓度的下列四种酸溶液(稀释倍数相同),pH变化最小的是 ; A.HCN B.HClO C.H2CO3 D.CH3COOH ②等体积等浓度的NaCN、NaClO两溶液中所含阴、阳离子总数的大小关系为 。 A.前者大 B.相等 C.后者大 D.无法确定 18.(12分)在密闭容器中进行反应①Fe(s)+C02(g)FeO(s)+CO(g) ΔH1=akJ·mol-1 反应②2CO(g)+02(g)2C02(g) △H2=b kJ·mol-1 反应③2Fe(s)+02(g)2FeO(s) △H3 (1)△H3= (用含a、b的代数式表示)。 (2)反应①的化学平衡常数表达式K= 。已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。 (3)将(2)中的平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。 A.缩小反应器体积 B.再通入CO2 C.升高温度 D.使用合适的催化剂 19.(10分)右图为CH4燃料电池的装置(A、B为多孔碳棒): (1) (填A或B)处电极入口通甲烷,其电极反应式为 。 (2)该燃料电池工作时溶液中的K+向 (填A或B)极移动。 (3)现有500 mL KNO3和Cu(N03)2的混合溶液,其中c(NO3-)=6.0mol·L-1,若以CH4燃料电池作为外接电源,且两极均用石墨作电极电解此混合溶液,工作一段时间后,电解池中两极均收集到22.4 L气体(标准状况,下同),则燃料电池消耗CH4体积为 L;假定电解后溶液体积仍为500 mL,原混合溶液中c(K+)为 mol·L-1。 20.(14分)10℃时,常压下加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化: 温度(℃) 10 20 30 加热煮沸后冷却到50℃ pH 8.3 8.4 8.5 8.8 (1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。 (2)丙同学认为甲、乙的判断都不充分。丙认为:只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙同学判断正确。试剂X是 。 A. Ba(OH)2溶液 B. BaCl2溶液 C. NaOH溶液 D. 澄清的石灰水 (3)将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则甲同学判断正确。 (4)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。 (5)将amol/L的Na2CO3溶液与bmol/L的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确的是 。 A. c(Na+)+ c(H+)>c(CO32-)+c(HCO3-)+c(OH-) B.c(Na+)>c(CO32-)+ c(HCO3-)+c(H2CO3) C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b D.若c(CO32-)+2c(OH-)=2c(H+)+ c(HCO3-)+ 3c(H2CO3),则可确定a=b (6)已知25℃时,Ksp [CaCO3]=2.8×10﹣9,Ksp [MgCO3]=6.8×10﹣6。该温度下向物质的量浓度均为0.02mol·L﹣1的MgCl2和CaCl2混合溶液中逐滴加入Na2CO3溶液,当CaCO3和MgCO3两种沉淀共存时,= (保留2位有效数字)。 高二期末考试试题答案 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答案 D D C B C A B B C C A B D A D D 17.(共16分)(1)酸(1分) Al3++3H2O Al(OH)3+3H+(2分) Al2O3 (2分) (2)NaOH(2分) (3)10-12 (2分) (4)增大(1分) C(2分) (5)①A ②C (每空2分) 18.(共12分,每空2分)(1)(2a+b)kJ·mol-1 (2)c(C0)/c(C02) 50% 0.5 mol/L (3) > BC(只选一个得1分,错选不得分) 19.(共10分,每空2分)(1)B CH4+10OH--8e-= CO32-+7H2O (2)A (3)8.96 2.0 20.(共14分)(1)HCO3-+H2O H2CO3+OH-(2分);大于(1分); (2)B(2分); (3)等于(2分); (4)乙(1分); 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃(2分) (5)C(2分) (6)4.1×10﹣4 (2分)查看更多