- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版高考化学实战策略作业
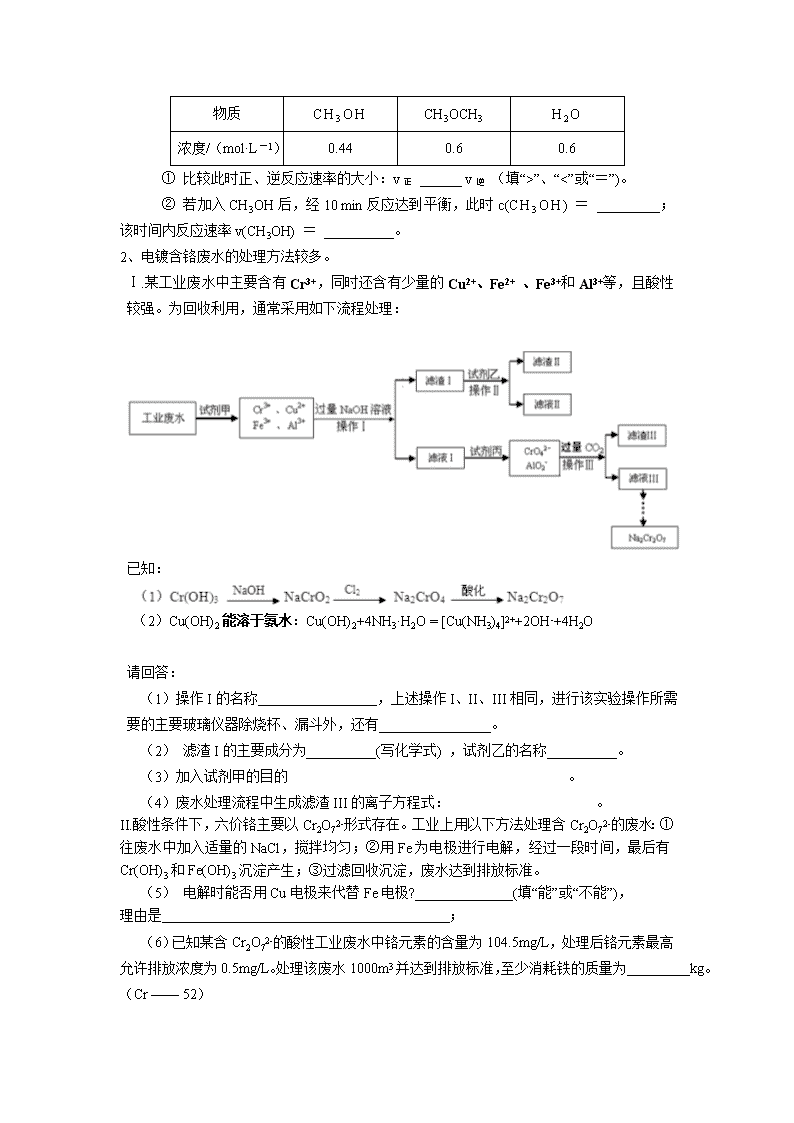
2020届一轮复习人教版 高考化学实战策略 作业 一、选择题(每小题只要一个选项符合题意) 1、化学与生活密切相关,下列有关说法正确的是 A.维生素C具有还原性,在人体内起抗氧化作用 B.糖类、蛋白质、油脂属于天然高分子化合物 C.煤经气化和液化两个物理变化过程,可变为清洁能源 D. 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 2、下列与有机物的结构、性质有关的叙述正确的是( ) A.苯、油脂均不能使酸性KMnO4溶液褪色 B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 3、用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( ) A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA 4、下列叙述正确的是 A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 C.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等 D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 5、向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是 操作 现象 结论 A 滴加BaCl2溶液 生成白色沉淀 原溶液中有SO42- B 滴加氯水和CCl4,振荡、静置 下层溶液显紫色 原溶液中有I― C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+、无K+ D 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+ 6、肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知: N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O (g) ΔH = -1 135.7kJ/mol 下列说法正确的是 A.N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1 068 kJ/mol B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O N2H5+ + OH- C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式: N2H4-4e-+ 4OH-=N2+4H2O D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大 7、下列实验操作与预期实验目的或所得实验结论一致的是 选项 实验操作及现象 实验目的或结论 A. 向1,2两试管中分别加入等浓度H2O2溶液10 mL、1 mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 证明FeCl3溶液的催化效率 更高 B. 向甲酸和甲醛的混合溶液中加入氢氧化钠溶液中和甲酸后,加入新制的氢氧化铜并加热,观察到砖红色沉淀生成 混合物中含有甲醛 C. 测定物质的量浓度相同的盐酸和醋酸溶液的pH;盐酸pH小于醋酸pH 证明盐酸酸性比醋酸强 D. 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 证明非金属性:Cl>Si 二、非选择题 【必做部分】 1、二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。 请回答下列问题: ⑴ 煤的气化的主要化学反应方程式为:_____________________________________。 ⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。 ⑶ 利用水煤气合成二甲醚的三步反应如下: ① 2H2(g) + CO(g) CH3OH(g);ΔH = -90.8 kJ·mol-1 ② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1 ③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1 总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2 (g)的ΔH= ___________; 一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。 a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚 ⑷ 已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下: 物质 CH3OH CH3OCH3 H2O 浓度/(mol·L-1) 0.44 0.6 0.6 ① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。 ② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。 2、电镀含铬废水的处理方法较多。 Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ 、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理: 已知: (2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O = [Cu(NH3)4]2++2OH-+4H2O 请回答: (1)操作I的名称 ,上述操作I、II、III相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有________________。 (2) 滤渣I的主要成分为__________(写化学式) ,试剂乙的名称__________。 (3)加入试剂甲的目的 。 (4)废水处理流程中生成滤渣III的离子方程式: 。 II.酸性条件下,六价铬主要以Cr2O72-形式存在。工业上用以下方法处理含Cr2O72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。 (5) 电解时能否用Cu电极来代替Fe电极?______________(填“能”或“不能”), 理由是 ; (6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L。处理该废水1000m3并达到排放标准,至少消耗铁的质量为 kg。(Cr —— 52) 3、已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃。 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ FeSO4 (1)装置Ⅱ的试管中不装任何试剂,其作用是_______________________,试管浸泡在50℃的水浴中,目的是________________________________。 (2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。 限选试剂:3 mol·L-1 H2SO4、6 mol·L-1 NaOH、0.5 mol·L-1 BaCl2、0.5 mol·L-1 Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。 检验试剂 预期现象和结论 装置Ⅲ的试管中加入________________。 产生大量白色沉淀,证明气体产物中含有SO3。 装置Ⅳ的试管中加入________________。 ___ (3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是 。 【选做部分】(以下三题,任选一题) 1、[化学-选修5 有机化学基础] 已知:① 在稀碱溶液中,溴苯难发生水解 ② 现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。 请回答下列问题: (1)X中官能的名称是 。 (2)F→H的反应类型是 。 (3)I的结构简式为 ; (4)E不具有的化学性质 (选填序号) a.取代反应 b.消去反应 c.氧化反应 d.1molE最多能与2molNaHCO3反应 (5)写出下列反应的化学方程式: ① X与足量稀NaOH溶液共热的化学方程式: ; ② F→G的化学方程式: ; (6)同时符合下列条件的E的同分异构体共有 种,其中一种的结构简式为 。 a.苯环上核磁共振氢谱有两种 b.不能发生水解反应 c.遇FeCl3溶液不显色 d.1molE最多能分别与1molNaOH和2molNa反应 2、[化学-选修2 化学与技术] 我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下: (1)沉淀池中发生的化学反应方程式是 ,上述生产纯碱的方法中副产品的一种用途为 ; (2)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 ; (3)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。 A.增大的浓度,使NH4Cl更多地析出 B.使NaHCO3更多地析出 C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 3、[化学-选修3 物质结构与性质] C和Si元素在化学中占有极其重要的地位。 (1)写出Si的基态原子核外电子排布式 。 从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。 (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。 (3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。 (4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成键和键,SiO2中Si与O原子间不形成上述π健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键 。 【答案与解析】 一、选择题 1、A 【解析】还原性的物质有抗氧化作用,A项正确;B项,糖类不属于高分子,错;C项,煤气化属于化学变化,错;D项,铜和铁组成的原电池,铁作负极被腐蚀,故D错。 2、C 【解析】油脂中有的也含有碳碳双键,能够与酸性KMnO4溶液发生反应而使之褪色,A项错误;甲烷与Cl2发生的是取代反应,乙烯与溴水发生加成反应,B项错误;乙醇中的官能团是—OH,而乙酸中的官能团是—COOH,二者分子中的官能团不同,D项错误。 3、D 【解析】本题以阿伏加德罗常数为载体,考查NO2、CO2分子中均含有2个氧原子,故NA个CO2和NO2分子混合气体中含有的氧原子数为2NA;乙烯和环丁烷最简式均为CH2,28 g混合气体相当于2mol CH2,含有的碳原子数为2NA; 同样NO2和N2O4的最简式也相同(NO2),92 g混合气体中含有的原子数为6NA,故A、B、C三项均正确。D项因为常温常压下,22.4 L不是1 mol,故转移的电子数不是2NA。 4、D 【解析】A项,苯酚钠为碱性溶液,故错;B项,温度不变,则Kw是不变的,错;C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确。 5、B 【解析】与BaCl2溶液反应生成的白色沉淀可能是BaSO4或BaCO3或BaSO3,A错;在四氯化碳中显紫色的是I2,B正确;黄色火焰可以覆盖K+的浅紫色火焰,故检验K+需通过蓝色钴玻璃观察火焰,C错;NH3极易溶于水,若溶液中含有少量的NH4+时,滴加稀NaOH溶液不会放出NH3,D错;选B。 6、C 7、C 二、非选择题 【必做部分】 1、 (1) C+H2OCO+H2 (2) Na2CO3+H2S==NaHCO3+NaHS (3) -246.4kJ· mol -1(2分) c、e (4) ①>② 0.04 mol·L-1 0.16 mol·L-1·min-1 【解析】(1)煤生成水煤气的反应为:C+H2OCO+H2 (2)既然生成两种酸式盐,应是NaHCO3和NaHS,故方程式为: Na2CO3+H2S==NaHCO3+NaHS。 (3)观察目标方程式,应是①×2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ· mol -1。 正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低;故选c、e。 (4)此时的浓度商Q==1.86<400,反应未达到平衡状态,向正反应方向移动,故正>逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。 由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1, 10min变化的浓度为1.6 mol·L-1,故(CH3OH)=0.16 mol·L-1·min-1。 小结:本题是化学反应原理的综合性试题,考查了化学方程式的书写、盖斯定律的应用、化学平衡移动原理,和利用浓度商和平衡常数的关系判断平衡移动的方向、平衡常数和速率的计算等。 2、(1) 过滤 (1分),玻璃棒 (2) Cu(OH)2、Fe(OH)3 氨水 (3) 将Fe2+氧化成Fe3+ (4) AlO2- +CO2 +2H2O = Al(OH)3↓+HCO3- (5) 不能 因阳极产生的Cu2+不能使Cr2O72-还原到低价态 (答案合理即给分) (6) 336 【解析】从图中可得,操作I是固液分离,故是过滤,玻璃仪器还有玻璃棒;试剂甲将Fe2+ 氧化为Fe3+,然后向Cr3+,Cu2+、Fe3+和Al3+的混合溶液中加过量NaOH溶液,滤渣I的主要成分为Cu(OH)2和Fe(OH)3 ,Cr3+转化为NaCrO2,Al3+转化为NaAlO2;已知(2)中知道Cu(OH)2能溶于氨水,故试剂乙是氨水; 试剂丙是Cl2,将NaCrO2氧化为Na2CrO4;废水处理流程中生成滤渣III的反应是CO2与NaAlO2的反应,由于CO2过量,故生成NaHCO3和Al(OH)3; 处理含Cr2O72-的废水需要产生还原剂Fe2+,不能用Cu代替; Fe2+和Cr2O72-的比例为6:1,Cr元素的质量是(104.5-0.5)×10-3×103×103=1.04×105g,故铁的质量为336kg。 3、(1)防止溶液倒吸入装置Ⅰ 防止SO3液化或凝固 (2)(10分)检验试剂 预期现象和结论 装置Ⅲ的试管中装有BaCl2溶液。 产生大量白色沉淀,证明气体产物中含有SO3。 装置Ⅳ的试管中装有酸性KMnO4溶液。 若溶液紫色褪去,证明气体产物中含有SO2; 若溶液紫色无明显变化,证明气体产物中不含SO2; 或:检验试剂 预期现象和结论 装置Ⅲ的试管中装有BaCl2溶液。 产生大量白色沉淀,证明气体产物中含有SO3。 装置Ⅳ的试管中装有溴水。 若溴水橙色褪去,证明气体产物中含有SO2; 若溴水橙色无明显变化,证明气体产物中不含SO2; (3)NaOH溶液 6 【选做部分】 1、(1)酯基、溴原子 (2)消去 (3) (4)bd (5)① ② (6)4 ; 2、(1), 化肥或电解液或焊药等(其他合理答案均给分) (2)循环Ⅰ 过滤; (3)A、C 3、【解析】(1)C、Si和O的电负性大小顺序为:O>C>Si。(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3 。(3)SiC电子总数是20个,则氧化物为MgO;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。(4) Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键 【考点分析】物质结构与性质、原子结构、杂化方式综合考查 【答案】(1)1s22s22p63s23p2 O>C>Si (2) sp3 共价键 (3)Mg Mg2+半径比Ca2+小,MgO晶格能大 (4)Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键查看更多