- 2021-08-24 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学(1-4班)卷·2018届云南省大理州宾川县第四高级中学高二3月月考(2017
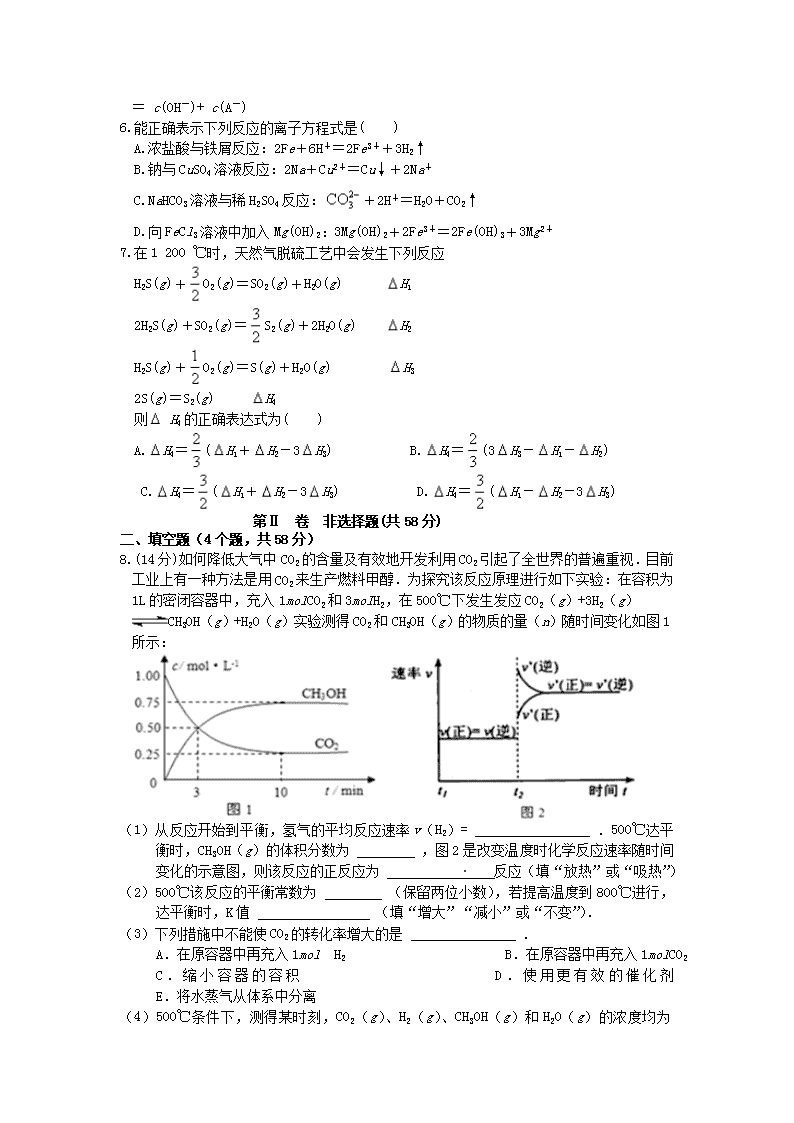
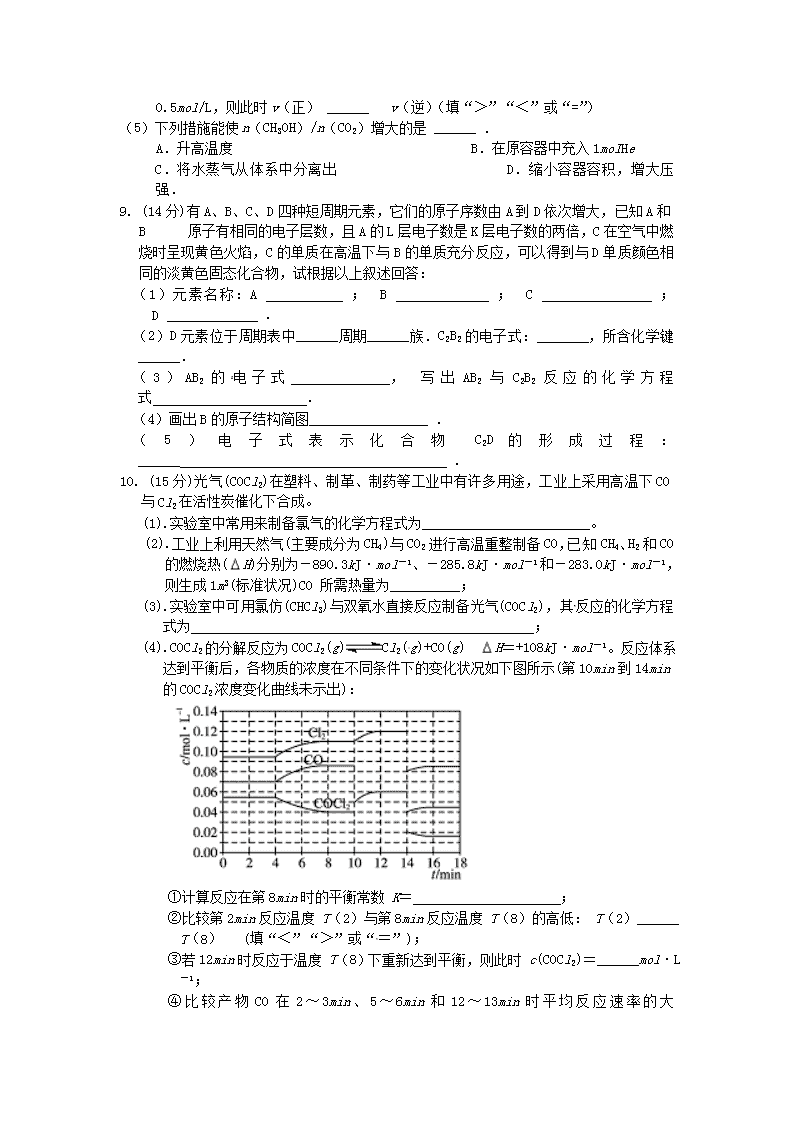
宾川四中2016—2017学年高二年级下学期3月考试 化 学 试 卷(1-4班) 制卷人:苏家兰 考生注意:1、考试时间90分钟,总分100分。 2、所有试题必须在答题卡上作答否则无效。 3、交卷时只交答题卡,请认真填写相关信息。 可能用到的相对原子质量:C—12 H---1 N—14 O---16 第I卷(选择题共42分) 一.单项选择题(本题包括7个小题,每小题6分,共42分。每小题只有一个选项符合题意,请将答案填写在答题卡的相应位置) 1.用 NA表示阿伏加德罗常数的值。下列叙述中 不正确的是( ) A.分子总数为 NA的NO2和CO2混合气体中含有的氧原子数为2 NA B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 NA D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2 NA 2.已知异丙苯的结构简式如图,下列说法错误的是( ) A.异丙苯的分子式为C9H12 B.异丙苯的沸点比苯高 C.异丙苯中碳原子可能都处于同一平面 D.异丙苯和苯为同系物 3.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( ) A.简单离子半径:W<X<Z B.W与X形成的化合物溶于水后溶液呈碱性 C.气态氢化物的热稳定性:W<Y D.最高价氧化物的水化物的酸性:Y>Z 4.下列有关实验的操作正确的是( ) 实验 操作 A 配制稀硫酸 先将浓硫酸加入烧杯中,后倒入蒸馏水 B 排水法收集KMnO4分解产生的O2 先熄灭酒精灯,后移除导管 C 浓盐酸与MnO2反应制备纯净Cl2 气体产物先通过浓硫酸,后通过饱和食盐水 D CCl4萃取碘水中的I2 先从分液漏斗下口放出有机层,后从上口倒出水层 5.已知温度 T时水的离子积常数为 KW,该温度下,将浓度为 amol·L-1的一元酸HA与 bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( ) A. a= b B.混合溶液的pH=7 C.混合溶液中, c(H+)=mol·L-1 D.混合溶液中, c(H+)+ c(B+ )= c(OH-)+ c(A-) 6.能正确表示下列反应的离子方程式是( ) A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ C.NaHCO3溶液与稀H2SO4反应:+2H+=H2O+CO2↑ D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ 7.在1 200 ℃时,天然气脱硫工艺中会发生下列反应 H2S(g)+O2(g)=SO2(g)+H2O(g) H1 2H2S(g)+SO2(g)=S2(g)+2H2O(g) H2 H2S(g)+O2(g)=S(g)+H2O(g) H3 2S(g)=S2(g) H4 则 H4的正确表达式为( ) A.H4=(H1+H2-3H3) B.H4=(3H3-H1-H2) C.H4=(H1+H2-3H3) D.H4=(H1-H2-3H3) 第Ⅱ 卷 非选择题(共58分) 二、填空题(4个题,共58分) 8.(14分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应CO2(g)+3H2(g)CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示: (1)从反应开始到平衡,氢气的平均反应速率v(H2)= .500℃达平衡时,CH3OH(g)的体积分数为 ,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 反应(填“放热”或“吸热”) (2)500℃该反应的平衡常数为 (保留两位小数),若提高温度到800℃进行,达平衡时,K值 (填“增大”“减小”或“不变”). (3)下列措施中不能使CO2的转化率增大的是 . A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2 C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离 (4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”) (5)下列措施能使n(CH3OH)/n(CO2)增大的是 ______ . A.升高温度 B.在原容器中充入1molHe C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强. 9. (14分)有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B 原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答: (1)元素名称:A ; B ; C ; D . (2)D元素位于周期表中______周期______族.C2B2的电子式: ,所含化学键______. (3)AB2的电子式 , 写出AB2与C2B2反应的化学方程式 . (4)画出B的原子结构简图 . (5)电子式表示化合物 C2D 的形成过程:______ . 10. (15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。 (1).实验室中常用来制备氯气的化学方程式为________________________。 (2).工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(H)分别为-890.3kJ·mol-1、-285.8kJ·mol-1和-283.0kJ·mol-1,则生成1m3(标准状况)CO 所需热量为__________; (3).实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气(COCl2),其反应的化学方程式为____________________________ ; (4).COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出): ①计算反应在第8min时的平衡常数 K= ; ②比较第2min反应温度 T(2)与第8min反应温度 T(8)的高低: T(2)______ T(8) (填“<”“>”或“=”); ③若12min时反应于温度 T(8)下重新达到平衡,则此时 c(COCl2)=______mol·L-1; ④比较产物CO在2~3min、5~6min和12~13min时平均反应速率的大小 ; ⑤比较反应物COCl2在5~6min和15~16min时平均反应速率的大小: v(5~6)______ v(15~16)(填“<”“>”或“=”),原因是 。 11. (15分)富马酸(反式丁烯二酸)与Fe2+形成的配合物--富马酸铁又称“富血铁”,可用于治疗缺铁性贫血.如图是合成富马酸铁的一种工艺路线: 回答下列问题: (1)A的化学名称为 由A生成B的反应类型为 . (2)C的结构简式为 . (3)富马酸的结构简式为 . (4)检验富血铁中是否含有Fe3+的实验操作步骤是 . (5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出 ______ LCO2(标 况);富马酸的同分异构体中,同为二元羧酸的还有 (写出结构简式).查看更多