- 2021-08-24 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学反应速率作业(全国通用)(1)
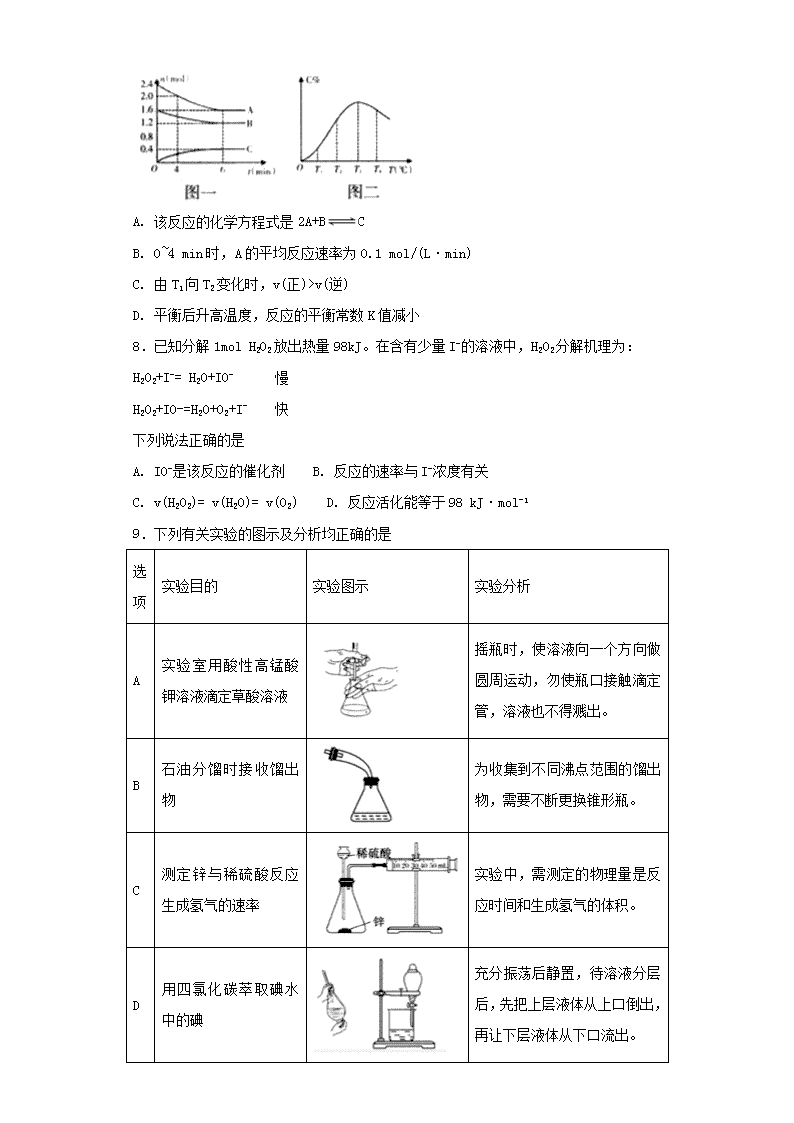
化学反应速率 一、单选题 1.下列有关化学反应速率的叙述正确的是 A. 通常用反应物或生成物的质量变化来表示化学反应速率 B. 对于任何化学反应来说,反应速率越大,反应现象越明显 C. 在密闭容器中进行的反应 C(s)+H2O(g)=CO(g)+H2(g),增加 C(s)的量速率不变 D. 某化学反应速率为 0.5mol/(L·s)是指该反应在 1s 时某物质的浓度为 0.5mol/L 2.已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时, 其速率为( ) N2+3H2⇌2NH3 起始浓度 mol/L 1.0 3.0 0 2 秒末浓度 mol/L 0.6 1.8 a A. 0.2mol/(L•s) B. 0.4mol/(L•s) C. 0.6mol/(L•s) D. 0.8mol/ (L•s) 3.在一定条件下,将 3molA 和 1molB 投入容积为 2L 的密闭容器中,发生如下反应:3A (g)+B(g) xC(g)+2D(g)。2min 末测得此时容器中 C 和 D 的浓度为 0.2mol/L 和 0.4mol/L。下列叙述正确的是 ( ) A. x=2 B. 2min 时,B 的浓度为 0.4mol/L C. 0~2min 内 B 的反应速率为 0.2mol·L-¹·min-¹ D. 此时 A 的转化率为 40% 4.一定温度下,在 2 L 的密闭容器中,X、 Y、 Z 三种气体的物质的量随时间 t(单 位为分钟)变化的曲线如右图,下列描述正确的是 A. t 分钟时该反应达到化学平衡状态 B. 反应开始到 10 分钟,用 X 表示的反应速率为 0.079mol·L-1·min-1 C. 反应开始到 10 分钟时, Y 的转化率为 79.0% D. 反应的化学方程式为: X(g) + 2Y(g) 3Z(g) 5.在一定温度下, 溶液发生催化分解。不同时刻测得生成 的体积(已折算为标准状况)如下表。 t/min 0 2 4 6 8 10 0.0 9.9 17.2 22.4 26.5 29.9 下列叙述不正确的是(溶液体积变化忽略不计) A. 的平均反应速率: B. 的平均反应速率: C. 反应到 时, D. 反应到 时, 分解了 50% 6.在容积为 2L 的密闭容器中发生反应 xA(g)+yB(g) zC(g)。图甲表示 200 ℃ 时容器中 A、B、C 物质的量随时间的变化,图乙表示不同温度下平衡时 C 的体积分数随 起始 n(A)∶n(B)的变化关系。则下列结论正确的是( ) A. 200℃时,反应从开始到平衡的平均速率 v(B)=0.04 mol·L-1·min-1 B. 200℃时,该反应的平衡常数为 25 C. 当外界条件由 200℃降温到 100℃,原平衡一定被破坏,且正逆反应速率均增大 D. 由图乙可知,反应 xA(g)+yB(g) zC(g)的ΔH<0,且 a=2 7.在 10 L 的密闭容器中,A、B、C 三种物质的物质的量(n)与时间(t)的关系如图一所 示,C 的百分含量(C%)与温度(T)的关系如图二所示,下列分析错误的是( ) 2 210 0.40 /mL mol LH O 2O ( )2 /V O mL 0 ~ 6min ( ) ( )2 2 2 3.3 10 / minv H O mol L−= × ⋅ 6 ~10min ( ) ( )2 2 2 3.3 10 / minv H O mol L−< × ⋅ 6min ( )2 2 0.30 /c H O mol L= 6min 2 2H O A. 该反应的化学方程式是 2A+B C B. 0~4 min 时,A 的平均反应速率为 0.1 mol/(L·min) C. 由 T1 向 T2 变化时,v(正)>v(逆) D. 平衡后升高温度,反应的平衡常数 K 值减小 8.已知分解 1mol H2O2 放出热量 98kJ。在含有少量 I-的溶液中,H2O2 分解机理为: H2O2+I-= H2O+IO- 慢 H2O2+IO-=H2O+O2+I- 快 下列说法正确的是 A. IO-是该反应的催化剂 B. 反应的速率与 I-浓度有关 C. v(H2O2)= v(H2O)= v(O2) D. 反应活化能等于 98 kJ·mol-1 9.下列有关实验的图示及分析均正确的是 选 项 实验目的 实验图示 实验分析 A 实验室用酸性高锰酸 钾溶液滴定草酸溶液 摇瓶时,使溶液向一个方向做 圆周运动,勿使瓶口接触滴定 管,溶液也不得溅出。 B 石油分馏时接收馏出 物 为收集到不同沸点范围的馏出 物,需要不断更换锥形瓶。 C 测定锌与稀硫酸反应 生成氢气的速率 实验中,需测定的物理量是反 应时间和生成氢气的体积。 D 用四氯化碳萃取碘水 中的碘 充分振荡后静置,待溶液分层 后,先把上层液体从上口倒出, 再让下层液体从下口流出。 A. A B. B C. C D. D 10.在恒温、恒容的密闭容器中反应 A(g) B(g)+C(g);若反应物的浓度由 2 mol·Lˉ 1 降到 0.8 mol·Lˉ 1 需 20s,那么反应物浓度由 0.8 mol·L ˉ 1 降到 0.2 mol·Lˉ1 所需的时间为 ( ) A. 10s B. 小于 10s C. 大于 10s D. 无法判断 二、填空题 11.化学实验是进行化学研究的有效方法,请回答下列实验中的有关问题。 I.用如图所示的装置测定中和热。 实验药品:100mL 0.50 mol‧L-1 盐酸、100mL 0.55 mol‧L-1NaOH 溶液。 实验步骤:略。 回答下列问题: (1)从实验装置上看,还缺少环形玻璃搅拌棒,该装置的作用是____________;有同 学提议可以用铜质搅拌棒替代,你是否赞同(说明理由)________________。 (2)你认为该实验成功的关键是______________________________。 II.影响化学反应速率的因素很多,某校课外兴趣小组用实验的方法进行探究。甲、乙 两个兴趣小组利用 Mg、Fe、Cu 和不同浓度的硫酸(0.5 mol‧L-1、2 mol‧L-1、18.4 mol ‧L-1),设计实验方案来研究影响反应速率的因素。 (1)请帮助甲小组完成研究的实验报告: 实 验 步 骤 现 象 结 论 ①分别取等体积 0.5 mol‧L-1 硫酸于试管中 ②分别投入大小、形状相同的 Mg、Fe、Cu ③观察金属表面产生气体的快慢 ①产生气体的速率 Mg>Fe ② Cu 上 无 气 体 产 生 _________ 根据控制变量法,要得出正确的实验结论,在实验过程中需要保持温度和压强相同。 (2)乙小组为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。 该小组选用的实验药品是:Fe、2mol‧L-1 硫酸和______mol‧L-1 硫酸。 12.在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g) 2NO2(g)体 系中,n(NO)随时间的变化如下表: (1)用 O2 的反应速率表示 0~2s 内该反应的平均反应速率 v=_______________。若上 述反应在 850℃下进行,反应 2s 时 n(NO)=0.009mol,并且不再随时间而改变,则该 反应是__________热反应。 (2)图中表示 NO2 浓度变化的曲线是__________(填字母)。 (3)能说明该反应已达到平衡状态的是________(填序号)。 A.v(NO2)=2v(O2) B.容器内的压强保持不变 C.v 逆(NO)=2v 正(O2) D.容器内气体密度保持不变 (4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________(填序号)。 A.及时分离出 NO2 B.适当升高温度 C.增大 O2 的浓度 D.选择高效催化剂 13.某同学学习了化学反应速率后,联想到曾用 H2O2 制备氧气,于是设计了下面的实验 方案并进行实验探究。 实验编号 反 应 物 催 化 剂 甲 试管中加入 3 mL 2﹪ H2O2 溶液和 3 滴蒸馏水 无 乙 试管中加入 3 mL 5﹪ H2O2 溶液和 3 滴蒸馏水 无 丙 试管中加入 3 mL 5﹪ H2O2 溶液和 3 滴蒸馏水 1 mL 0.1 mol/L FeCl3 溶液 丁 试管中加入 3 mL 5﹪ H2O2 溶液和 3 滴稀盐酸溶液 1 mL 0.1 mol/L FeCl3 溶液 戊 试管中加入 3 mL 5﹪ H2O2 溶液和 3 滴 NaOH 溶液 1 mL 0.1 mol/L FeCl3 溶液 【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比 较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的 5﹪的 H2O2 溶液加 热到 65℃时就有氧气放出,加热到 80℃时就有较多氧气产生。 (1)上述实验发生反应的化学方程式为 。 (2)实验甲和实验乙的实验目的是 ; 实验丙、实验丁和实验戊的实验目的是 。 (3)请根据该同学查阅的资料分析 H2O2 的性质,解释实验甲和实验乙能否达到实验目 的? 。 (4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在 2 分钟内 6 个 时间点对注射器内气体进行读数,记录数据如下表。 时间/s 20 40 60 80 100 120 实验丙 9.5 19.5 29.0 36.5 46.0 54.5 实验丁 8.0 16.0 23.5 31.5 39.0 46.5气体体积/mL 实验戊 15.5 30.0 44.5 58.5 71.5 83.0 ①对实验戊,0~20 s 的反应速率 v 1= mL/s,100~120 s 的反应速率 v 2= mL/s。 不考虑实验测量误差,二者速率存在差异的主要原因是 。 ②如右图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线 c 表示的是实 验 (填“丙”、“丁”或“戊”)。 14.(1)已知 H2(g)、CO(g)和 CH 3OH(l)的燃烧热△H 分别为-285.8kJ·mol -1、 -283.0kJ · mol-1 和 -726.5kJ · mol-1 。 那 么 用 太 阳 能 分 解 10mol 水 消 耗 的 能 量 是 ____________kJ; (2)由合成气(组成为 H2、CO 和少量的 CO2)直接制备二甲醚,其中的主要过程包括 以下四个反应: 甲醇合成反应: (i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJ•mol-1 (ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1 水煤气变换反应: (iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1 二甲醚合成反应: (iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1 则由 H2 和 CO 直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。 (3)在容积为 1.00L 的容器中,通入一定量 N2O4,发生 N2O4(g) 2NO2(g), 100℃ 时 , 体 系 中 各 物 质 浓 度 随 时 间 变 化 如 图 所 示 。 在 0 ~ 60s 时 段 , v(N2O4)=_______________________, (4)已知反应 2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g) 分子中化学键断裂时分别需要吸收 436kJ、151kJ 的能量,则 1molHI(g)分子中化学 键断裂时需吸收的能量为___________kJ。在 716K 时,气体混合物中碘化氢的物质的量 分数 x(HI)与反应时间 t 的关系如下表 t/min 0 20 40 60 80 120 x(HI) 1 0.91 0.85 0.815 0.795 0.784 上述反应中,正反应速率为 v 正= k 正·x2(HI),逆反应速率为 v 逆=k 逆·x(H2)·x(I2), 其中 k 正、k 逆为速率常数, 若 k 正 = 0.0027min-1,在 t=40min 时,v 正=_______min-1 参考答案 1.C 2.B 3.D 4.C 5.C 6.B 7.B 8.B 9.A 10.C 11. 搅拌(将溶液混合均匀) 不赞同,铜质搅拌棒易散热,使实验误差增大 减少中和 热的损失 金属性越强的金属单质与稀硫酸反应的速率越快(合理答案可给分) 0.5 12.(1)0.0015mol·L-1·s-1;(2 分) 放;(2 分) (2)b;(2 分) (3)BC;(2 分) (4)C (2 分) 13.(1)2H2O2 2H2O + O2↑ (2)探究反应物的不同浓度对反应速率的影响 探究在不同酸碱性条件下,催化剂对反应速率的影响 (3)实验甲和实验乙不能达到实验目的,因为 H2O2 在常温且无催化剂作用的条件下比较稳 定 (4)① 0.775 0.575 随反应的不断进行,H2O2 溶液的浓度逐渐降低,反应速率减小 ② 丁 14 . 2858 2CO ( g ) +4H2 ( g ) =CH3OCH3(g) +H2O(g) △ =-204.7 kJ•mol-1 0.0010mol/(L·s) 299 1.95×10-3 催化剂查看更多