云南省茚旺高级中学2018-2019学年高二上学期10月月考化学试卷
会泽县茚旺高级中学
2018年秋季学期高二年级10月月考试卷
化 学
命题人:解开金 验卷人:杨保玉 审核人:邹美灵
本试卷可能用到的相对原子质量: H:1 C:12 O:16 Na:23
一、选择题(每小题只有一个选项符合题意,每题 2分,共48分)
1、下列说法中正确的是( )
A.在化学反应中,发生物质变化的同时不一定发生能量变化
B.ΔH>0表示放热反应,ΔH<0表示吸热反应
C.ΔH的大小与热化学方程式中的各物质的化学计量数无关
D.反应产物的总焓大于反应物的总焓时,ΔH>0
2、在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
由1 mol CO和3 mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为( )
A.2 912 kJ B.2 953 kJ C.3 236 kJ D.3 867 kJ
3、下列说法中,正确的是( )
A.0.1 mol·L-1盐酸和0.1 mol·L-1硫酸与2 mol·L-1 NaOH溶液反应,其反应速率相同
B.大理石块与大理石粉分别同0.1 mol·L-1盐酸反应,其反应速率相同
C.Mg、Al在相同条件下分别与0.1 mol·L-1盐酸反应,其反应速率相同
D.0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应,其反应速率相同
4、下列说法正确的是( )
A.增大压强,活化分子数增多,化学反应速率一定增大
B.升高温度,活化分子百分数不一定增大,化学反应速率一定增大
C.加入反应物,会使活化分子百分数增加,化学反应速率增大
D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大
5、一定温度下,在2 L的密闭容器中发生反应:M(g)+2N(g)xP(g) ΔH<0,N、P的物质的量随时间变化的关系如图所示。下列有关说法不正确的是( )
A.x=2
B.反应开始2 min内,v(P)=0.1 mol·L-1·min-1
C.2 min后,降低温度平衡向右移动
D.当容器内混合气体压强不再改变时,反应体系达到化学平衡状态
6、下列反应中,在高温下不能自发进行的是( )
A.CO(g)C(s)+ O2(g) B.2N2O5(g)4NO2(g)+O2(g)
C.(NH4)2CO3(s)NH4HCO3(s)+NH3(g) D.MgCO3(s)MgO(s)+CO2(g)
7、在容积不变的密闭容器中,一定条件下发生反应:2A(?)B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小 B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应 D.若向容器中充入惰性气体,则平衡向左移动
8、在一密闭容器中进行以下可逆反应:M(g)+N(g)P(g)+2 L(?)。在不同的条件下P的体积分数φ(P)的变化情况如图,则该反应( )
A.正反应放热,L是固体 B.正反应放热,L是气体
C.正反应吸热,L是气体 D.正反应放热,L是固体或气体
9、下列说法中正确的是( )
A.二氧化硫溶于水能导电,故二氧化硫属于电解质
B.硫酸钡难溶于水,故硫酸钡属于弱电解质
C.硫酸是强电解质,故纯硫酸能导电
D.氢离子浓度相同的盐酸和醋酸导电能力相同
10、在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+,对于该平衡的下列叙述正确的是( )
A.加入水时,平衡逆向移动 B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡正向移动
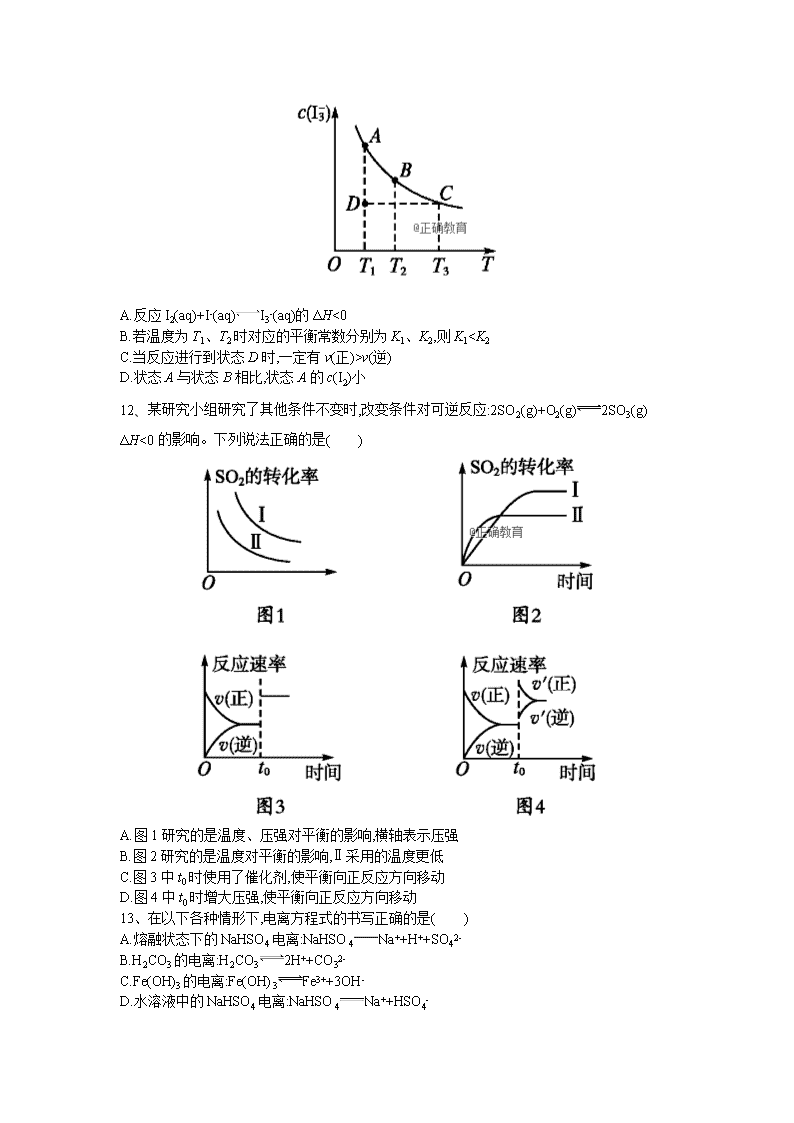
11、I2在KI溶液中存在平衡:I2(aq)+I-(aq)I3-(aq),某I2、KI混合溶液中,温度T与平衡时c(I3-)的关系如图。下列说法不正确的是( )
A.反应I2(aq)+I-(aq)I3-(aq)的ΔH<0
B.若温度为T1、T2时对应的平衡常数分别为K1、K2,则K1
v(逆)
D.状态A与状态B相比,状态A的c(I2)小
12、某研究小组研究了其他条件不变时,改变条件对可逆反应:2SO2(g)+O2(g)2SO3(g) ΔH<0的影响。下列说法正确的是( )
A.图1研究的是温度、压强对平衡的影响,横轴表示压强
B.图2研究的是温度对平衡的影响,Ⅱ采用的温度更低
C.图3中t0时使用了催化剂,使平衡向正反应方向移动
D.图4中t0时增大压强,使平衡向正反应方向移动
13、在以下各种情形下,电离方程式的书写正确的是( )
A.熔融状态下的NaHSO4电离:NaHSO4Na++H++SO42-
B.H2CO3的电离:H2CO32H++CO32-
C.Fe(OH)3的电离:Fe(OH)3Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4Na++HSO4-
14、在某温度下,将1 mol H2和1 mol I2的气态混合物充入1 L的密闭容器中,发生反应:H2(g)+I2(g)2HI(g) ΔH<0;5 min后达到平衡状态,测得c(H2)=0.9 mol·L-1,则下列结论中不能成立的是( )
A.平衡时H2、I2的转化率相等 B.从反应开始至平衡的过程中,v(HI)=0.04 mol·L-1·min-1
C.其他条件不变再向容器中充入少量H2,I2的转化率提高
D.若将容器温度提高,其平衡常数K一定增大
15、对达到化学平衡状态的可逆反应:A+BC+D。若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
16、下列说法或表示方法正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则含1 mol H2SO4的稀溶液和含1 mol Ba(OH)2的溶液反应的ΔH=2×(-57.3) kJ·mol-1
B.增大N2的量,可使可逆反应N2(g)+3H2(g)2NH3(g)的ΔH增大
C.在稀溶液中,H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,则放出的热量大于57.3 kJ
D.反应2SO2(g)+O2(g)2SO3(g)和反应4SO2(g)+2O2(g)4SO3(g)的ΔH相等
17、下列说法正确的是( )
A.电离常数受溶液中电解质浓度的影响 B.电离常数可以表示弱电解质的相对强弱
C.电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的c(H+)大
D.H2CO3的电离常数表达式:K=
18、下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离程度与浓度关系的是( )
19、通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)2H2(g)+O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)CO(g)+H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
A.反应①中电能转化为化学能 B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小 D.反应CH4(g)C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
20、已知:
P4(g)+6Cl2(g)4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。
下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能 B.可求Cl2(g)+PCl3(g)PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ·mol-1 D.P—P键的键能为 kJ·mol-1
21、pH=1的两种一元酸HX和HY溶液,分别取100 mL加入足量的镁粉,充分反应后,收集到H2体积分别为V(HX)和V(HY)。若相同条件下V(HX)>V(HY),则下列说法正确的是( )
A.HX可能是强酸 B.反应开始时二者生成H2的速率不相等
C.HX的酸性弱于HY的酸性 D.HY一定是强酸
22、在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法错误的是( )
容器
甲
乙
丙
反应物投入量
1 mol N2、
3 mol H2
2 mol NH3
4 mol NH3
NH3的平衡
浓度(mol·L-1)
c1
c2
c3
反应的能量变化
放出a kJ
吸收b kJ
吸收c kJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
A.2c12p2=2p1
23、已知:
①C(s)+O2(g)CO2(g) ΔH=-393.5 kJ·mol-1 ②2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶3 D.3∶2
24、将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+) B.Ka(HF) C. D.
二、非选择题,共52分。
25、(8分)某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示,则在恒定T、P条件下应满足:
(1)若X=0、Y=0,则Z 。
(2)若X=0.75,则Y =2.25mol ,Z 。
(3)X、Y、Z应满足的一般条件是 、 。
26、(8分)已知2A2(g)+B2(g)2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
(1)a (填“>”“=”或“<”)b。
(2)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量c kJ,C的浓度
(填“>”“=”或“<”)w mol·L-1。
(3)能说明该反应已经达到平衡状态的是 。
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内气体的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是 。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
27、(8分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式: 。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
温度
实验
次数
起始温度t1/℃
终止温
度t2/℃
温度差
平均值
(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②用上述实验数值计算结果为53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因可能是
(填字母)。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
28、(12分)(1)反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
700 ℃
900 ℃
K1
1.47
2.15
K2
2.38
1.67
反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH,平衡常数K,则ΔH= (用ΔH1和ΔH2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是 (填“吸热”或“放热”)反应。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为 mol·L-1。
②下列措施中能使平衡时增大的是 (填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
29、(16分)Ⅰ.Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应: Na2SO3(aq)+Cl2(g)+H2O(l)=Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
Cl2(g)+H2O(l)=HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式: 。
Ⅱ.25 ℃,两种常见酸的电离常数如下表所示。
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
①HSO3-的电离常数表达式K= 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
Ⅲ.红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=_____________________。
(2)如图1所示,在0—2min内CO2的平均反应速率为____________________。
(3)图1、图2表示上述反应在2min时达到平衡、在4min时因改变某个条件而发生变化的曲线。由图1判断,反应进行至4min时,曲线发生变化的原因是______________(用文字表达);由图2判断,4min到6min的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂 c.通入O2 d.缩小容器体积
(4)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
已知该反应能自发进行,则下列图像正确的是____________。
一、选择题
1-5 D B D D B 6-10 A C B D B 11-15 B D C D C 16-20 C B D D C 21-24 C D A D
二、非选择题
25、(1)Z >0 (2)Z ≥0 (3)Y=3X,Z≥0
26、(1) > (2) = (3) bc (4) c
27、Ⅰ.5.0
Ⅱ.(1)H2SO4(aq)+NaOH(aq)Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)①30.1 ②acd
28、(1)ΔH1-ΔH2 吸热 (2)①2.0 0.67(或) ②A
29、ⅠNa2SO3(aq)+ HClO(aq) = Na2SO4(aq)+ HCl (aq) △H = (a-b) kJ·mol-1
Ⅱ① ②H2SO3+HCO3-HSO3-+CO2↑+H2O
Ⅲ(1). (2). 0.04mol·L-1·min-1 (3). 对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小 b (4). AC
一、选择题
1-6 D B D D B 6-10 A C B D B 11-15 B D C D C 16-20 C B D D C 21-24 C D A D
二、非选择题
25、(1)Z >0 (2)Z ≥0 (3)Y=3X,Z≥0
26、(1) > (2) = (3) bc (4) c
27、Ⅰ.5.0
Ⅱ.(1)H2SO4(aq)+NaOH(aq)Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)①30.1 ②acd
28、(1)ΔH1-ΔH2 吸热 (2)①2.0 0.67(或) ②A
29、ⅠNa2SO3(aq)+ HClO(aq) = Na2SO4(aq)+ HCl (aq) △H = (a-b) kJ·mol-1
Ⅱ① ②H2SO3+HCO3-HSO3-+CO2↑+H2O
Ⅲ(1). (2). 0.04mol·L-1·min-1 (3). 对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小 b (4). AC