【推荐】2018年9月29日 周末培优-试题君之每日一题君2018-2019学年上学期高二化学人教版(课堂同步系列一)
高考频度:★★★★☆ 难易程度:★★★★☆
以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键
H-H
C=C
C-C
C≡C
C-H
E(kJ/mol)
436
615
347.7
812
413.4
写出甲烷一步生成乙烯的热化学方程式:_________________________,反应中硅化物晶格限域的单中心铁催化剂的作用是________________________;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为___________;
③生成1 mol Z产生的H2约合标准状况下________L。
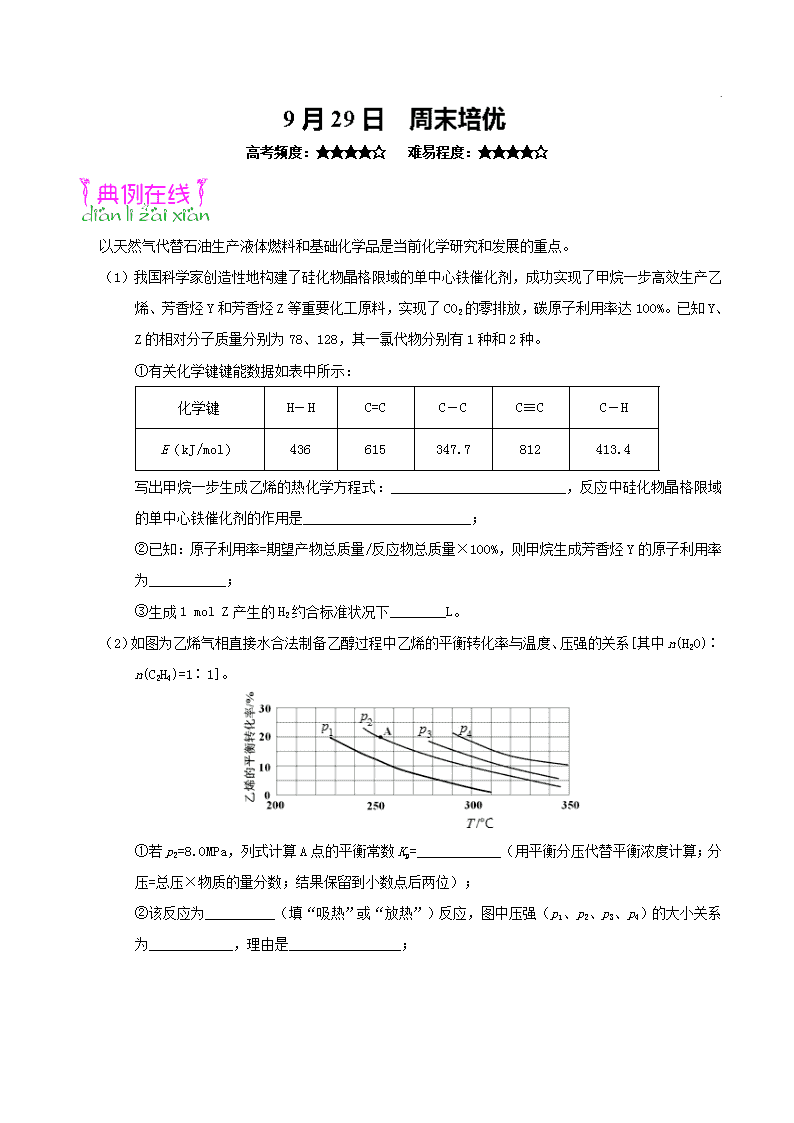
(2)如图为乙烯气相直接水合法制备乙醇过程中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
①若p2=8.0 MPa,列式计算A点的平衡常数Kp=____________(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为__________(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为____________,理由是________________;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______________(任写两条)。
【参考答案】(1)①2CH4(g)C2H4(g)+2H2(g) ΔH=+166.6 kJ/mol 降低反应活化能,加快反应速率
②81.25%
③179.2
(2)①0.07
②放热 p1
”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化
B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化
D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:
①Na2SO3(aq)+Cl2(g)+H2O(l)Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l)HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:________________________。
3.Ⅰ.煤制天然气的工艺流程简图如下:
(1)反应Ⅰ:C(s) + H2O(g)CO(g) + H2(g) ΔH =+135 kJ·mol−1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
(2)反应Ⅱ:CO(g) + H2O(g)CO2(g) + H2(g) ΔH=−41 kJ·mol−1。如图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
①判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1∶3,则反应Ⅱ应选择的温度是_______(填“T1”或“T2”或“T3”)。
(3)①甲烷化反应Ⅳ发生之前需要进行脱酸反应Ⅲ。煤经反应Ⅰ和Ⅱ后的气体中含有两种酸性气体,分别是H2S和_______。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是__________。
Ⅱ.利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,在能源和环境上的意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)2H2O(g)+4CO(g) ΔH>0
CH4超干重整CO2的催化转化原理示意如图:
(4)过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
(5)假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程Ⅰ和过程Ⅱ中均含有氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料=1,可导致过程Ⅱ中催化剂失效
(6)一定条件下,向体积为2 L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的ΔH=________________。
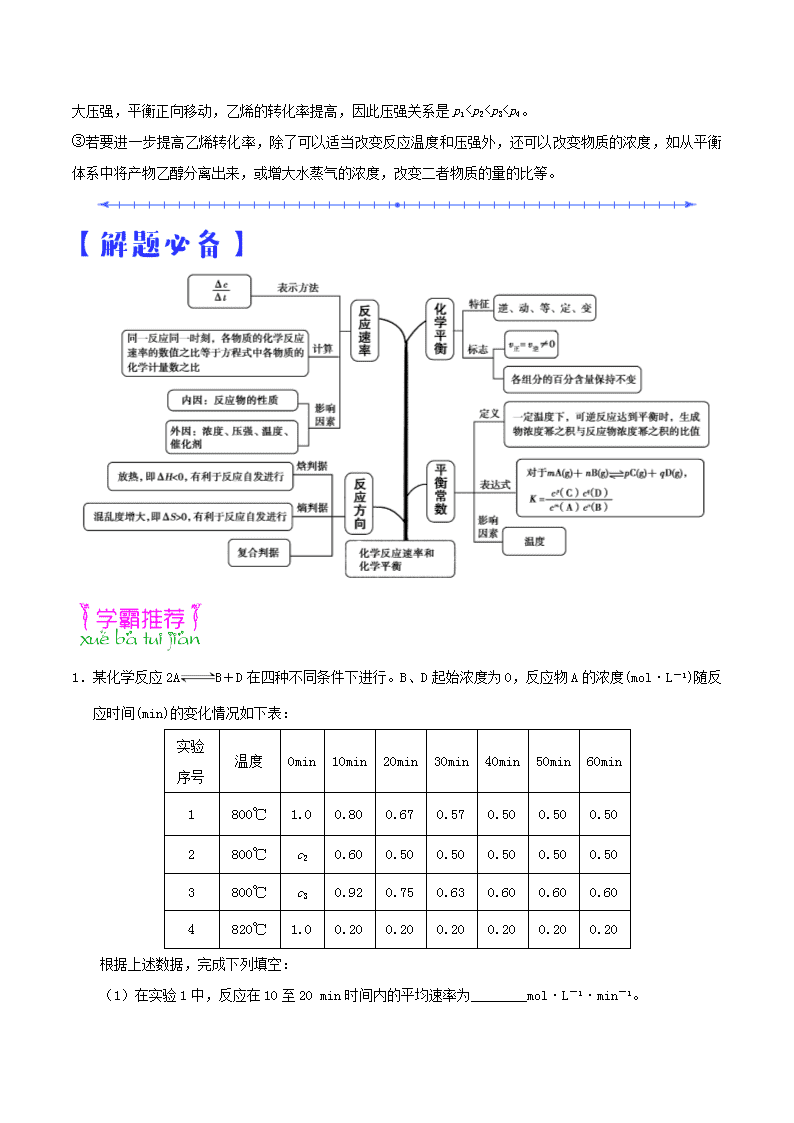
1.【答案】(1)0.013
(2)1.0 使用了催化剂
(3)> >
(4)吸热 温度升高时,平衡向右移动
0.17 mol·L-1,即c3>(0.92+0.17) mol·L-1=1.09 mol·L-1。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4中A的浓度小,说明了实验中A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。
2.【答案】(1)I2O5+5H2SI2+5S+5H2O
(2)①0.15 mol·L−1·min−1
②80% ③<
④向右 ⑤BC
(3)Na2SO3 (aq)+HClO(aq)Na2SO4 (aq)+HCl(aq) ΔH=(a−b) kJ·mol−1
③由图可知T2温度下先达到平衡,说明T2>T1,在平衡状态下由T2到T1,φ(CO2)增大,说明平衡向右移动,故正反应放热,即ΔH <0。
④达到平衡时,b点对应CO2的体积分数为0.8,在该点CO消耗的浓度为0.8 mol·L−1,c(CO2)= 0.8 mol·L−1,c(CO)= 0.2 mol·L−1,根据化学平衡常数表达式K===45,在T1下达平衡时,充入物质的量均为 2 mol 的CO和CO2气体,则相当于CO和CO2的浓度均增加了1 mol·L−1,化学反应的浓度商Q===<45,Q
查看更多