2018-2019学年湖北省荆州中学高二上学期第三次半月考(双周考)化学试题 Word版
2018-2019学年湖北省荆州中学高二上学期第三次半月考(双周考)
化 学 试 卷
命题人:王友金 审题人:白学荔
可能用到的相对原子质量:H-1 O-16 Mg-24 Na-23 C-12 Al-27 Si-28 Fe-56
第Ⅰ卷(选择题,共 48 分) 一、选择题(每小题只有一个选项符合题意,每小题 3 分,共 48 分。)
1.化学是你,化学是我,化学深入我们生活,下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色 B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃 D.PX 项目主要产品对二甲苯属于饱和烃
2.下列实验能获得成功的是( )
A.用溴水可鉴别苯、CCl4、己烯 B.加浓溴水,然后过滤可除去苯中少量己烯
C.苯、溴水、铁粉混合制成溴苯 D.可用分液漏斗分离乙醇和乙酸乙酯
3.NA 为阿伏加德罗常数的值,下列说法正确的是( ) A.18 g D2O 和 18 g H2O 中含有的质子数均为 10NA
B.2 L 0.5 mol·L-1 亚硫酸溶液中含有的 H+离子数为 2NA C.过氧化钠与水反应时,生成 0.1 mol 氧气转移的电子数为 0.2NA D.密闭容器中 2 mol NO 与 1 mol O2 充分反应,产物的分子数为 2NA
Y
Z
X
W
4.短周期元素 X、Y、Z、W 在元素周期表中的相对位置如图所示。已知 Y、W 的原子序 数之和是 Z 的 3 倍,下列说法正确的是
A.原子半径:X
Z C.Z、W 均可与 Mg 形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
+ 3+
�2+ 3+
�2– – –
5. 某无色溶液含有下列离子中的若干种:H+、NH4 、Fe
�、Ba
�、Al
�、CO3
�、Cl 、OH 、
NO3–。向该溶液中加入铝粉,只放出 H2,则溶液中能大量存在的离子最多有( )。
A.3 种 B.4 种 C.5 种 D.6 种
6. 下列文字表述与反应方程式对应且正确的是 ( )。
A.0.5mol/LNaHSO4 与 0.5mol/LBa(OH)2 混合至溶液呈中
2- +
Ba2++OH-+SO4
�+H =BaSO4↓+H2O
B.向 2mol/LFe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
C.向 20mL0.5mol/LFeBr2(aq)中通入 224mLCl2(标况): 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
2- -
D.向 30mL0.5mol/LNaOH(aq)中通入 224mLCO2(标况): 3OH-+2CO2=CO3
�+HCO3 +H2O
7.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转
化关系:下列有关物质的推断不正确的是( )
丁 丁
甲 乙 丙 甲
A.若甲为 AlCl3 溶液,则丁可能是 NaOH 溶液 B.若甲为氮气,则丁可能是 O2
C.若甲为 Fe,则丁可能是稀硝酸 D.若甲为 NaOH 溶液,则丁可能是 CO2
8.分子式为 C5H10O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有(不含立体异构) A.3 种 B.4 种 C.5 种 D.6 种
9.下列说法不正确的是 ( ) A.在其他外界条件不变的情况下,使用催化剂可 以改变化学反应进行的速率 B.NH4HCO3(s)==NH3 (g)+H2O(g)+CO2(g) ΔH= +185.57 kJ·mol-1 能自发进行,原因是体
系有自发地向混乱度增加的方向转变的倾向 C.焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以作为反应自发性的判据 D.ΔH<0、ΔS<0 的反应在任何温度下都能自发进行
10.在密闭容器中,反应 X2(g)+Y2(g) 2XY(g) ΔH<0 达到甲平衡。在仅改变某一条
件后,达到乙平衡,对此过程的分析正确的是( )
A.图Ⅰ是加入反应物的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
11.难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的 TaS2 粉末装入石英管一 端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(s)+2I2 (g) TaI4 (g)+ S2 (g)下列说法正确的是( ) A.在不同温度区域,TaI4 的量保持不变 B.该反应的平衡常数与 TaI4 和 S2 的浓度乘积成反比 C.在提纯过程中,I2 的作用是将 TaS2 从高温区转移到低温区 D.在提纯过程中,I2的量不断减少
12.在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g) 达到平衡时,
再向容器内通入一定量的 N2O4(g),重新达到平衡后,与第一次平衡时相比 NO2 的体积分 数( )
A.不变 B.增大 C.减小 D.无法判断
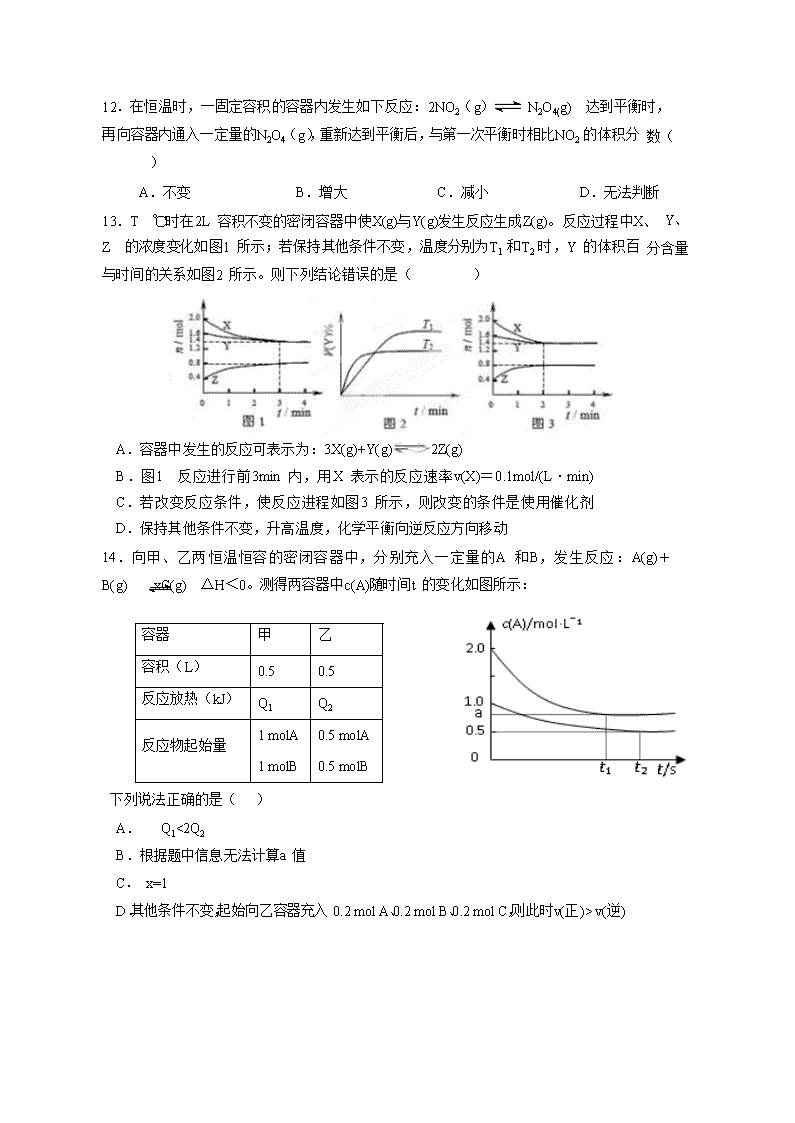
13.T ℃时在 2L 容积不变的密闭容器中使 X(g)与 Y(g)发生反应生成 Z(g)。反应过程中 X、 Y、Z 的浓度变化如图 1 所示;若保持其他条件不变,温度分别为 T1 和 T2 时,Y 的体积百 分含量与时间的关系如图 2 所示。则下列结论错误的是( )
A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B.图 1 反应进行前 3min 内,用 X 表示的反应速率 v(X)=0.1mol/(L·min) C.若改变反应条件,使反应进程如图 3 所示,则改变的条件是使用催化剂 D.保持其他条件不变,升高温度,化学平衡向逆反应方向移动
14.向甲、乙两恒温恒容的密闭容器中,分别充入一定量的 A 和 B,发生反应:A(g)+
B(g) xC(g) △H<0。测得两容器中 c(A)随时间 t 的变化如图所示:
容器
甲
乙
容积(L)
0.5
0.5
反应放热(kJ)
Q1
Q2
反应物起始量
1 molA
1 molB
0.5 molA
0.5 molB
下列说法正确的是( )
A. Q1<2Q2
B.根据题中信息无法计算 a 值
C. x=1
D.其他条件不变,起始向乙容器充入 0.2 mol A、0.2 mol B、0.2 mol C,则此时 v(正)> v(逆)
15.在恒温恒压密闭容器 M(如图Ⅰ)和恒温恒容密闭容器 N(如图Ⅱ)中,两容器中均
加入 a molA 和 a molB,起始时两容器体积均为 VL,发生如下反应并达到化学平衡状态:
2A(?)+ B(?)xC(g) ΔH<0,平衡时 M 中 A、B、C 的物质的量之比为 1∶3∶4。 下列判断不正确的是( )
A.x=2
B.若 N 中气体的密度如图Ⅲ所示,则 A、B 只有一种是气态 C.A 为气体,B 为非气体,则平衡时 M、N 中 C 的物质的量相等 D.若 A、B 均为气体,平衡时 M 中 A 的转化率小于 N 中 A 的转化率
16.某温度下,在 2 L 的密闭容器中,加入 1 mol X(g)和 2 mol Y(g)发生反应:X(g)+
mY(g) 3Z(g) 平衡时,X、Y、Z 的体积分数分别为 30%、60%、10%。在此平衡体系中加 入 1 mol Z(g),再次达到平衡后,X、Y、Z 的体积分数不变。下列叙述不正确的是······· ( )
A.m=2 B.两次平衡的平衡常数相同
C.X 与 Y 的平衡转化率之比为 1∶1 D.第二次平衡时,Z 的浓度为 0.4 mol·L-1
第Ⅱ卷(非选择题,共 52 分)
17.(10 分)
2016 年 8 月的 eLife 上发表了浙江医科大学第二医院和浙江大学肿瘤研究所的晁明和胡 汛等人的一篇论文。媒体以“用十几块钱的小苏打饿死了癌细胞”为题予以报道,报道曲解了 小苏打的作用,但小苏打在他们治疗癌症的方法中确实功不可没。
在实验室中模拟工业制取 NaHCO3 的实验步骤如下: 第一步:连接好装置,检验气密性,在仪器内装入药品。 第二步:先让某一装置发生反应,直到产生的气体不能再在 C 中溶解,再通入另一装
置中产生的气体,片刻后,C 中出现固体。继续向 C 中通入两种气体,直到不再有固体产 生。
第三步:分离 C 中所得的混合物,得到 NaHCO3 固体。第四步:向滤液中加入适量的某固体粉末,有 NH4Cl 晶体析出。
(1)下图所示装置的连接顺序是:a 接 ; 接 ;b 接 (填接口编号)。
(2)A 中常选用的固体反应物为 ;D 中应选用的液体为 。
(3)第二步中让 装置先发生反应
(4)C 中用球形干燥管而不用直导管,其作用是 。
(5)第二步中化学方程式为 。
(6)第三步分离出 NaHCO3 固体的操作为 。
18、(12 分)合成氨反应 N2(g)+3H2(g) 2NH3(g)的平衡常数 K 值和温度的关系 如下:
温 度(℃)
360
440
520
K 值
0.036
0.010
0.0038
(1)写出工业合成氨的化学反应的平衡常数 K 值表达式为_
由上表数据可知该反应为 反应(填“放热”或“吸热”)
(2)原料气 H2 可通过反应 CH4(g) + H2O (g) CO(g) + 3H2(g) 获取,已知该反应中,当
初始混合气中的
�n(H 2O)
n(CH 4 )
�
恒定时,温度、压强对平衡混合气 CH4 含量的影响如下图所示:
图中,两条曲线表示压强的关系是:P1
�P2(填“>”、“=”或“<”),
该反应为 反应(填“吸热”或“放热”)。
(3)原料气 H2 还可通过反应 CO(g) + H2O(g) CO2 (g) + H2 (g) 获取:
①T ℃时,向容积固定为 5 L 的容器中充入 1 mol 水蒸气和 1 mol CO,反应达平衡后,测 得 CO 的浓度为 0.08 mol·L-1,则该温度下反应的平衡常数 K 值为 。
②保持温度仍为 T ℃,改变水蒸气和 CO 的初始物质的量之比,充入容器进行反应,下
列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变 b.混合气体的密度不随时间改变 c.单位时间内生成 a mol CO2 的同时消耗 a mol H2
d.混合气中 n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
19.(10 分)T ℃时,将 3mol 气体 A 和 1mo1 气体 B 通入容积为 2L 且固定不变的密闭容 器中,发生如下反应:3A(g)+B(g)xC(g),2min 时反应达到平衡状态(温度不变),此时容
器内剩余了 0.8molB,并测得 C 的浓度为 0.4mol/L.请填写下列空白:
(1) 从反应开始到平衡状态,生成 C 的平均速率为 ;x= ;
(2) 若向原平衡混合物的容器中再充入 amolC,在 T℃达到新的平衡,此时 B 的物质的量
为 n(B)= mol;
(3)若上述可逆反应的热化学方程式为:3A(g)+B(g) xC(g);△H=-QKJ/mol(Q>0)
①若可逆反应达到平衡后升高体系温度,正反应速率 (填“增大”、“减小” 或“不变”),平衡将 (填“左移”、“右移”或“不移动”)。
②若可逆反应达到平衡后,加入 C,则 C 所占的体积分数 (填“变大”、“变小” 或“不变”,下同),△H 。
20、(10 分)在一个温度恒定的密闭容器中,SO2 和 O2 发生反应.已知消耗 1 mol SO2 时,
放出的热量为 Q.请按要求回答下列问题.
[恒压条件下]
(1)若开始时放入 1 mol SO2 和 0.5 mol O2,达平衡后,生成 0.9 mol SO3,这时 SO2 的转化率 为 .
(2)若开始时放入 4 m ol SO2 和 2 mol O2,达平衡后,生成 SO3 的物质的量为 mol, 反应放出的热量为 .
[恒容条件下]
(3)若开始时放入 1 mol SO2 和 0 .5 mol O2,达平衡后,生成 a mol SO3,则 a 0.9(填“>”、
“<”或“=”).
(4)若令 x、y 和 z 分别代表初始加入 SO2、O2 和 SO3 的物质的量,要使达平衡时,反应混合 物中三种气体的物质的量分别与(3)中平衡时完全相同,则 x、y、z 必须满足的一般条件是
.(用两个代数式表式,其中一个只含 x、y,另一个含 x、z).
21.(10 分)乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
回答下列问题:
(1)A 的结构简式为 。
(2)由乙醇生产 C 的化学反应类型为 。
(3)由 D 生成 E 的化学方程式为 。
(4)由乙醇生成 F 的化学方程式为 。
(5)由 A 生成 B 的化学方程式为 _ 。
参考答案
1
2
3
4
5
6
7
8
B
A
C
C
C
D
B
B
9
10
11
12
13
14
15
16
D
D
C
C
D
C
D
D
17. (10分)
(1)fed (1分,少答、多答或顺序错均无分) c (1分)
(2)石灰石或大理石或块状CaCO3(1分,合理均给分,答出粉状无分)、饱和碳酸氢钠溶液或饱和NaHCO3溶液 (1分)
(3)B (1分)
(4)防止倒吸 (1分,合理均给分)
(5)CO2+H2O+NH3+NaCl=NH4Cl+NaHCO3↓ (2分)
(6)过滤(2分)
18.(每空2分,共12分)
1) K=c(NH3)2/[c(N2)c(H2)3] 放热
2) < 吸热
3) 2.25 cd
19.(共10分)
1) (4分)0.2mol/(L·min) 4
2) (2分)(0.8+0.2a)mol
3) (4分)增大 左移
不变 不变
20.(每空2分,共10分)
1) 90% (2)3.6 3.6Q
(3)< (4)x=2y x+z=1
21. (共10分)
(1)CH3COOH(2)取代反应
(3)nCH2===CHCl-CH2—CHCl-
(4)CH3CH2OHCH2CH2↑+H2O
(5) CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O