- 2021-08-24 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省莆田市第一中学高一上学期第一次月考化学试题+Word版含解析
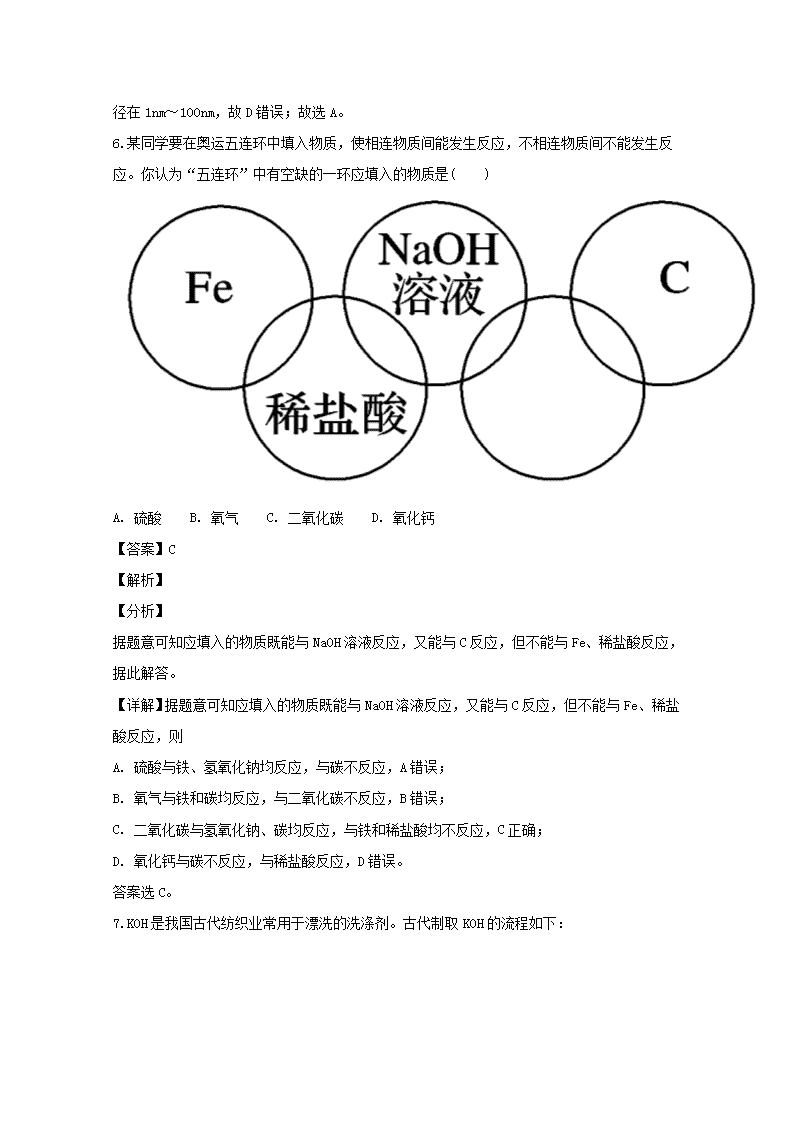
2018-2019学年高一第一次月考试题化学 (时间:60分钟 满分:100分) 相对原子量: C12 O16 Cl35.5 一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意) 1.下列物质的分类合理的是( ) A. 酸性氧化物:CO2、NO、SO2、H2O B. 碱性氧化物:Na2O、CaO、Mn2O7、Na2O2 C. 碱:NaOH、KOH、Ba(OH)2、NH3·H2O D. 铵盐:NH4Cl、NH4NO3、 (NH4)2SO4、CO (NH2)2 【答案】C 【解析】 【详解】A、CO2、SO2是酸性氧化物;H2O、NO是不成盐氧化物,故A错误;B、Na2O、CaO是碱性氧化物,Mn2O7是酸性氧化物,Na2O2是过氧化物,故B错误;C、NaOH、KOH、Ba(OH)2、NH3•H2O在溶液中电离出来的阴离子全部是氢氧根离子,符合碱的概念,故C正确;D、NH4Cl、NH4NO3、(NH4)2SO4是铵盐;CO(NH2)2是尿素属于有机化合物,故D错误;故选C。 2.下列物质能导电且属于电解质的是( ) A. 铜丝 B. 熔融的氯化钠 C. 氨水 D. 蔗糖 【答案】B 【解析】 【详解】A.铜丝能导电,属于单质,既不是电解质也不是非电解质,故A错误;B.熔融的氯化钠能导电,由于能完全电离而导电,故为电解质,且为强电解质,故B正确;C.氨水属于能导电的混合物,既不是电解质也不是非电解质,故C错误;D.蔗糖在水溶液中和熔融状态下均不能导电,故为非电解质,故D错误;故选B。 【点睛】本题考查电解质与非电解质,理解概念是解答的关键。本题的易错点为C,要注意电解质导电的条件是溶于水或在熔化状态下的化合物,单质和混合物既不是电解质也不是非电解质。 3.下列物质的应用或转化与氧化还原反应原理有关的是( ) A. 工业上用铁矿石炼铁 B. 用稀盐酸除去钢铁表面的铁锈 C. 用胃舒平(氢氧化铝)治疗胃酸过多 D. 工业上煅烧石灰石制生石灰 【答案】A 【解析】 【详解】A.工业上用铁矿石炼铁,Fe元素的化合价降低,发生氧化还原反应,与氧化还原反应原理有关,故A选;B.稀盐酸除去钢铁表面的铁锈,生成氯化铁和水,没有元素的化合价变化,与氧化还原反应原理无关,故B不选;C.氢氧化铝和盐酸发生中和反应,属于复分解反应,与氧化还原反应原理无关,故C不选;D.石灰石制生石灰,没有元素的化合价变化,与氧化还原反应原理无关,故D不选;故选A。 4.2016年9月,“天宫二号”发射成功,若在“天宫二号”空间实验室(失重条件下)进行以下实验,其中最难以完成的是( ) A. 将金粉和铜粉混合 B. 将牛奶加入水中混合 C. 蒸发食盐水制取食盐晶体 D. 用漏斗、滤纸过滤除去水中的泥沙 【答案】D 【解析】 试题解析:用漏斗、滤纸过滤除去水中的泥沙,由于失重,滤液无法流出,不能完成过滤操作, D错误; 考点:考查化学实验能完成的条件; 5.判断下列有关化学基本概念的依据正确的是( ) A. 酸:在水溶液里电离出的阳离子全部为H+的化合物 B. 纯净物与混合物:是否仅含有一种元素 C. 电解质与非电解质:辨别依据是水溶液是否导电 D. 溶液与胶体:本质区别是能否发生丁达尔效应 【答案】A 【解析】 【详解】A、水溶液中电离出的阳离子全部为H+的化合物为酸,故A正确;B、纯净物:只由一种物质组成的称为纯净物。混合物:由两种或两种以上物质组成的称为混合物。所以纯净物、混合物与是否仅含一种元素没有必然的关系。比如:O2和O3混合在一起,虽然只含一种元素,但仍是混合物;H2SO4 含三种元素,但由于是一种物质,故仍是纯净物,故B错误;C.电解质与非电解质是根据化合物在水溶液中和熔融状态下能否导电区分的,如碳酸钙在水中不能导电,但在熔融状态下能够导电,因此碳酸钙属于电解质,故C错误;D.溶液与胶体两者的根本区别在于分散质粒子直径的大小,溶液中的分散质粒子直径小于1nm,胶体的胶粒直径在1nm~100nm,故D错误;故选A。 6.某同学要在奥运五连环中填入物质,使相连物质间能发生反应,不相连物质间不能发生反应。你认为“五连环”中有空缺的一环应填入的物质是( ) A. 硫酸 B. 氧气 C. 二氧化碳 D. 氧化钙 【答案】C 【解析】 【分析】 据题意可知应填入的物质既能与NaOH溶液反应,又能与C反应,但不能与Fe、稀盐酸反应,据此解答。 【详解】据题意可知应填入的物质既能与NaOH溶液反应,又能与C反应,但不能与Fe、稀盐酸反应,则 A. 硫酸与铁、氢氧化钠均反应,与碳不反应,A错误; B. 氧气与铁和碳均反应,与二氧化碳不反应,B错误; C. 二氧化碳与氢氧化钠、碳均反应,与铁和稀盐酸均不反应,C正确; D. 氧化钙与碳不反应,与稀盐酸反应,D错误。 答案选C。 7.KOH是我国古代纺织业常用于漂洗的洗涤剂。古代制取KOH的流程如下: 上述流程中没有涉及的化学反应类型是( ) A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应 【答案】C 【解析】 该流程中发生的反应依次是:CaCO3CaO+CO2↑(分解反应),CaO+H2O===Ca(OH)2(化合反应),Ca(OH)2+K2CO3CaCO3↓+2KOH(复分解反应)。 8.完成下列实验所需选择的装置或仪器都正确的是( ) A. 分离植物油和氯化钠溶液选用① B. 除去氯化钠晶体中混有的KNO3晶体选用② C. 分离四氯化碳中的溴单质选用③ D. 除去二氧化碳气体中的氯化氢气体选用④ 【答案】A 【解析】 【详解】A.植物油和氯化钠溶液互不相溶,可用分液的方法分离,故A正确;B.除去氯化钠晶体中混有的KNO3晶体,可用蒸发浓缩、冷却结晶的方法分离,故B错误;C.分离CCl4中的Br2应用蒸馏的方法,不能用过滤的方法,故C错误;D.除去CO2气体中的HCl气体,应用饱和碳酸氢钠溶液洗气,不能用NaOH溶液,因二者都与NaOH反应,故D错误;故选A。 9.中国科学技术大学的钱逸泰教授等以四氯化碳和金属钠为原料,在700 ℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是( ) A. 金刚石属于金属单质 B. 制造过程中元素种类没有改变 C. 四氯化碳是一种化合物 D. 这个反应是置换反应 【答案】A 【解析】 试题分析:A、金刚石主要成分是C,C属于非金属,因此金刚石属于非金属单质,故说法错误;B、化学反应遵循元素守恒,因此元素种类不变,故说法正确;C、CCl4两种元素组成的纯净物,属于化合物,故说法正确;D、此反应有单质的参加和单质的生成,属于置换反应,故说法正确。 考点:考查物质分类、化学反应等知识。 10.某2 mol固体A在一定温度下完全分解,产物都是气体。分解反应式为:2A=B+2C+3D,若测得生成的混合气体与氢气的密度比值为15,则固体A的摩尔质量为( ) A. 30 g/mol B. 45 g/mol C. 90 g/mol D. 氢气密度未知,无法求得 【答案】C 【解析】 【详解】同温同压条件下,气体的密度之比等于相对分子质量之比。测得生成的混合气体的密度在相同条件下是氢气的15倍,可知混合气体的平均摩尔质量是氢气的15倍,即混合气体的平均摩尔质量为:2g/mol×15=30g/mol,反应前后的总质量不变,反应前A的物质的量是反应后的,则A的摩尔质量为:30g/mol×3=90g/mol,故选C。 【点睛】本题考查了物质的量的计算、化学方程式的计算,明确阿伏伽德罗定律及其推论的内容为解本题关键。本题的难点是正确理解气体的密度和相对分子质量间的关系。 11.在自来水蒸馏实验中,下列操作叙述正确的是( ) A. 在蒸馏烧瓶中盛满自来水,并放入几粒沸石 B. 将温度计水银球插入蒸馏烧瓶中液面以下 C. 冷水从冷凝器上口入,下口出 D. 取少量收集到的液体滴入硝酸银和稀硝酸,无明显现象 【答案】D 【解析】 【详解】A.蒸馏烧瓶中不可盛满自来水,液体应该不超过容积的,故A错误;B.温度计测量的是蒸汽的温度,应放在蒸馏烧瓶的支管口处,故B错误;C.冷凝器中冷却水的流向应为下口进水,上口出水,故C错误;D.蒸馏水中没有氯离子,所以不会与硝酸银反应生成氯化银沉淀,故D正确;故选D。 【点睛】本题考查了蒸馏实验的注意事项。解题时注意蒸馏实验的原理,温度计的位置和冷凝水的流向。本题的易错点为A,要注意常见仪器的使用方法。 12.下列叙述正确的是( ) A. 同温同压下,相同体积的物质,其物质的量必然相等 B. 任何条件下,等物质的量的氧气和一氧化碳所含的分子数必然相等 C. 1 L一氧化碳气体一定比1 L氧气的质量小 D. 同温同压下,等体积的物质所含的分子数一定相等 【答案】B 【解析】 【详解】A.同温同压下,气体摩尔体积相等,相同体积的气体,其物质的量相等,但如果是液体或固体,气体摩尔体积对其不适用,其密度不一定相等导致其物质的量不一定相等,故A错误;B.根据N=nNA知,二者的物质的量相等,则分子数一定相等,故B正确;C.温度和压强未知,则气体摩尔体积未知,则无法确定两种气体的物质的量,根据m=nM知,二者的质量无法比较,故C错误;D.如为固体或液体,则等体积的物质的物质的量不一定相等,则其分子数也不一定相等,故D错误;故选B。 13.以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( ) A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1 B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等 C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为 【答案】D 【解析】 【详解】A.根据原子守恒知,三种气体CO、CO2、O3分别都含有1mol O,则三种气体的物质的量分别为1mol、0.5mol、mol,所以三种气体物质的量之比=1mol:0.5mol:mol=6:3:2,故A错误;B.气体摩尔体积受温度和压强影响,温度和压强未知,无法确定气体摩尔体积,导致无法计算二氧化碳的物质的量,所以无法比较二者中C原子个数是否相等,故B错误;C.摩尔质量的单位是g/mol,则该气体摩尔质量是32g/mol,故C错误;D.ag氯气的物质的量==mol,每个氯分子中含有2个氯原子,所以氯分子个数为0.5b,因此NA== /mol,故D正确;故选D。 【点睛】本题考查物质的量有关计算,注意气体摩尔体积适用范围及适用条件。本题的易错点为D,要注意公式的灵活应用。 14.符合如下实验过程和现象的试剂组是( ) A. A B. B C. C D. D 【答案】B 【解析】 【详解】A.碳酸钾与氯化镁反应生成碳酸镁沉淀,加入硝酸,沉淀溶解反应生成硝酸镁溶液,加入硫酸钾不反应,没有白色沉淀生成,故A错误;B.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入硝酸反应生成硝酸钡溶液,加入硫酸钾生成硫酸钡沉淀,故B正确;C.碳酸钾与硝酸钠不反应,故C错误;D.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入盐酸反应生成氯化钡溶液,加入氯化钙不反应,故D错误;故选B。 15.生活因化学而精彩,化学因实验而生动,实验因“洗涤”而更加精准,关于沉淀或晶体洗涤的说法错误的是( ) A. 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 B. 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 C. 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 D. 洗涤的操作是向过滤器里加洗涤剂,一般洗涤剂尽量多加,然后借助玻璃棒搅拌让洗涤剂流下 【答案】D 【解析】 【详解】A.洗净的检验可取最后一次洗涤液少许于试管中,根据是否生成沉淀确定是否含有形成沉淀的该溶液中的离子,故A正确;B.洗涤的试剂常选用:①蒸馏水;②冷水;③有机溶剂,如酒精、丙酮等;④该物质的饱和溶液等,故B正确;C.洗涤的目的是除去晶体表面的可溶性杂质,得到更纯净的晶体,提高纯度,故C正确;D.洗涤的正确方法是:让过滤后的晶体继续留在过滤器中,加洗涤剂浸没晶体,让洗涤剂自然流下,重复2-3次即可,故D错误;故选D。 16.下图表示1gO2与1gX气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是 A. N2 B. CH4 C. CO2 D. NO 【答案】C 【解析】 试题分析:体积相同、温度相同时,气体压强与物质的量成正比,根据图象知,相同温度下,氧气压强大于X气体,说明氧气的物质的量大,根据n=知,质量相同时,物质的量与摩尔质量成反比,氧气的物质的量大于X,则氧气的摩尔质量小于X,这几个选项中只有二氧化碳摩尔质量大于氧气。 【考点定位】阿伏伽德罗定律 【名师点睛】阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同的分子数,称为阿伏加德罗定律。气体的体积是指所含分子占据的空间,因此,当气体所含分子数确定后,气体的体积主要决定于分子间的平均距离而不是分子本身的大小。 推论: (1)同温同压下,V1/V2=n1/n2 (2)同温同体积时,p1/p2=n1/n2=N1/N2 (3)同温同压等质量时,V1/V2=M2/M1 (4)同温同压同体积时,M1/M2=ρ1/ρ2,熟练应用才能解答该题。 二、非选择题(本题包括4大题,共52分) 17.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数的值用NA表示,则: (1)该气体的物质的量为________。 (2)该气体所含原子总数为________。 (3)该气体在标准状况下的体积为________。 (4)该气体在标准状况下的密度为________。 (5)该气体一个分子的质量为________。 【答案】 (1). mol (2). (3). L (4). g/L (5). g 【解析】 【详解】(1)m g某气体的物质的量为= mol,故答案为:mol; (2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即原子数为2× mol×NAmol-1=,故答案为:; (3)该体积的体积为 mol×22.4L/mol=L,故答案为:L; (4)标况下密度为= g/L,故答案为:g/L; (5)该气体一个分子的质量==g,故答案为:g。 18.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: (1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同); (2)除去自来水中的Cl-等杂质,选择装置A,装置A中①的名称是________,进水的方向是从________口进水。实验时A中除加入少量自来水外,还需加入少量碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。 A.立即补 B.冷却后补加 C.不需补加 D.重新配料 收集完蒸馏水后,是先撤酒精灯还是先停冷凝水?_________________________。A中不可能用到的仪器有________(填正确答案标号)。 A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器 (3)①从碘水中分离出I2,可以选择以下哪种萃取剂_____________; A.酒精 B.苯 C.汽油 D.食盐水 ②该分离方法的名称为________。 ③分液漏斗在使用前须清洗干净并________; ④在选择以上萃取剂时,本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。装置B在分液时为使液体顺利滴下,除打开旋塞外,还应进行的具体操作是_____________。 【答案】 (1). D (2). 冷凝管(直形) (3). 下 (4). 防止暴沸 (5). B (6). 先撤酒精灯 (7). CD (8). BC (9). 萃取分液 (10). 检漏 (11). 上口倒出 (12). 打开上口活塞或使活塞上的凹槽对准小孔 【解析】 【详解】(1)从氯化钾溶液中得到氯化钾固体,可用蒸发的方法,选择D装置;故答案为:D; (2)由图可知①为冷凝管,冷凝时要保证冷凝管充满水而充分冷却,水的方向应为下进上出,A 中一般要加入碎瓷片,防止暴沸,补加碎瓷片时需要待已加热的试液冷却后再加入;收集完蒸馏水后,先撤酒精灯后停冷凝水,防止冷凝管骤冷炸裂,且对馏分充分冷却, 蒸馏需圆底烧瓶盛放待蒸馏的液体,需温度计测量蒸气的温度,需接收器接受馏分,用不到C.吸滤瓶、D.球形冷凝管,故答案为:冷凝管;下;防止暴沸;B;先撤酒精灯;CD; (3)①碘在酒精中的溶解度大于在水中的溶解度,但酒精与水互溶,碘在苯中的溶解度大于在水中的溶解度,且碘与苯不反应;水与苯不互溶,碘在汽油中的溶解度大于在水中的溶解度,且碘与汽油不反应;水与汽油不互溶,故选:BC; ②碘易溶于有机溶剂,可萃取和分液的方法分离,故答案为:萃取分液; ③由于分液漏斗有活塞开关,故使用前需要检查是否漏液,故答案为:检漏; ④分液过程中,由于苯或汽油的密度比水小,故应该从分液漏斗的上口倒出,蒸馏时,冷凝水从下端进水,以保证充分冷凝,分液时,为保证液体顺利流出,应使分液漏斗内压强与外界大气压相等,应打开分液漏斗上端活塞或使凹槽对准小孔,故答案为:上口倒出;打开分液漏斗上端活塞或使凹槽对准小孔。 19.粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): (1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。 a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦ (2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。 (3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。 (4)判断SO42—已沉淀完全的方法是__________________。 【答案】 (1). ad (2). 过滤 (3). 蒸发皿 (4). CaCl2+Na2CO3=CaCO3↓+2NaCl (5). FeCl3+3NaOH=Fe(OH)3↓+3NaCl (6). 取上层清液少许于试管中,再加入BaCl2溶液,若产生白色沉淀,说明SO42—未沉淀完全,反之则沉淀安全 【解析】 【详解】(1)除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,先加水溶解,所以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,然后过滤,最后调节溶液的pH等于7后蒸发即可,所以其顺序是⑤③②①⑥④⑦或⑤②③①⑥④⑦,故答案为:ad; (2)根据上述分析,操作Z为过滤,蒸发操作用到的仪器有酒精灯,玻璃棒,蒸发皿,三脚架,泥三角,故答案为:过滤;蒸发皿; (3)第Ⅱ步中,除去Ca2+和Fe3+相应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl;FeCl3+3NaOH=Fe(OH)3↓+3NaCl,故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;FeCl3+3NaOH=Fe(OH)3↓+3NaCl; (4)判断SO42-已沉淀完全的方法是:取上层清液少许于试管中,再加入BaCl2溶液,若产生白色沉淀,说明SO42-未沉淀完全,反之则沉淀安全,故答案为:取上层清液少许于试管中,再加入BaCl2溶液,若产生白色沉淀,说明SO42-未沉淀完全,反之则沉淀完全。 【点睛】本题考查了化学实验的基本操作和物质的分离与提纯。本题的易错点为(1),要注意粗盐提纯过程碳酸钠要在氯化钡之前加入。 20.一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式:XY2(液)+3O2(气)=XO2(气)+2YO2(气)。冷却后,在标准状况下测得生成物的体积为672mL、密度为2.56 g/L。则: (1)反应前O2的物质的量是___________mol。 (2)化合物XY2的摩尔质量是____________。 (3)若XY2分子中X、Y两元素质量之为3:16,则XY2的化学式是_____________。 【答案】 (1). 0.03 (2). 76g/mol (3). CS2 【解析】 【详解】(1)由方程式XY2(液)+3O2(气)=XO2(气)+2YO2(气)可知,该反应是一反应前后气体分子数不变的反应,即反应前后气体体积相同,故反应前O2的体积为672 mL,物质的量是0.672L÷22.4L/mol=0.03mol。 (2)参加反应的氧气是0.03mol,质量是0.03mol×32g/mol=0.96g。由化学方程式可知消耗XY2的物质的量为0.01 mol。又因反应后的气体为672 mL,密度为2.56 g·L-1,则反应后气体总质量为m=ρV=2.56 g·L-1×0.672L=1.72 g。根据质量守恒定律可知m(XY2)=1.72 g-m(O2)=1.72 g-0.96g=0.76 g,所以M(XY2)=0.76g÷0.01mol=76 g·mol-1; (3)设X、Y两元素的相对原子质量分别是M(X)、M(Y),则M(X)+2M(Y)=76,M(X)/2M(Y)=3/16,解得M(X)=12、M(Y)=32,即X为碳,Y为硫,则XY2的化学式是CS。 查看更多