- 2021-08-24 发布 |
- 37.5 KB |
- 15页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一下学期第一次月考化学试题
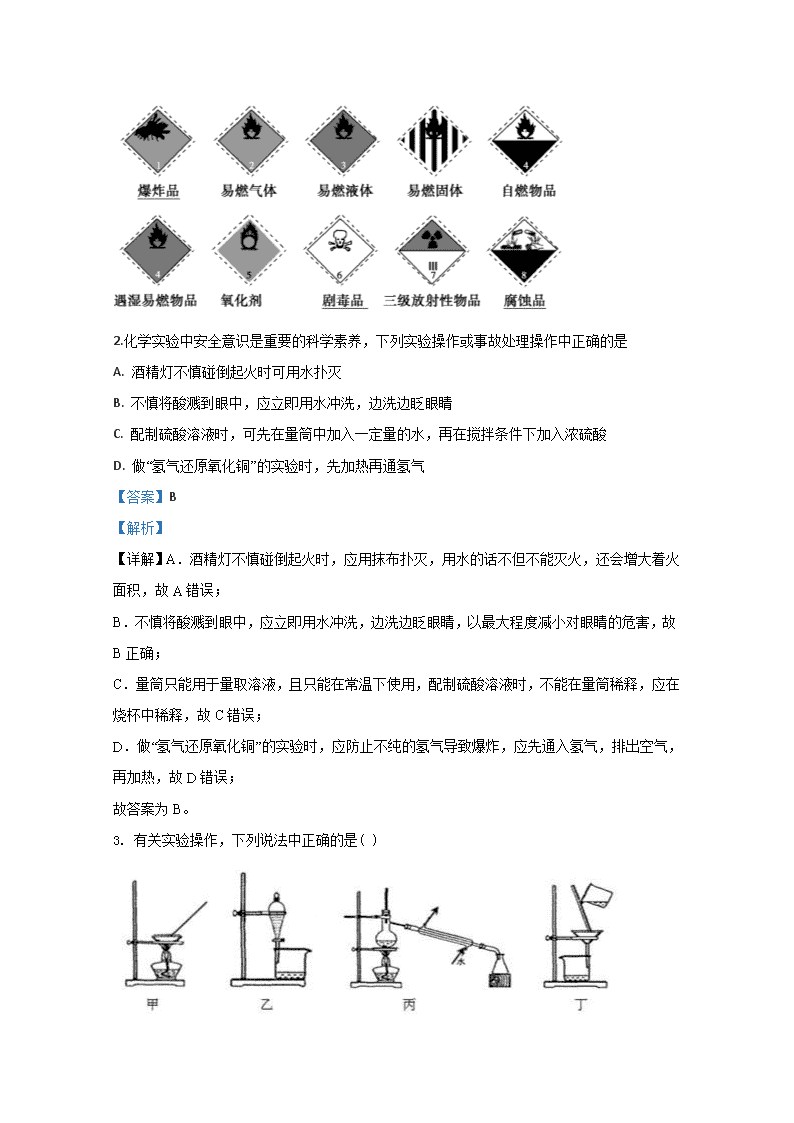
新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一下学期第一次月考化学试题 1.对于易燃易爆、有毒的化学物质,往往会在其包装上贴危险警告标签。下列所列物质中,贴错了标签的是( ) A B C D 物质 浓 (酒精) 汞 危险警告标签 A. A B. B C. C D. D 【答案】D 【解析】 【详解】A. 浓硫酸具有强腐蚀性,贴腐蚀品的标志,A正确; B. (酒精)属于易燃物,贴易燃液体的标签,B正确; C. 汞是剧毒品,贴剧毒品标志,C正确; D. KCl性质稳定,不属于易爆物,该图为爆炸品标志,D错误;故答案为:D。 【点睛】常用危险化学品标志: 2.化学实验中安全意识是重要的科学素养,下列实验操作或事故处理操作中正确的是 A. 酒精灯不慎碰倒起火时可用水扑灭 B. 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 C. 配制硫酸溶液时,可先在量筒中加入一定量的水,再在搅拌条件下加入浓硫酸 D. 做“氢气还原氧化铜”的实验时,先加热再通氢气 【答案】B 【解析】 【详解】A.酒精灯不慎碰倒起火时,应用抹布扑灭,用水的话不但不能灭火,还会增大着火面积,故A错误; B.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛,以最大程度减小对眼睛的危害,故B正确; C.量筒只能用于量取溶液,且只能在常温下使用,配制硫酸溶液时,不能在量筒稀释,应在烧杯中稀释,故C错误; D.做“氢气还原氧化铜”的实验时,应防止不纯的氢气导致爆炸,应先通入氢气,排出空气,再加热,故D错误; 故答案为B。 3. 有关实验操作,下列说法中正确的是( ) A. 甲装置可用于灼烧胆矾,制备无水硫酸铜 B. 乙装置可用于分离溴单质与四氯化碳 C. 丙装置可用于蒸馏,分离乙醇和水 D. 丁装置可用于过滤,分离汽油和水的混合物 【答案】C 【解析】 【详解】A.灼烧胆矾,应选用坩埚,故错误; B.溴易溶于四氯化碳,不能通过分液方法分离,应利用沸点不同采用蒸馏方法,进行分离,故错误; C.利用乙醇和水的沸点不同,进行提纯和分离,故正确; D.汽油和水互不相溶的两种液体,应通过分液方法分离,故错误; 故选C。 4.下列实验操作中正确的是( ) A. 蒸馏操作时,应向蒸馏烧瓶中加入几块碎瓷片,以防止暴沸 B. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 C. 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 D. 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 【答案】A 【解析】 【详解】A. 碎瓷片起防止暴沸作用,所以蒸馏操作时,加入碎瓷片可防止暴沸,A项正确; B. 蒸发时待大量晶体析出时,停止加热,利用蒸发皿余热把剩余的水蒸干,B项错误; C. 分液时,为防止液体污染,分液漏斗中下层液体从下口放出,上层液体从上口倒出,C项错误; D. CCl4与水不互溶;而且溴在CCl4中的溶解度比在水中的大很多,所以可用CCl4作萃取剂。但是酒精与水互溶,不能做萃取剂,D项错误; 答案选A。 【点睛】D项是易错点,萃取剂的选取原则为:与水互不相溶,被萃取的物质在该溶剂中的溶解度比在水中的溶解度大,且跟萃取物不发生化学反应,一般选取四氯化碳、苯或汽油等作为水溶液中溴或碘单质的萃取剂。 5.下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是 ( ) ① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶中转移液体 A. ①和② B. ①和③ C. ③和④ D. ①和④ 【答案】D 【解析】 【详解】① 过滤中玻璃棒的作用为引流; ② 蒸发中玻璃棒的作用为搅拌; ③ 溶解中玻璃棒的作用为搅拌; ④ 向容量瓶中转移液体,玻璃棒的作用为引流。 故选D。 6. 要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们 ( ) A. 溶解、过滤 B. 制成热饱和溶液,降温后再过滤 C. 加热、冷却后蒸发 D. 溶解、过滤后结晶 【答案】B 【解析】 【分析】 考查物质的分离与提纯。氯化钠和硝酸钾都易溶于水,氯化钠的溶解度受温度变化影响不大,硝酸钾的溶解度受温度影响变化大,可根据此项不同性质进行分离。 【详解】A.NaCl与硝酸钾两种物质都溶于水,不能用溶解过滤方法,故错误; B.硝酸钾固体的溶解度随温度的升高明显增大,氯化钠固体的溶解度受温度变化影响较小,如提纯硝酸钾,就要让它成为晶体析出,所以用降温结晶的方法,然后过滤得到硝酸钾,此项正确; C.加热、冷却后蒸发还是得到二者的混合物,不能分离成功,故错误; D.溶解、过滤后结晶,在温度不变的条件下,硝酸钾不能大量析出,故错误; 所以正确的答案选B。 7.有一较浓的无色溶液,向其中加入少量的BaCl2溶液和稀HNO3,振荡,有白色沉淀生成,则原溶液中存在的离子 A 只有SO B. 只有Ag+ C. 有SO和Ag+ D. 有SO或Ag+ 【答案】D 【解析】 【详解】向某溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,白色沉淀可能是硫酸钡或氯化银,如Na2SO4+BaCl2=BaSO4↓+2NaCl;也可能为BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓;故选D。 8.下列叙述错误的是( ) ①摩尔是国际单位制中七个基本物理量之一; ②1mol任何物质都含有约6.02×1023个原子; ③6.02×1023就是阿伏加德罗常数; ④氢原子的摩尔质量是1g; ⑤HCl的摩尔质量等于1molHCl分子的质量; ⑥1molCO2中含有1mol碳和2mol氧。 A. ①②③ B. ②③④ C. ②④⑥ D. 全部 【答案】D 【解析】 【详解】①摩尔是物质的量的单位,物质的量是国际单位制中七个基本的物理量之一,故①错误; ②物质不一定由原子构成,故1mol物质中不一定都含有约6.02×1023个原子,还可能是分子或离子,故②错误; ③12g12C原子数就是阿伏加德罗常数,近似为6.02×1023mol-1,故③错误; ④氢原子的摩尔质量是1 g/mol,故④错误; ⑤摩尔质量与质量意义不同,单位也不相同,质量以g为单位,摩尔质量以g/mol为单位,1 mol物质的质量与该物质的摩尔质量只是在数值上相等,故⑤错误; ⑥1 mol CO2中含有1 mol碳原子和2 mol氧原子,故⑥错误; 答案选D。 9.已知16gA和20gB恰好完全反应生成0.04 molC和31.76gD,则C的摩尔质量为 A 106 B. 53g/mol C. 106g/mol D. 126g/mol 【答案】C 【解析】 【详解】16gA和20gB恰好完全反应生成0.04摩尔C和31.76gD,根据质量守恒知,C的质量为4.24g;M===106g/mol,答案选C。 【点睛】本题应用了质量守恒定律计算出C的质量,需熟练应用物质的量和质量的关系式进行计算。 10.以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关计算正确的是 A. 现有CO、CO2、O3三种气体,分别都含有1molO,则三种气体的物质的量之比为3∶2∶1 B. ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 C. 标准状况下,11.2LX气体分子的质量为16g,则X气体的摩尔质量是32 D. 4℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为 【答案】B 【解析】 【详解】A.CO、CO2、O3三种气体,它们含有的氧原子个数之比为1:2:3,则氧原子的物质的量相同,设都为1mol,则n(CO)=1mol,n(CO2)=mol,n(O3)=mol,则这三种气体的物质的量之比为1: :=6:3:2,故A错误; B.ngCl2的物质的量为mol,所含氯原子数为:×2NA,则有mol×2NA=m,则阿伏加德罗常数NA的数值可表示为,故B正确; C.标准状况下,11.2LX气体的物质的量为=0.5mol,质量为16g,=32g⋅mol−1,摩尔质量的单位是g⋅mol−1,所以X气体的摩尔质量是32g⋅mol−1,故C错误; D.4℃时,1mL水的质量是1g,20滴水恰好为1mL,那么1滴水的质量是0.05g,1滴水中所含的水分子数N=nNA=NA=×NA/mol=,故D错误; 答案选B。 11.在NaCl和NaBr的混合溶液中,Na+、Br—、Cl—的物质的量浓度之比不可能出现的是( ) A. 5:3:2 B. 3:2:2 C. 5:4:1 D. 3:2:1 【答案】B 【解析】 【详解】电解质混合溶液呈电中性,由电荷守恒可知:c(Na+)=c(Br-)+c(Cl-)。 A.Na+、Br-、Cl-的物质的量浓度之比为5:3:2,满足c(Na+)=c(Br-)+c(Cl-),故A不选; B.Na+、Br-、Cl-的物质的量浓度之比为3:2:2,则c(Na+)≠c(Br-)+c(Cl-),故B选; C.Na+、Br-、Cl-的物质的量浓度之比为5:4:1,满足c(Na+)=c(Br-)+c(Cl-),故C不选; D.Na+、Br-、Cl-的物质的量浓度之比为3:2:1,满足c(Na+)=c(Br-)+c(Cl-),故D不选; 故选B。 12.用NA表示阿伏加德罗常数的值,下列叙述正确的是 A. 等体积、等密度的N2和CO原子数不相同 B. 25℃,1.01×105Pa,等质量的O2和O3中所含氧原子数之比为2:3 C. 标准状况下,11.2LH2O含有的原子数为1.5NA D. 常温常压下,44gCO2含有的原子数为3NA 【答案】D 【解析】 【详解】A.等体积、等密度的N2和CO的质量相等,二者摩尔质量相等,所以其物质的量相等,根据N=nNA知,其分子个数相等,N2和CO每个分子中所含原子数相同,则等物质的量的N2和CO原子数相同,故A错误; B.氧气和臭氧均由氧原子构成,故等质量的氧气和臭氧中含有的氧原子的个数相同,故B错误 C.标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误; D.44g二氧化碳的物质的量为1mol,而二氧化碳中含3个原子,故1mol二氧化碳中含3NA个原子,故D正确; 答案选D。 【点睛】D项的常温常压是干扰信息,由于质量与物质是否处于标况下无关,计算时无需在标况下,只有涉及到气体的摩尔体积时,再用到标况。 13.如图两瓶体积相等的气体,在同温、同压下瓶内气体的关系一定正确的是 A. 原子数相等 B. 密度相等 C. 质量相等 D. 摩尔质量相等 【答案】A 【解析】 【详解】根据阿伏伽德罗定律可知,体积相等的气体在同温同压时具有相同物质的量, A.N2、O2、NO都是双原子分子,根据N=nNA可知两瓶内气体具有相同原子数,故A正确; B.两瓶气体的质量不确定,则无法确定两瓶气体的密度是否相等,故B错误; C.氮气和氧气比例不确定,无法判断两瓶气体的质量是否相等,故C错误; D.氮气和氧气的组成不确定,无法计算氮气和氧气的平均摩尔质量,故D错误; 答案选A。 14.用NA表示阿伏加德罗常数的值。下列说法中正确的是 A. 2.4g金属镁变成镁离子时失去的电子数为0.1NA B. 标况下,mg气体A与ng气体B的分子数相同,则A、B两气体的密度之比为n∶m C. 含有NA个氦原子的氦气的体积约为11.2L D. 1.7gOH-中所含的电子数为NA 【答案】D 【解析】 【详解】A.2.4g镁的物质的量为0.1mol,而镁变为镁离子时失去2个电子,故0.1mol镁失去0.2NA个电子,故A错误; B.标准状况下,分子数相同的气体A和B,根据n=可知二者的物质的量相同,依据pV=nRT,n=,可知pM=ρRT,可知同温同压下,A、B两气体的密度之比等于其摩尔质量之比=m:n,故B错误; C.氦气的状态条件未知,不能利用气体摩尔体积计算体积,故C错误; D.一个OH-中含有10个电子,1.7g氢氧根离子的物质的量为0.1mol,含有1mol电子,所含的电子数为NA,故D正确; 答案选D。 15.将5mol·L-1的盐酸10mL稀释到200mL,从中取出10mL的溶液的物质的量浓度是 A. 0.05 mol·L-1 B. 0.25 mol·L-1 C. 0.10 mol·L-1 D. 0.50 mol·L-1 【答案】B 【解析】 【详解】设稀释后盐酸物质量浓度为c,则:10mL×5mol/L=200mL×c,解得c=0.25mol/L,由于溶液是均匀的,所以取出的10ml盐酸的浓度等于稀释后盐酸的浓度为0.25mol/L,答案选B。 16.下列说法中不正确的是 A. 实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g B. 标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L C. 将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1 D. 200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L 【答案】C 【解析】 【详解】A.实验中需2.00mol·L-1的NaCl溶液950mL,需要1000mL容量瓶,则配制时应称取的质量=2.00mol·L-1×1L×58.5g/mol=117.0g,故A正确; B.标准状况下,11.2LHCl气体物质的量为=0.5mol,溶于水配成1L溶液,其浓度==0.5mol/L,故B正确; C.4g氢氧化钠的物质的量为0.1mol,溶于1L水中,溶剂的体积不能代表溶液的体积,所形成溶液浓度不为0.1mol·L-1,故C错误; D.200mLFe2(SO4)3溶液中含Fe3+56g,即Fe3+的物质的量为=1mol,则SO42-的物质的量=×1mol=1.5mol,则溶液中SO42-的物质的量浓度==7.5mol/L,故D正确; 答案选C。 17.下列溶液中的氯离子浓度与50mL1mol·L-1的AlCl3溶液中氯离子浓度相等的是( ) A. 150mL1mol·L-1的NaCl B. 75mL2mol·L-1的NH4Cl C. 150mL3mol·L-1的KCl D. 75mL2mol·L-1的CaCl2 【答案】C 【解析】 【分析】 1mol/L的AlCl3溶液中氯离子浓度为1mol/L×3=3mol/L,结合溶质浓度及物质构成计算离子的浓度,以此来解答。 【详解】A、1mol·L-1的NaCl中氯离子浓度为1mol/L,故A错误; B、2mol·L-1的NH4Cl中氯离子浓度为2mol/L,故B错误; C、3mol·L-1的KCl中氯离子浓度为3mol/L,故C正确; D、2mol·L-1CaCl2中氯离子浓度为2mol/L×2= 4mol/L,故D错误; 故选C。 18.设NA为阿伏加德罗常数,如果a g某气态物质的分子数为p,则b g该气体在标准状况下的体积V(L)是( ) A. B. C. D. 【答案】D 【解析】 【详解】a g某气态物质的分子数为p,则b g该气体分子数为p=,则b g该气体的物质的量为=mol,则标况下b g该气体的体积是mol22. 4L/mol=L,故答案选D。 19.已知单质碘受热易升华(固体变为气体)。可用于分离或提纯物质的方法有A.过滤 B.升华 C.加热分解 D.洗气法 下列各组混合物的分离或提纯应选用上述哪种方法最合适? (1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用____________。 (2)除去O2中少量的水蒸气,用________。 (3)除去固体碘中混有的少量NaI,用________。 (4)除去氧化钙中的CaCO3,用________。 【答案】 (1). A (2). D (3). B (4). C 【解析】 【详解】(1)除去溶液中的固体颗粒,一般用过滤的方法; (2)除去O2中的水蒸气可通过装有浓H2SO4的洗气瓶; (3)单质I2易升华,可用升华法把I2从混合物中分离出来; (4)CaO中的CaCO3可用加热法使CaCO3分解。 20.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。正确的操作顺序是________________(填字母)。 A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.④⑤②①③ 请分别写出本题③、④中所涉及的化学反应方程式:________________________________________ 【答案】 (1). C (2). ③中所涉及的化学反应方程式:HCl+NaOH=NaCl+H2O、2HCl+Na2CO3=2NaCl+H2O+CO2↑;④中所涉及的化学反应方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl 【解析】 【分析】 除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后可除去过量的氯化钡,过滤后加盐酸、蒸发得到NaCl,以此来解答; 【详解】除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后可除去过量的氯化钡,过滤后加盐酸、蒸发得到NaCl,则正确的操作顺序为⑤②④①③或②⑤④①③; ④加过量的碳酸钠溶液,除去Ca2+和Ba2+,相关的化学反应为:Na2CO3+CaCl2=CaCO3↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl;③加适量盐酸,除去过量的NaOH和Na2CO3,相关的化学反应方程式为:HCl+NaOH=NaCl+H2O、2HCl+Na2CO3=2NaCl+H2O+CO2↑。 21.海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验: 请填写下列空白: (1)CCl4是____色、比水____的液体。步骤⑤后静置,下层液体的颜色为______色,上层液体的成分为___________。该步骤所用主要玻璃仪器的名称是__________。 (2)能选用CCl4获取碘的原因是_____________________、___________________、_______ 【答案】 (1). 无色 (2). 密度大 (3). 紫红色(或紫色) (4). MnSO4、K2SO4 (5). 分液漏斗 (6). 有机溶剂CCl4溶解碘的能力大于水 (7). CCl4难溶于水 (8). CCl4与水不反应 【解析】 【分析】 实验室从海带中提取碘:海带灼烧①成海带灰,浸泡②溶解得到海带灰悬浊液,通过过滤③,得到不溶的残渣和含碘离子的滤液,向含碘离子的滤液中加入稀硫酸、氧化剂MnO2④,将碘离子氧化成碘单质,反应为MnO2+2KI+2H2SO4═MnSO4+K2SO4+2H2O+I2,利用有机溶剂CCl4萃取⑤出碘水中碘单质得到碘的四氯化碳溶液,再通过蒸馏⑥提取出碘单质,据此分析解答。 【详解】(1)四氯化碳是一种有机溶剂,是一种无色液体,密度大于水,碘易溶于有机溶剂,从碘水中提取碘可以用有机溶剂萃取然后分液;所以操作⑤为萃取、分液,所用仪器为分液漏斗,碘溶于四氯化碳中,下层液体是紫红色(或紫色),含碘离子的溶液加入二氧化锰和稀硫酸,碘离子被氧化为碘单质,得到含碘水溶液,反应为MnO2+2KI+2H2SO4═MnSO4+K2SO4+2H2O+I2,上层溶液中含有MnSO4和K2SO4; (2)有机溶剂CCl4溶解I2的能力大于水,并且难溶于水,又与水不反应,故可以作CCl4获取碘。 22.某实验需要100mL、1.00mol/L的Na2CO3溶液,现通过如下操作配制: ①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。 ②把①所得溶液冷却到室温后,小心转入A; ③继续加蒸馏水至液面离瓶颈刻度线1~2cm处,改用B小心滴加蒸馏水至溶液凹液面最低点与刻度线相切; ④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入仪器A中,并轻轻摇匀;⑤将仪器A塞紧,充分摇匀。 (1)请书写操作②③所使用的仪器:A:____________、B:___________(填仪器名称) (2)在仪器A上需标记的是___________________________________________ (3)操作步骤正确的顺序是____________________(填序号)。 (4)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为_____________ (5)现用Na2CO3固体配制以上Na2CO3溶液,则需称量Na2CO3___________ g (6)在配制100mL、0.1mol/L的Na2CO3溶液时,下列操作中的________会导致结果偏低(请用序号填写)。 a.用托盘天平称量时砝码放在左盘 b.将烧杯中的溶液转移到仪器A时不慎洒到仪器A外 c.定容时俯视刻度线 d.定容时仰视刻度线 e.干净的仪器A未经干燥就用于配制溶液 【答案】 (1). 100mL容量瓶 (2). 胶头滴管 (3). 温度、容量和刻度线 (4). ①②④③⑤ (5). 10% (6). 10.6g (7). abd 【解析】 【分析】 (1)根据配制溶液时需要的容器回答; (2)根据容量瓶的构造回答; (3)依据配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、洗涤、定容、摇匀、装瓶确定正确的操作步骤排序解答; (4)利用,计算出ω的值; (5)根据m=nM=cVM,计算出m的值; (6)分析操作对溶质的物质的量和溶液体积的影响,依据c=进行误差分析。 【详解】(1)配制100mL、1.00mol/L的Na2CO3溶液是在100mL容量瓶中进行,所以应将溶解冷却后的溶液转移到100mL容量瓶中;定容时,加水到离刻度线1−2cm时,改用胶头滴管逐滴滴加,防止加水过量; (2)容量瓶上标有温度,容量,刻度线; (3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、洗涤、定容、摇匀、装瓶,所以正确的顺序为:①②④③⑤; (4)根据,,密度为1.06g/mL,浓度为1.00mol/L,摩尔质量为106g/mol,=10%; (5)配制100mL、1mol/L的Na2CO3溶液,需要碳酸钠的质量m=1mol/L×0.1L×106g/mol=10.6g; (6)a.用托盘天平称量时砝码放在左盘,会使溶质的质量偏小,物质的量偏小,根据c=可知,溶液浓度偏低,故a符合题意; b.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致溶质的物质的量偏小,溶液浓度偏低,故b符合题意; c.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故c不符合题意; d.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故d符合题意; e.干净的仪器A(容量瓶) 未经干燥就用于配制溶液,由于最后还要定容,对溶液的浓度没有影响,故e不符合题意; 答案选abd。 23.填空 (1)1.7gNH3与标况下_________LH2S中的氢原子数相同 (2)在标准状况(( )℃ 、_____________KPa)下,CO和CO2的混合气体共4.48L,质量为7.2g。则两种气体的物质的量之和为____________mol,该混合气体的平均相对分子质量为___________,其中CO2为___________g. 【答案】 (1). 3.36L (2). 0 (3). 101 (4). 0.2 (5). 36 (6). 4.4 【解析】 【分析】 (1)根据 ,计算出1.7gNH3中氢原子的物质的量,根据计算出V; (2)根据标况的定义回答,根据计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的质量,依据,计算混合气体平均相对分子质量。 【详解】(1)根据,1.7g NH3的物质的量为0.1mol,一个氨分子含有三个氢原子,0.1molNH3含有0.3mol氢原子,一个硫化氢分子含有两个氢原子,0.3mol氢原子与0.15molH2S气体含有的氢原子数相同,根据,即与标准状况下=0.15mol×22.4L/mol=3.36L气体含有的氢原子数相同; (2)标况下指的是0℃、101KPa下,1mol任何气体在标况下的体积都是22.4L;4.48L标况下气体物质的量为,设CO物质的量为x,CO2物质的量为y,则x+y=0.2,28x+44y=7.2,解得x=0.1mol,y=0.1mol,则二氧化碳质量为0.1mol×44g/mol=4.4g,一氧化碳的质量为0.1mol×28g/mol=2.8g,混合气体的总质量为7.2g,混合气体的平均摩尔质量为,所以相对分子质量为36。 【点睛】由于已知CO和CO2的混合气体的总体积,总质量,需要熟练应用物质的量及其相关公式,找到质量和物质的量的关系,列出二元一次方程是解本题的关键 。查看更多