- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版化学平衡图像学案
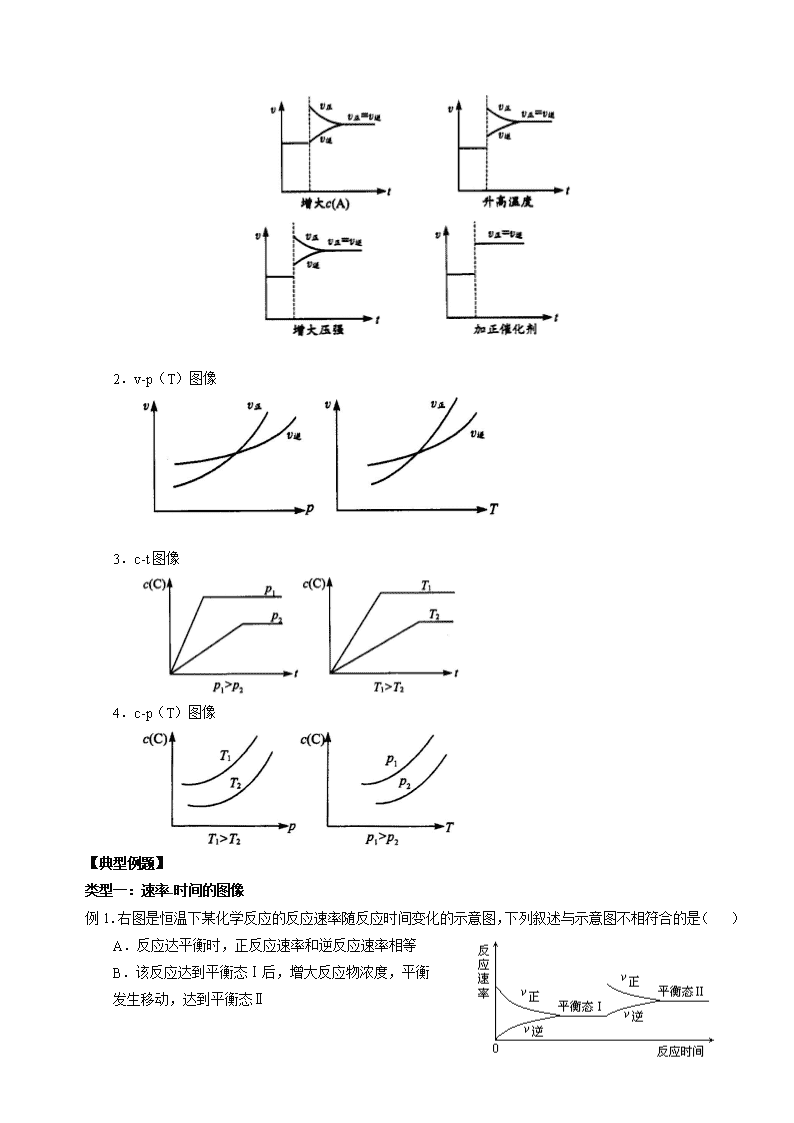
化学平衡图像 【高考展望】 图像题是化学反应速率和化学平衡部分的重要题型。这类题可以全面考查各种条件对化学反应速率和化学平衡的影响,具有很强的灵活性和综合性。该类题型的特点是:图像是题目的主要组成部分,把所要考查的知识寓于坐标曲线上,简明、直观、形象,易于考查学生的观察能力、类比能力和推理能力。当某些外界条件改变时,化学反应速率或有关物质的浓度(或物质的量、百分含量、转化率等)就可能发生变化,反映在图像上,相关的曲线就可能出现渐变(曲线是连续的)或突变(出现"断点")。 解答化学平衡图像题必须抓住化学程式及图像的特点。析图的关键在于对“数”、 “形” 、“义” 、“性”的综合思考,其重点是弄清“四点”(起点、交点、转折点、终点)及各条线段的化学含义,分析曲线的走向,发现图像隐含的条件,找出解题的突破口。 【方法点拨】 一、解答化学平衡图像题的一般方法: 化学平衡图像题,一是以时间为自变量的图像;二是以压强或温度为自变量的图像。从知识载体角度看,其一判断化学平衡特征;其二应用勒夏特列原理分析平衡移动过程;其三逆向思维根据图像判断可逆反应的有关特征;其四综合运用速率与平衡知识进行有关计算。 ①确定横、纵坐标的含义。 ②分析反应的特征:正反应方向是吸热还是放热、气体体积是增大还是减小或不变、有无固体或纯液体物质参与反应等。 ③分清因果,确定始态和终态;必要时可建立中间态以便联系始、终态(等效模型)。 ④关注起点、拐点和终点,分清平台和极值点,比较曲线的斜率,把握曲线的变化趋势,抓住“先拐先平数值大”。 ⑤控制变量:当图像中有三个变量时,先确定一个量不变,再讨论另外两个量之间的关系。 ⑥最后检验结论是否正确。 二、常见化学平衡图像归纳: 例:对于反应mA (g)+nB (g)pC (g)+qD (g),若m+n>p+q且ΔH>0。 1.v-t图像 2.v-p(T)图像 3.c-t图像 4.c-p(T)图像 【典型例题】 类型一:速率-时间的图像 例1.右图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( ) A.反应达平衡时,正反应速率和逆反应速率相等 B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡 发生移动,达到平衡态Ⅱ C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡 发生移动,达到平衡态Ⅱ D.同一反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等 【思路点拨】从图像可看出该反应达到平衡态Ⅰ后v正突然增大,v逆当时不变,而后才增大,应该是增大反应物浓度所致。 【答案】C 【解析】可逆反应达到平衡时,v正=v逆>0,A正确。同一反应物在不同的平衡态下浓度不相等,只有在同一平衡态下浓度才会保持不变,D符合示意图。观察示意图可知,平衡态Ⅰ到平衡态Ⅱ,正反应速率和逆反应速率都增大了,所以绝对不会是减小反应物浓度造成的,C肯定不符合示意图。 【总结升华】化学平衡状态是指在一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。增大浓度,反应速率增大,减小浓度,反应速率减小。 举一反三: 【变式1】对于达平衡的可逆反应X+Y W+Z,增大压强,则正、逆反应速度(v)的变化如图,分析可知X、Y、Z、W的聚集状态可能是( ) A.Z、W为气体,X、Y中之一为气体 B.Z、W中之一为气体,X、Y为非气体 C.X、Y、Z皆为气体,W为非气体 D.X、Y为气体,Z、W中之一为气体 【答案】CD 【解析】由图像知,增大压强,则正、逆反应速度均增大,正反应速率增大较多,则平衡势必向右移动,正反应应是体积减小的反应。 【变式2】右图表示反应N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( ) A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6 【答案】A 【解析】由图可知,该反应从t1时正逆反应速率都增大,并且逆反应速率增加更多,所以平衡逆向移动,氨的百分含量降低;从t3时正逆反应速率都增大,但增大幅度相同,所以平衡不移动,氨的百分含量保持不变;从t4时正逆反应速率都降低,但正反应速率降低更多,平衡仍然是逆向移动,氨的百分含量进一步降低。由上可知,氨的百分含量最高的一段是t0~t1,本题应选A。 类型二:浓度(含量)-时间的图像 例2.汽车尾气中,产生NO的反应为:N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是: A.温度T下,该反应的平衡常数K= B.温度T下,随着反应的进行,混合气体的密度减小 C.曲线b对应的条件改变可能是加入了催化剂 D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 【思路点拨】根据“先拐先平”原则,先拐的到达平衡的时间短,对应的反应速率快,温度高。 【答案】A 【解析】本题考查化学平衡知识。根据平衡常数列式,A正确;B项:温度T下,随着反应的进行,混合气体的密度不变;C项:曲线b对应的条件改变不可能是加入了催化剂,因为催化剂不能使平衡移动;D项:随着温度升高,C(N2)减小,平衡正向移动,正反应吸热。 【总结升华】借助图象考查化学平衡问题,是近年来备受高考青睐的一种命题形式。 解题的主要策略有: ①先根据“先拐先平”原则,判断出曲线对应的温度或压强的大小。“先拐先平”即先拐的说明达到平衡所需的时间短,对应的化学反应速率快,对应的温度或压强大。 ②固定其中的一个因素(温度或压强),然后讨论另一个因素与化学平衡中的参量(百分含量、体积分数、平均相对分子质量)的变化关系,从而判断出该反应为放热反应或吸热反应、反应前后气体体积的大小关系。 举一反三: 【变式1】可逆反应 mA(s) + nB(g) eC(g)+fD(g) ,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和 压强(P)的关系如下图:下列叙述正确的是( ) A.达平衡后,加入催化剂则C%增大 B.达平衡后,若升温,平衡左移 C.化学方程式中 n>e+f D.达平衡后,增加A的量有利于平衡向右移动 【答案】B 【变式2】已知反应2SO2(g)+O2(g) 2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)在不同温度下随时间(t)变化的示意图,Y可以是( ) A.SO2的转化率 B.混合气体的密度 C.密闭容器内的压强 D.O2的体积分数 【答案】A 【变式3】对于密闭容器中的反应:N2(g) + 3H2(g) 2NH3(g),△H <0 。 在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( ) A.点a的正反应速率比点b的大 B.点c处反应达到平衡 C.点d(t1时刻)和点e(t2时刻)处n(N2)不等 D.其它条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 【答案】AD 【变式4】已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是( ) A.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态 B.前10 min内用υ(NO2)表示的化学反应速率为0.06 mol/(L·min) C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L D.图中的两条曲线,X是表示N2O4浓度随时间的变化曲线 【答案】A 类型三:浓度(含量)-压强(温度)的图像 例3.用CO合成甲醇(CH3OH)的化学方程式为: CO(g)+2H2(g) CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系曲线如图所示。下列说法正确的是( ) A.温度:T1>T2>T3 B.正反应速率:v(a)>v(c),v(b)>v(d) C.平衡常数:K(a)>K(c),K(b)=K(d) D.平均摩尔质量:M(a)<M(c),M(b)>M(d) 【答案】C 【解析】选项A,该反应的正反应为放热反应,温度越高,CO的平衡转化率越小,故T3>T2>T1。选项B,温度越高,化学反应速率越大,故v(c)>v(a);压强越大,化学反应速率越大,故v(b)>v(d)。选项C,降低温度,化学平衡向正反应方向移动,化学平衡常数K增大,故有K(a)>K(c);温度不变,K不变,故K(b)=K(d)。选项D,升高温度,化学平衡向逆反应方向移动,即向气体总物质的量增大的方向移动,则M(a)>M(c);增大压强,化学平衡向气体总物质的量减小的方向移动,则M(b)>M(d)。 【总结升华】在其它条件不变的情况下,通过图像分析单一因素对化学平衡的影响。 举一反三: 【变式1】右图是温度和压强对X+Y2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( ) A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态 C.X和Y中只有一种为气态,Z为气态 D.上述反应的逆反应的△H >0 【答案】C 【解析】根据示意图,在压强不变的情况下,随着温度的升高,Z的体积分数增大,即随着温度的升高,平衡向正反应方向移动,所以正反应为吸热反应,△H>0;逆反应为放热反应,△H<0;所以A,D错误。同样,在温度不变的情况下,随着压强的减小,Z的体积分数增大,即随着压强的减小,平衡向正反应方向移动,正反应为气体体积增大的反应,所以C正确。 【变式2】在一定条件下,固定容积的密闭容器中发生如下反应:2NO2(g)O2(g) + 2NO(g) ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( ) A.当X表示温度时,Y表示NO2的物质的量 B.当X表示压强时,Y表示NO2的转化率 C.当X表示反应时间时,Y表示混合气体的密度 D.当X表示NO2的物质的量时,Y表示O2的物质的量 答案:AB 【答案】AB 【解析】若x表示温度,则随温度升高,平衡向正反应方向移动,NO2物质的量减少,A正确; 若x表示压强,则随压强增大,平衡向逆反应方向移动,NO2转化率减小,B正确; 若x表示反应时间,混合气体的密度应保持一条直线不变,C错误; 若x表示NO2的物质的量,则随固定容器中NO2物质的量增加,O2的物质的量也应在一定限度内增加,D错误,故选AB。查看更多