- 2021-08-24 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习化学反应速率和平衡图象的分析突破学案
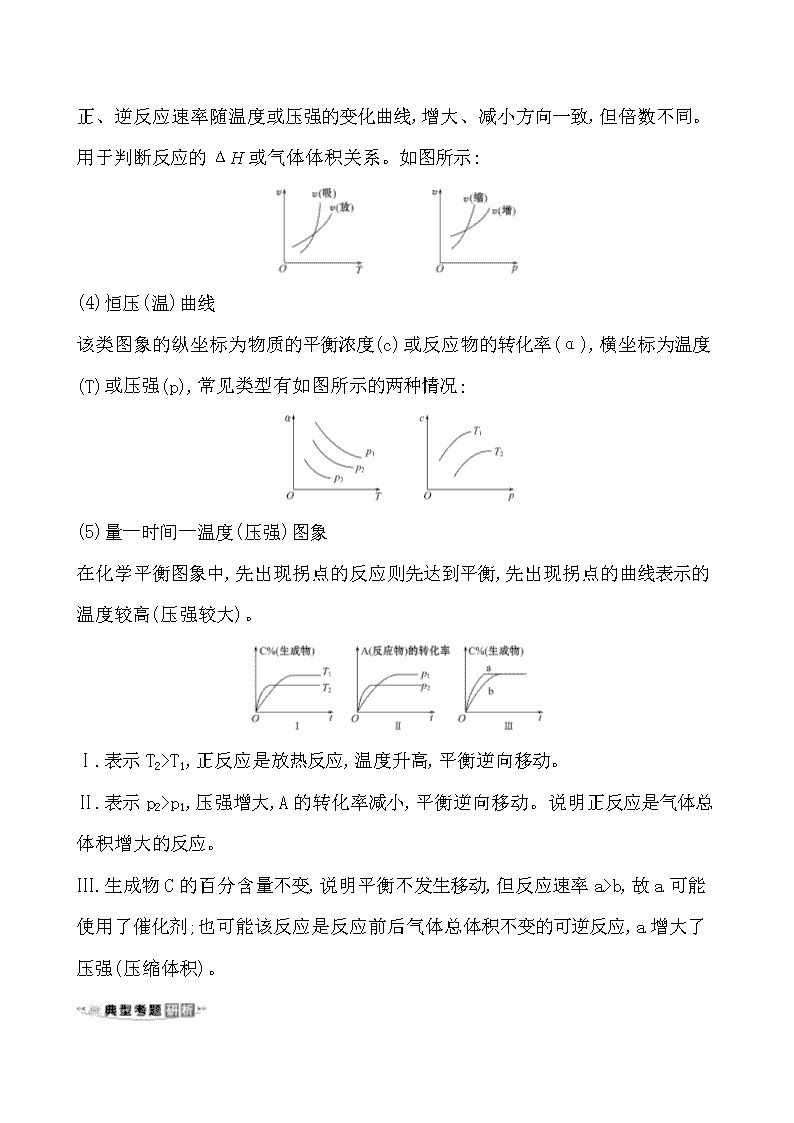
化学反应速率和平衡图象的分析 化学反应速率平衡图象的基本类型 (1)速率-时间图象 此类图象定性揭示了v(正)、v(逆)随时间(含条件改变对化学反应速率的影响)变化规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动方向等。反应N2(g)+3H2(g)2NH3(g) ΔH<0的速率如图所示。 (2)浓度-时间图象(c-t图象) 此类图象能说明各平衡体系组分(或某一成分)的物质的量浓度在反应过程中的变化情况。此类图象中各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的化学计量数关系。如图所示: (3)速率—条件图象(v -T或v -p图象) 正、逆反应速率随温度或压强的变化曲线,增大、减小方向一致,但倍数不同。用于判断反应的ΔH或气体体积关系。如图所示: (4)恒压(温)曲线 该类图象的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型有如图所示的两种情况: (5)量—时间—温度(压强)图象 在化学平衡图象中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(压强较大)。 Ⅰ.表示T2>T1,正反应是放热反应,温度升高,平衡逆向移动。 Ⅱ.表示p2>p1,压强增大,A的转化率减小,平衡逆向移动。说明正反应是气体总体积增大的反应。 Ⅲ.生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a可能使用了催化剂;也可能该反应是反应前后气体总体积不变的可逆反应,a增大了压强(压缩体积)。 【典例】(2019·全国卷Ⅱ改编)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 ( ) ①T1>T2 ②a点的反应速率小于c点的反应速率 ③a点的正反应速率大于b点的逆反应速率 ④b点时二聚体的浓度为0.45 mol·L-1 A.①② B.②④ C.①③ D.③④ 【思维建模】解答速率平衡图象的思维流程一般为 读题明确图象要描述的含义或者考查方程式的特点,了解题目要求解决的问题。 ↓ 看图明确横纵坐标的含义。 ↓ 判断分析曲线变化趋势及其原因,联系相关知识解答问题。 ↓ 结论根据要求选出或写出正确答案。 【解析】选D。由图知虚线对应的速率快,对应温度高,则T2>T1,①错误;由T2(c点)>T1(a点),但环戊二烯的浓度a点大于c点,则a点、c点的速率大小无法确定,②错误;a点、b点的温度相同,环戊二烯的浓度a点大于b点,则a点的正反应速率大于b点的正反应速率,b点没有达到平衡状态,则b点的正反应速率大于b点的逆反应速率,③正确;b点时环戊二烯的浓度减少0.9 mol·L-1,则b点时二聚体的浓度为0.45 mol·L-1,④正确。 1.(2020·沧州模拟)对反应aA(g)+bB(g)cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是 ( ) A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行 B.图乙中,若T2>T1,则ΔH<0且a+b=c+d C.图丙中,t1时刻改变的条件一定是使用了催化剂 D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率 【解析】选C。图甲中压强一定时,温度越高,平衡体系中A%越大,说明升高温度,平衡逆向移动,则有ΔH<0;若p1>p2,温度一定时,压强越大,平衡体系中A%越小,则有a+b>c+d,ΔS<0;若使ΔH-TΔS<0,则在较低温度下有利于该反应自发进行,A正确。图乙中温度一定时,增大压强,A的平衡转化率不变,则有a+b=c+d; 压强一定时,若T2>T1,温度越高,A的平衡转化率越小,说明升高温度,平衡逆向移动,则有ΔH<0,B正确。图丙中t1时刻,改变条件后v(正)、v(逆)同等程度地改变,平衡不移动,则改变的条件可能是使用了催化剂,若a+b=c+d改变的条件也可能是增大了压强,C错误。图丁中温度为T1时先达到平衡状态,则温度:T1>T2,若ΔH<0,升高温度,平衡逆向移动,反应物的转化率降低,故纵坐标不可能表示的是反应物的转化率,D正确。 2.(2020·乌鲁木齐模拟)合成乙烯的主要反应:6H2(g)+2CO2(g)CH2CH2(g) +4H2O(g) ΔH<0。图中L(L1、L2)、x可分别代表压强或温度。下列说法正确的是 ( ) A.L1查看更多
相关文章
- 当前文档收益归属上传用户