- 2021-08-24 发布 |
- 37.5 KB |
- 37页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学高考必背知识点汇总
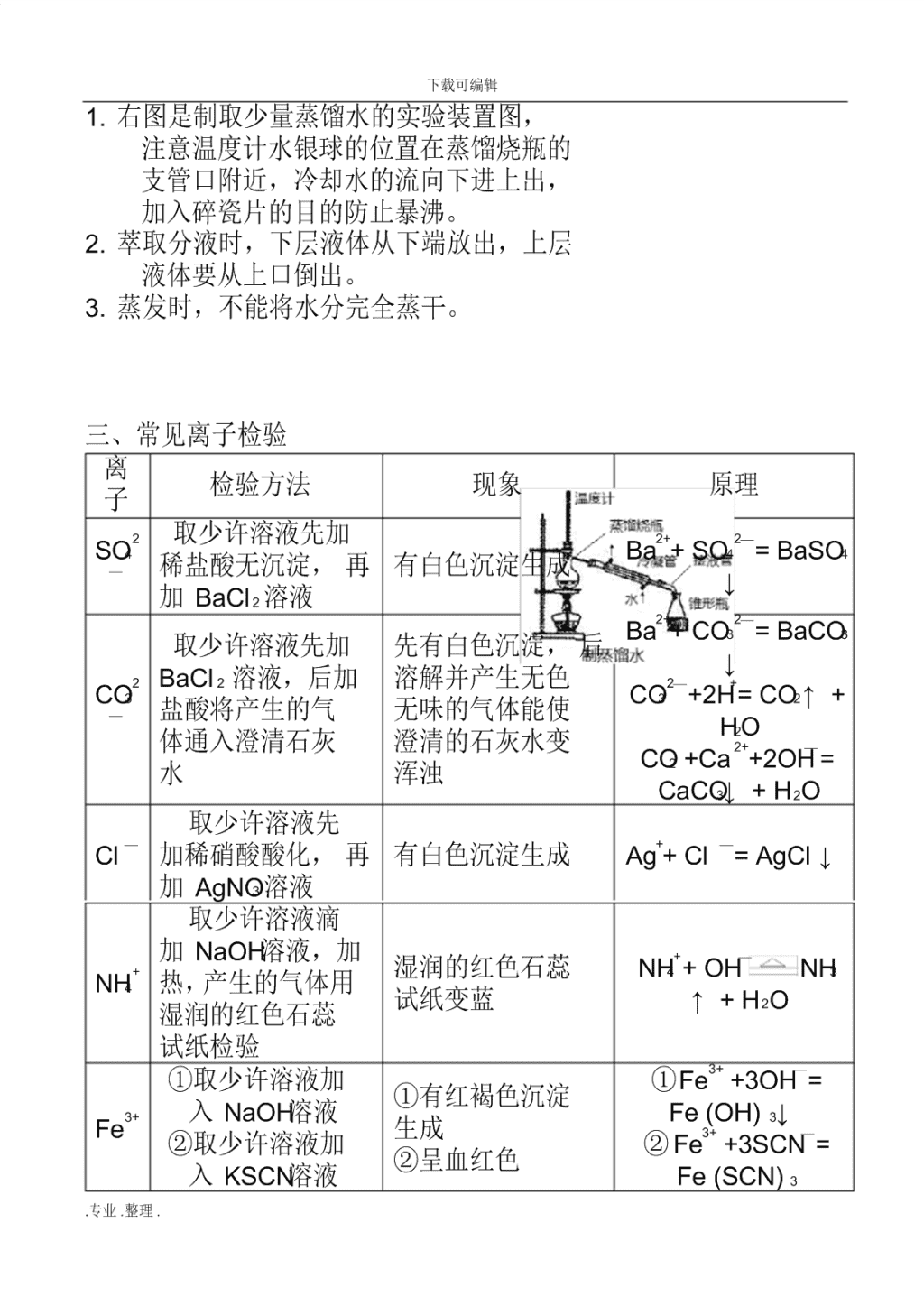
下载可编辑 .专业 .整理 . 必修一 化学实验基础知识 一、 化学实验安全: 1、 实验安全常识: (1)酒精、煤油等有机物燃烧、小面积失火,应迅速用湿布 或沙土盖灭;钠着火应用沙土盖灭,切不可用水或 CO2。 (2)使用、制备有毒气体时,宜在通风橱中或密闭系统中进 行,外加尾气吸收处理装置。 2、 实验安全操作: (1)防爆炸:点燃可燃性气体(如 H2、CO、CH4 等)或用 H2、 CO还原 CuO、Fe2O3 之前,要检验气体的纯度。 (2)防暴沸:蒸馏(加沸石或碎瓷片) 。 (3)防中毒:制取有毒气体(如 Cl 2、CO)时,应在通风橱中 进行。 (4)防倒吸:加热法制取并用排水法收集气体或吸收溶解度 较大气体时,要加装安全瓶等装置。 二、混合物的分离与提纯 方 法 适用范围 主要仪器 举例 过 滤 从固液混合物中 分 离 出 不 溶 的 固 体物质的方法 漏斗、烧杯、玻璃棒 除去 NaCl 溶 液中的泥沙 蒸 发 从 溶 液 中 提 纯 出 溶质的方法 蒸发皿、酒精灯、玻 璃棒 海水晒盐 蒸 馏 适 用 于 分 离 互 溶 但 沸 点 不 同 的 液态混合物 酒精灯、温度计、蒸 馏烧瓶、冷凝管、接 液管、锥形瓶 自来水制取 蒸馏水 分 液 适 用 于 分 离 互 不 相 溶 的 液 态 混 合物 分液漏斗、烧杯 CCl4 与水的混 合物 萃 取 溶质在互不相溶 的 溶 剂 中 溶 解 度 有较大的差异 分液漏斗、烧杯 用 CCl4 提 取 碘水中的碘、 溴 水 中 提 取 溴 下载可编辑 .专业 .整理 . 1. 右图是制取少量蒸馏水的实验装置图, 注意温度计水银球的位置在蒸馏烧瓶的 支管口附近,冷却水的流向下进上出, 加入碎瓷片的目的防止暴沸。 2. 萃取分液时,下层液体从下端放出,上层 液体要从上口倒出。 3. 蒸发时,不能将水分完全蒸干。 三、常见离子检验 离 子 检验方法 现象 原理 SO4 2 — 取少许溶液先加 稀盐酸无沉淀, 再 加 BaCl 2 溶液 有白色沉淀生成 Ba2++ SO4 2—= BaSO4 ↓ CO3 2 — 取少许溶液先加 BaCl 2 溶液,后加 盐酸将产生的气 体通入澄清石灰 水 先有白色沉淀, 后 溶解并产生无色 无味的气体能使 澄清的石灰水变 浑浊 Ba2++ CO3 2—= BaCO3 ↓ CO3 2—+2H+= CO2↑+ H2O CO2 +Ca 2++2OH— = CaCO3↓+ H2O Cl — 取少许溶液先 加稀硝酸酸化, 再 加 AgNO3 溶液 有白色沉淀生成 Ag++ Cl —= AgCl ↓ NH4 + 取少许溶液滴 加 NaOH溶液,加 热,产生的气体用 湿润的红色石蕊 试纸检验 湿润的红色石蕊 试纸变蓝 NH4 ++ OH— NH3 ↑+ H2O Fe3+ ①取少许溶液加 入 NaOH溶液 ②取少许溶液加 入 KSCN溶液 ①有红褐色沉淀 生成 ②呈血红色 ①Fe3+ +3OH—= Fe (OH) 3↓ ② Fe3+ +3SCN—= Fe (SCN) 3 下载可编辑 .专业 .整理 . Na+ 用铂丝蘸取钠盐 或其溶液做焰色 反应 火焰颜色呈黄色 K+ 用铂丝蘸取钾盐 或其溶液做焰色 反应 透过蓝色钴玻璃 看到紫色 焰色反应:金属或它们的化合物在灼烧时会使火焰呈现特殊 的颜色的现象(焰色反应是元素的性质) 。 步骤:洗(用稀盐酸洗) 、烧、蘸、烧、观。 钠的焰色反应:黄色;钾的焰色反应:紫色(透过蓝色钴玻 璃);焰色反应不一定发生化学变化。 主题 2 基本概念 一、物质的量 1、物质的量 (1) 是一个物理量,表示一定数目微观粒子的集合体。符号: n 单位:摩尔符号: mol (2) 使用该单位时 , 应指明对象 , 它的对象是分子、原子、离子、 质子、中子、电子等。 2、阿伏加德罗常数 (1) 是一个物理量,把 6.02 ×1023mol -1 叫阿伏加德罗常数。符 号: NA;单位: mol-1 (2)1mol 任何物质所含的粒子数约为 6.02 ×1023 个 (3) 粒子数、阿伏加德罗常数、物质的量的关系: n=N/NA 3、摩尔质量 (1) 是一个物理量,表示单位物质的量的物质所具有的质量。 符号: M 单位: g/ mol 摩尔质量在数值上等于该物质的相对 原子质量或相对分子质量。 (2) 质量、摩尔质量、物质的量的关系: n = m / M 4、气体摩尔体积 (1) 决定物质体积大小的因素 : ①粒子数目②粒子的大小③粒 子之间的距离 (2) 当微粒的数目一定时:固体、液体体积主要决定于粒子本 身的大小;气体的体积主要决定于粒子间的距离,而粒子间 下载可编辑 .专业 .整理 . 的距离又决定于温度和压强。 (3) 气体摩尔体积定义:单位物质的量的气体所占有的体积。 符号: Vm 单位: L/ mol 标准状况下, Vm约为 22.4L/mol 。 (4) 气体体积、气体摩尔体积、物质的量的关系: n=V/Vm 5、阿伏加德罗定律 (1) 同温同压下,相同体积的任何气体所含的分子数相同 ( 有 “三同”必推出另一“同” ) 。 二、物质的量在化学实验中的应用 1、物质的量浓度 单位体积溶液中所含溶质 B 的物质的量。符号: CB 单位: moI/L ; 物质的量浓度与溶液体积、物质的量的关系: CB= 2、物质的量浓度的配制 配制前要检查容量瓶是否漏水 (1)主要仪器:托盘天平、量筒、烧杯、玻璃棒、容量瓶(一 定规格) 、胶头滴管 (2)步骤: ①计算 m=c· v · M ②称量 ③溶解 (冷却) ④转移(洗涤 2— 3 次,并将洗涤液转入容量瓶)和洗涤 ⑤ 定容 ⑥摇匀 ⑦装瓶贴签 注意: 1) 在配制之前要检查容量瓶是否漏液; 2) 定容操作要点: 加水距刻度线 1-2cm 处,改用胶头滴管逐滴加入蒸馏水至凹液 面与刻度线相切。 (3) 要学会误差分析: a. 定容时,俯视刻度线,则所配溶液 浓度偏高; b. 容量瓶洗涤后,残留有少量蒸馏水,则所配溶 液浓度无影响; c. 转移过程中有溶液洒落在容量瓶外,则所 配溶液浓度偏低。 3、溶液稀释的计算 稀释前后溶质的质量或物质的量不变。 c (浓) ·V(浓) = c (稀) ·V(稀) 三、物质的量在化学方程式中的应用 化学方程式中各物质的化学计量数之比等于各物质的物 质的量之比; 下载可编辑 .专业 .整理 . 2Na+2H2O=2NaOH+H2↑,表示 2molNa 与 2molH2O完全反应, 生成 2molNaOH和 1molH2. 四、 关于阿伏加德罗常数说的常见错误, 设 NA 为阿伏加德罗常 数的值 1、常温、 常压下, 1.06 g Na2CO3 含有的 Na+数为 0.01N A 应 为 0.02N A,明确化学式中各粒子间关系 2、标准状况下, 22.4L 水的质量约为 18g;22.4L 适用于标准 状况下的气体,而水不是气体 3、3.2g 氧气与钠燃烧完全反应转移的电子数为 0.4N A 应为 0.2N A 电子,根据反应产物确定转移电子数 4、0.5 moI/L 的 MgCI2 溶液中,含有 CI — 个数为 1NA 当溶液 体积为 1L 时 5、常温、 常压下, 1mol 氖气含有原子数为 2NA 氖气为单原子 分子,记住常见气体的化学式,如 Cl 2、O3(臭氧)等 6、18g NH 4 +中所含电子数为 11NA 应为 10NA,明确各粒 子数计算方法 7、常温、 常压下, 22.4L 的氢气的分子数为 1N A 22.4L 适用 处于标准状况下的气体 注意:涉及需用 22.4L/mol 时,要先看条件:是否标准状况 (0℃,101kPa );再看状态:是否是气体。 五、物质的分类 1、分类法 常用的分类方法:交叉分类法和树状分类法 混合物 如:空气、氯水、氨水等 氧化物 ( 酸性氧 化物、碱性氧化物、两性氧化物 ) 物质 化合物 无机化合物 酸、碱、盐 纯净物 有机化合物 如乙醇、 CCl4 等 单质 金属 非金属 2、分散系及其分类 ⑴分散系:把一种(或多种)物质分散在另一种(或多种) 物质中所得到的体系。 ⑵常见分散系(分散剂是水或其他液体)比较: 分散系 溶液 胶体 浊液 下载可编辑 .专业 .整理 . ① 常 见 的 胶 体: Fe(OH)3胶体、 豆浆、烟、云、雾等; ②胶体与其他分散系的本质区别是:分散质粒子的直径在 1nm~100nm之间; ③区分胶体和溶液的方法:丁达尔效应。 3、下列化学式与指定物质的主要成分对应关系为 CH 4 — — 天 然 气 CO 和 H2 — — 水 煤 气 CaSO4·2H2O——石膏粉 NaHCO3——小苏打粉 Na 2CO3——纯碱、苏打粉 CaCO 3 ——石灰石、大理石 NH4HCO3——碳铵 CaO ——生石灰 Ca(OH) 2——熟 石灰、消石灰 NaOH——烧碱、火碱、苛性钠 FeSO 4 ·7H2O——绿矾 CO2——干冰 KAl(SO 4) 2·12H2O——明矾 Ca(ClO) 2 和 CaCl2——漂白粉 CuSO4·5H2O——胆矾、蓝矾 H2O2——双氧水 SiO 2——石英、水晶 Na 2SiO3 溶液—— 水玻璃 Fe 2O3——铁红、赤铁矿 Fe3O4——磁铁矿 Al 和 Fe2O3——铝热剂 六、物质的变化 (一)物质变化的分类 1、四种基本反应类型 :化合反应 分解反应 置换 反应 复分解反应 2、四种基本反应类型与氧化还原反应的关系: ⑴置换反应一定是氧化还原反应。如: 2Na+2H2O=2NaOH+H2 ↑ Cl 2+2KBr= 2KCl+Br 2 ⑵ 复 分 解 反 应 一 定 不 是 氧 化 还 原 反 应 。 如 : Al 2(SO4) 3+6NH3·H2O==2Al(OH) 3↓+3(NH4) 2SO4 ⑶化合反应、分解反应可能是氧化还原反应。 如 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Fe+2O 2 Fe3O4 既是化合反 应又是氧化还原反应; SO2+H2O H2SO3 Na 2O+H2O= 2NaOH是化合反应而不是氧化 还原反应。 分散质粒 子直径 <1nm 1~100nm > 100nm 能否透过 滤纸 能 能 不能 稳定性 稳定 较稳定 ( 介稳 ) 不稳定 下载可编辑 .专业 .整理 . 2KMnO4 K2MnO4+MnO2+O2 ↑ 既是分解反应又是氧化还原反 应; 2Fe(OH)3 Fe2O3+3H2O 是分解反应但不是氧化还原反应。 (二)离子反应 1、酸、碱、盐的概念 ⑴酸:电离时生成的阳离子全部是 H+的化合物。如: H2SO4、 HCl、HNO3、H2CO3、CH3COOH等。 ⑵碱:电离时生成的阴离子全部是 OH- 的化合物。如: Ba(OH)2、KOH、NH3·H2O等。 ⑶盐:能电离出金属离子 ( 或铵根离子 ) 和酸根离子的化合 物。如: KCl、Na2SO4、CaCl 2、NH4Cl 等。 2、离子反应 ⑴定义:在水溶液中有离子参加的一类反应。 ⑵离子反应发生的条件: a、有沉淀生成; b、有气体生成; c、有水、弱酸、弱碱生成。 3、离子方程式 ⑴定义:用实际参加反应离子符号表示反应的方程式 ⑵书写步骤: “写 ( 写化学方程式 ) 、拆 ( 把强酸、强碱及易溶 盐拆写成离子 ) 、删 ( 删去方程式两边不参加反应的离子及 化学计量数约简为最简 ) 、查 ( 检查离子方程式两边各元素 的原子个数和电荷数是否相等 ) 。” ⑶意义:不仅可以表示某一定物质间的具体反应,还可以 表示所有同一类型的离子反应。 4、离子方程式书写应注意的问题 (1) 在离子反应里,把强酸、强碱、可溶盐拆写成离子符号, 其它物质一般都保留其化学式,不能拆写。 强酸:盐酸 (HCl) 、硝酸 (HNO3) 、硫酸 (H2SO4) 强碱: NaOH KOH Ba(OH) 2 Ca(OH) 2 可溶盐: 氯化物:除 AgCl 外; 硝酸盐:所有; 硫酸盐:除 BaSO4 外 碳酸盐: Na2CO3 K 2CO3 (NH 4) 2CO3 碳酸氢盐:所有 ( 如 NaHCO3 KHCO 3) (2) 检查离子方程式, 方程式两边电荷总数和原子总数是否 相等。 下载可编辑 .专业 .整理 . 5、离子共存:在溶液中,如有两种离子若能发生反应则这两 种离子不能共存于同一溶液。 ⑴有沉淀生成,如 Ba2+和 SO4 2- 、Ag+和 Cl - 、Fe3+和 OH- 等因生 成沉淀而不能大量共存 ⑵有气体生成, 如 CO3 2- 、HCO3 - 与 H+因生成气体而不能大量共 存 ⑶因生成水或弱酸或弱碱,如 H+与 OH- 因生成水、 NH4 +与 OH- 因生成一水合氨而不能大量共存。 ⑷隐含条件时常见情况: ①“无色溶液”中不能存在有色离子如: Fe3+、Fe2+、Cu2+、 MnO4 - 等。 ②“酸性溶液”中隐含该溶液中存在大量的 H+即:能与 H+ 反应的离子不能大量共存, 如 OH- 、HCO3 - 、CO3 2- 等 ③“碱性溶液”中隐含该溶液中存在大量的 OH- 即能与 OH- 反应的离子不能大量共存, 如 H+、NH4 +、Fe3+、Al 3+等。 6、常见离子反应 ⑴ 铝 与 氢 氧 化 钠 溶 液 反 应 2Al+2OH- +2H2O=2AlO2 - +3H2↑ ⑵金属钠与水反应 2Na+2H 2O=2Na++2OH- +H2↑ ⑶ 氧 化 铁 溶 于 盐 酸 中 Fe2O3+6H+=2Fe3++3H2O ⑷ 氯 化 亚 铁 加 入 氯 水 中 2Fe2++Cl 2=2Fe3++2Cl - ⑸氯化铁溶液中加入铁粉 2Fe 3++Fe=3Fe2+ ⑹氯化铁溶液中加入铜粉 2Fe 3++Cu=2Fe2++Cu2+ ⑦氯气通入氢氧化钠溶液中 2OH —+Cl 2=Cl —+ClO— +H2O (三)氧化还原反应 1、常见元素的价态: H、Na、K、Ag +1 价 Ca 、Mg、Ba、 Zn +2 价 下载可编辑 .专业 .整理 . Al +3 价 Fe +2 、 +3 价。 Cl -1 、+1 价, C +2、+4 价, NO3 - 、HCO3 - -1 价, CO3 2- 、 SO4 2- -2 价。 2、氧化还原反应的特征 ( 判断依据 ) :反应前后有化合价升降。 3、氧化还原反应的本质:有电子的转移 ( 得失或偏移 ) 4、基本概念及关系: 升 ( 化合价 )-- 失( 电子 )-- 氧 ( 氧化反应 )-- 还 ( 还原剂 ) 降( 化合价 )-- 得( 电子 )-- 还 ( 还原反应 )-- 氧 ( 氧化剂 ) 5、表示方法:双线桥和单线桥法 6 、 常 见 氧 化 还 原 反 应 : Cl 2 + H2O HCl+HClO 2Ca(OH)2+2Cl 2== CaCl 2+ Ca(ClO) 2+2H2O 2NaOH+Cl2=NaCl+NaClO+H2O 2Fe+3Cl 2 2FeCl 3 主题 3 金属及其化合物 一、金属钠及其重要化合物: 1、金属钠的单质: (1) 与非金属反应; 2Na+Cl2 2NaCl ; 4Na+O2=2Na2O(白色粉末 ) , 2Na+O2 Na2O2 (黄色火焰,生成淡黄色固体) ; (2) 与 H2O反应: 2Na+2H2O=2NaOH+H2↑ 现象: 浮在水面上——密度小于水; 熔化成小球— —钠的熔点低,反应为放热反应; 游、嘶——有气体生成; 滴有酚酞的水溶液变红— —有碱生成 (3) 与盐溶液的反应:钠先与水反应,生成的 NaOH再与盐溶液 反应,如: Na 投入 CuSO4 溶液中产生蓝 下载可编辑 .专业 .整理 . 色沉淀,不能置换出金属铜。 (4) 注意:少量金属钠应保存在煤油中;用镊子取用,用滤纸 吸干表面的煤油,用小刀切割,剩余的 钠放回原试 剂瓶。 (5) 主要用途:制过氧化钠,制稀有金属,钠钾合金作原子能 反应堆导热剂,制高压钠灯用于道路的照明。 (6) 工业制法:电解熔融的 NaCl; 2、钠的氧化物: Na2O+H2O=2NaOH Na2O+2HCl=2NaCl+H2O 2Na 2O2+2H2O=4NaOH+O2↑ 2Na 2O2+2CO2=2Na2CO3+O2 Na 2O2 用作供氧剂、漂白剂。 3、碳酸钠与碳酸氢钠:碳酸钠( Na2CO3,俗名:纯碱或苏打) 、 碳酸氢钠( NaHCO3,俗名小苏打) (1) 物理性质:碳酸钠,白色易溶于水的粉末;碳酸氢钠,白 色溶于水的细小晶体。它们的水溶液都呈碱 性, NaHCO3 可作为食用碱。在相同条件下,碳酸钠 溶解度>碳酸氢钠溶解度 (2) 化学性质: 2NaHCO 3 Na2CO3+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑ HCO3 - +H+=CO2↑+H2O Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ CO3 2- +2H+=CO2↑+H2O Na2CO3+ Ca(OH)2= CaCO3 ↓ +2NaOH CO3 2- +Ca2+=CaCO3↓( 白色 ) Na2CO3+BaCl2=2NaCl+BaCO3 ↓ CO3 2- +Ba2+=BaCO3↓( 白色 ) Na2CO3+ CaCl2=2NaCl+CaCO3 ↓ CO3 2- +Ca2+=CaCO3↓( 白色 ) NaHCO 3 溶液也能与石灰水反应生成 CaCO3 白色沉淀。 (3) Na 2CO3 与 NaHCO3 相互转化 a. 碳酸氢钠固体加热: 2NaHCO 3 Na2CO3+H2O+CO2↑ 下载可编辑 .专业 .整理 . b. 碳酸钠溶液中通入 CO2: Na 2CO3+CO2+H2O=2NaHCO3 (4) 鉴别 Na2CO3、NaHCO3 的方法: a 、分别取少量试样于两支试管中,加水配成等体积 溶液,分别滴加酚酞,颜色较红的为 Na2CO3; b、分别取少量试样于两支试管中,分别加热,产物能使 澄清石灰水变浑浊的为 NaHCO3; c、分别取少量试样于两支试管中,加水配成溶液,分别 滴加 BaCl2 或 CaCl2 溶液, 有白色沉淀产生的为 Na2CO3。 ( 不能用石灰水来区分 ) 二、金属铝及其重要化合物 1、金属铝的单质: 铝是地壳中含量最多的金属元素, 在自然界以化合态形式 存在,银白色金属,密度较小。 (2) 化学性质: a. 与氧气反应: 4Al+3O2 2Al 2O3 ( 铝片耐腐蚀,原因是铝片与空气中氧气反应在表面形成 致密的氧化物薄膜 ) b. 与盐酸反应 2Al+6HCl=2AlCl 3+3H2↑,2Al+6H +=2Al 3++3H2 ↑; c. 遇浓硫酸、浓硝酸发生金属钝化,在表面形成致密的氧化 物薄膜,阻止反应继续进行。 d. 与 碱 溶 液 反 应 2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ , 2Al+2OH- +2H2O=2AlO2 - +3H2↑ e. 铝热反应 (3) 制法与用途: 作电导线,制 铝合金。 2、Al 2O3 和 Al(OH) 3 氧化铝 (Al 2O3) :两性氧化物,熔点高(耐火材料) ,难溶 于水, 两 性 氧 化 物 : Al 2O3+6HCl=2AlCl 3+3H2O Al 2O3+6H+=2Al 3++3H2O Al 2O3+2NaOH=2NaAlO2+H2O Al 2O3+2OH- ==2AlO2 - +H2O 下载可编辑 .专业 .整理 . Al(OH) 3 受热分解: 2Al(OH) 3 Al 2O3+3H2O Al(OH) 3 的 两 性 : Al(OH) 3+3HCl=AlCl 3+3H2O Al(OH) 3+3H+=Al 3++3H2O Al(OH) 3+NaOH=NaAlO2+2H2O Al(OH) 3+OH- =AlO2 - +2H2O 三、金属铁、铜及其重要氧化物: 1、铁和铜的单质 (1) 物理性质: 铁—银白色金属,硬度大,密度大;铜—紫 红色金属,良好的导电性。 (2) 金属铁、铜的化学性质: 1) 铁在纯氧中点燃 3Fe+2O 2 Fe3O4 2) 铁 在 高 温 条 件 下 与 水 蒸 气 反 应 3Fe+4H2O(g) Fe3O4+4H2 3) 铁与稀硫酸反应 Fe+H2SO4=FeSO4+H2↑, Fe+2H +=Fe2++H2↑ 常温下铁遇浓硫酸、浓硝酸会发生金属钝化 4) 铁与盐溶液反应 Fe+CuSO4=FeSO4+Cu Fe+Cu 2+=Fe2++Cu Fe+2FeCl 3 = 3FeCl 2 Fe+2Fe 3+=3Fe2+ 5) 铜与非金属单质反应 2、铁和铜的氧化物 氧化亚铁 (FeO) :碱性氧化物,黑色粉末;氧化铜 (CuO):黑 色粉末,不溶于水。 氧化铁 (Fe 2O3) :碱性氧化物,红棕色粉末,俗称铁红,红色 油漆、涂料,是赤铁矿的主要成分; 四氧化三铁 (Fe 3O4) :有磁性的黑色晶体,俗称磁性氧化铁, 是磁铁矿的主要成分; 铁的氧化物都不溶于水,不与水反应,都能溶于酸且与酸 反应。 FeO+H 2SO4=FeSO4+H2O FeO+2H+=Fe2++H2O Fe2O3+6HCl=2FeCl 3+3H2O Fe2O3+6H+=2Fe3++3H2O 下载可编辑 .专业 .整理 . CuO+H2SO4=CuSO4+H2O CuO+2H+=Cu2++H2O 3、金属铁和铜的氢氧化物: (1) 制备: Fe(OH)2 ( 白色不溶于水 ) 、 Fe(OH)3 ( 红褐色固体不溶于 水) 、Cu(OH)2 ( 蓝色固体不溶于水 ) Fe2++2OH- =Fe(OH)2↓, Fe 3++3OH- =Fe(OH)3↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3(灰白色迅速变成灰绿色,最 后变成红褐色) CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 (2) 化学性质: (1) 不 溶 性 碱 受 热 分 解 : 2Fe(OH)3 Fe2O3+3H2O Cu(OH)2 CuO+H2O (2) 与 酸 反 应 : Fe(OH)2+2HCl=FeCl 2+2H2O Fe(OH)2+2H+=Fe2++2H2O Fe(OH) 3+3HCl=FeCl 3+3H2O Fe(OH)3+3H+=Fe3++3H2O 2Fe(OH)3+3H2SO4==Fe2(SO4) 3+3H2O Cu(OH)2+2HCl=CuCl2+2H2O 4、铁盐和铜盐: (1) Fe 2+、Fe3+的鉴别: 方法 Fe2+ Fe3+ 溶液颜色 浅绿色 黄色 滴加 NaOH溶 液 生成灰白色沉淀, 迅速变成灰绿色, 最后变成红褐色 生成红褐色沉 淀 滴加硫氰化钾 溶液( KSCN) 溶液颜色无明显 变化 溶液颜色变红 (Fe3+的特征反 应) (2) Fe 2+、Fe3+的转化: (1) Fe 2+转化为 Fe3+,需通入氯气或滴加氯水 2FeCl 2+Cl 2=2FeCl 3,2Fe2++Cl 2=2Fe3++2Cl - ; (2) Fe 3+转化为 Fe2+,需加入铁粉或铜粉 2FeCl 3+Fe=3FeCl2, 2Fe 3++Fe=3Fe2+; 下载可编辑 .专业 .整理 . 2FeCl 3+Cu=2FeCl2+CuCl2, 2Fe 3++Cu=2Fe2++Cu2+ 四、合金:由一种金属跟其他一种或几种金属 ( 或非金属 ) 一起 熔合而成的具有金属特性的物质(混合物) 。 合金的优良性能:合金的硬度一般比它的各成分金属的大; 多数合金的熔点一般比各成分金属的低。 主题 4 非金属及其化合物 一、 氯气及含氯化合物 1、氯气 (1) 物理性质:黄绿色、有刺激性气味、能溶于水、密度比 空气大、易液化的有毒气体。 (2) 化学性质:氯气具有强氧化性, a. 能跟金属(如 Na、 Fe、 Cu 等): 2Na + Cl 2 2NaCl 2Fe+3Cl 2 2FeCl 3 Cu + Cl 2 CuCl 2 b. 和非金属 ( 如 H2) 反应: H2 + Cl 2 2HCl 将 HCl 溶于水, 就得到盐酸。 c. 和水的反应: Cl 2 + H2O HCl+HClO ( 氯气溶于水得氯水, 部分氯气与水发生了反应 ) d. 与碱的反应: 2NaOH+Cl2=NaCl+NaClO+H2O(2OH—+Cl 2=Cl — +ClO—+H2O)(用于多余氯气的吸收) “84”消毒液 ( 漂白液 ) 的有效成分是 NaClO 漂白粉制取原理的反应方程式是 2Ca(OH)2+2Cl 2== CaCl 2+ Ca(ClO) 2+ 2H 2O, (此处用石灰乳,而不能用石灰水) 漂白粉的成分是 CaCl2、Ca(ClO) 2,有效成分是 Ca(ClO) 2。 漂粉精露置于空气中变质的化学反应方程式: Ca(ClO) 2+CO2+H2O== CaCO3+2HClO , 2HClO 2HCl+O2↑ (写两个) 漂白粉漂 白原 理: Ca(ClO) 2+CO2+H2O== CaCO3 ↓ +2HClO (写一个) e. 与盐溶液反应: Cl 2+2NaBr = =2NaCl+Br 2 Cl 2+2KI == 2KCl+I 2 (3) 氯气的制法: a. 实验室制少量氯气 下载可编辑 .专业 .整理 . b. 工业上制少量氯气,电解饱和食盐水的方法。 (4) 氯气的用途:制盐酸、制农药、制漂白粉等;氯气用于自 来水消毒的不利因素: Cl 2 和水中的有机物质反应 生成有机氯化物,可能对人体有害。 2、含氯重要化合物: 次氯酸的性质: (弱酸性、不稳定性、强氧化性、漂白性) 氯水见光易分解 , 方程式 2HClO 2HCl+O2↑,氯水应存放在 棕色试剂瓶中, 新制氯水成分: HCl、HClO、 H 2O、Cl 2,久置氯水主要成分 为 HCl。 例:在紫色石蕊试液中滴加过量的氯水,现象是:先变红, 后褪色。原因:氯水中有盐酸使之变红,有 次氯酸使之褪色。 二、硅及硅的化合物 1、硅单质 硅晶体的熔点和沸点都很高,硬度也很大,硅晶体的导电 性介于导体和绝缘体之间,是一种重要的半导体 材料,广泛应用于电子工业的各个领域 ( 计算机芯片、光太 阳能电池板 ) 。 Si+O 2 == SiO 2 Si+4HF==SiF 4+2H2↑ 2、SiO2(俗名:石英、水晶)化学性质 不活泼,耐高温耐 腐蚀 (1) 不与酸 ( 除 HF)反应( SiO2+4HF==SiF4↑+2H2O )不能用 玻璃瓶装氢氟酸,可以用氢氟酸雕刻玻璃 (2) 与碱性氧化物反应 SiO2+CaO CaSiO3 (3) 与强碱反应 SiO2+2NaOH==Na2SiO3+H2O 实验室装 NaOH、Na2SiO3、Na2CO3 的试剂瓶用橡皮塞, 不用玻 璃塞; 加热熔融 NaOH时不能用石英坩埚、陶瓷坩埚 , 因为其中含 SiO2。 (4) 用途:水晶用于做镜片,玛瑙用于装饰,制石英坩埚,纯 净的 SiO2 用于制造光导纤维 3 、硅酸盐 (1) 特点:结构复杂,大多数不溶于水,化学性质稳定。 (2)Na 2SiO3 ①可溶于水, 能与酸反应生成硅酸 ②用于制硅 胶,木材防火剂③具有黏性,不能用玻璃塞 下载可编辑 .专业 .整理 . (3) 传统硅酸盐工业:陶瓷工业、水泥工业、玻璃工业。 (4) 生产陶瓷原料:黏土; 生产水泥原料:石灰石、黏土、 石膏; 生产玻璃原料:石灰石、纯碱、石英。 三、硫及硫的重要化合物 ( 一) 二氧化硫的性质与作用 1、物理性质:无色、有刺激性气味的、有毒气体,密度比 空气大,易溶于水,易液化 2、化学性质 ⑴与水反应 SO2+H2O H2SO3 可逆反应, H2SO3 不稳定,容 易分解 ⑵还原性 2SO 2+O2 2SO 3 ,也能被酸性 KMnO4 溶液氧 化生成硫酸盐 ⑶漂白性: SO2 能使品红溶液褪色; 只能使石蕊试液变红, 不能使石蕊试液褪色 原理:与有色物质结合反应生成无色物质,该物质不稳 定 (暂时性漂白) 加热又恢复红色。 3、酸雨: pH〈5.6 正常性雨水 pH 值大约为 5.6 ,水中 溶解有 CO2;酸雨中溶解了 SO2 和 NO2 ⑴污染物来源: SO2(主要)含硫燃料的燃烧。 (次要)含硫 金属矿物的冶炼、硫酸工厂产生的废气。氮氧化物主要来 自于汽车尾气 ⑵防治:开发新能源,对含硫燃料进行脱硫处理,对汽 车尾气进行处理,提高环境保护的意识 ⑶常见的环境和生活问题:酸雨: SO2, NOx ; 温室效应: CO2,CH4; 光化学烟雾: NOx,烃; 臭氧层空洞: NO,氯氟烃; 白色污染:塑料垃圾; 假 酒中有毒成分: CH3OH; 室内污染:甲醛和苯蒸气 ;赤潮 和水华:含磷洗衣粉的使用和生活污水的大量排放; CO 与 NO 与血红蛋白结合会损害人的健康;废电池:重金属 离子污染。 ( 二) 硫酸的性质 1、稀硫酸的性质:具有酸的通性(如可使石蕊试液变红) 2、浓硫酸的特性 ⑴吸水性: 浓硫酸能吸收附着在物质表面或内部的湿存水和 结晶水,是一种液体干燥剂,不能干燥碱性气 体 NH3 下载可编辑 .专业 .整理 . ⑵脱水性:有机物的碳化变黑; ⑶浓硫酸的强氧化性 ①与铜反应: 2H2SO4(浓) +Cu CuSO4+SO2↑+2H2O 被还 原的硫酸占反应硫酸的 1/2 ②与碳反应: C+2H2SO4(浓) 2SO2↑+ CO2↑+2H2O ③常温下,浓硫酸使铁、铝钝化(表面生成了致密的氧 化膜) 四、氮及氮的重要化合物 ( 一 ) 氮的氧化物: NO 无色气体,不溶于水,极易与 O2 反应 2NO+O2=2NO2 NO2 红 棕 色 气 体 , 易 溶 于 水 , 3NO2+H2O=2HNO3+NO NOx 主要来源:汽车尾气的排放、金属的冶 炼、氮肥的生产。主要危害:会形成光化学烟雾。 ( 二) 氨及铵盐 1、氨的制取 ⑴工业制法的反应原理: N2+3H2 2NH3 ⑵实验室制法: ① 反 应 原 理 : 铵 盐 与 碱 共 热 制 取 常 用 反 应 2NH4Cl+Ca(OH) 2 CaCl 2+2NH3↑+ 2H2O 也可用加热浓氨水或浓氨水滴加到生石灰 上来制取 ②干燥方法:用碱石灰干燥氨气 ③收集:用向下排 空气法收集 ④验满: 将湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒置 于集气瓶口 ⑤尾气处理:用水吸收,注意防止倒吸 2、氨气的性质 物理性质:无色有刺激性气味的气体,密度比空气小, 极易溶于水,易液化可做大型冷库制冷剂 ⑴与水反应 ①氨溶于水时, 大部分氨分子和水形成一水合氨, NH3·H2O 不稳定,受热分解为氨气和水 NH3+H2O NH3·H2O NH4 ++OH- NH3· H2O NH3↑ +H2O ②氨水中有分子: NH3 、H2O、NH3·H2O ,离子: NH4 + 、OH- (除水分子外, NH3·H2O最多) ③氨气能使湿润的红色石蕊试纸变蓝 下载可编辑 .专业 .整理 . ④液氨与氨水的区别:液氨:是氨气的液体状态,属于 纯净物; 氨水:氨气溶解于水所得的混合 物 ⑵氨可以与酸(硫酸,硝酸,盐酸)反应生成盐 NH3+HCl==NH4Cl (白烟) NH 3+HNO3===NH4 NO3(白烟) 氨气通入强酸中: NH3+H+==NH4 + 3、铵盐 铵盐易溶解于水(通性) ⑴受热易分解 NH 4Cl NH3 ↑ +HCl↑ NH 4HCO3 NH3 ↑ +H2O+CO2↑ 不都生成氨气( NH4NO3)。 ⑵铵盐与碱反应放出氨气(通性) NH4Cl+NaOH NaCl+NH3↑+H2O 注意: 铵态氮肥要避免 与碱性肥料混合使用 NH4 + 检验:取少量待测液,加入 NaOH溶液,加热,在试 管口用湿润的红色石蕊试纸检验,试纸变蓝证明待测液中有 NH4 +存在 ( 三 ) 硝酸的性质 1、物理性质:密度比水大,易溶于水,纯净的硝酸无 色,工业硝酸常因溶有少量 NO2 而略呈黄色。 2、化学性质: (1) 酸性:与金属反应不产生 H2 (2) 不稳定性:见光受热会分解,应贮存在避光、低 温处。 (3) 强氧化性: Cu + 4HNO3( 浓 )=== Cu(NO 3) 2+2NO2↑+2H2O 3Cu +8HNO3( 稀 )==3Cu(NO3) 2+2NO↑+4H2O Fe +4HNO3( 稀 )==Fe(NO3) 3+NO↑+2H2O ( 硝酸 足量 ) 3Fe +8HNO3( 稀 )==3Fe(NO3) 2+2NO↑+4H2O ( 铁粉 足量 ) C+ 4HNO3( 浓 ) CO2↑+4NO2↑+2H2O 常温下,浓硝酸使铁、铝钝化(表面生成了致密 的氧化膜) 小结:重要元素单质及其化合物相互转化 ( 一) 氯单质及其化合物相互转化 下载可编辑 .专业 .整理 . 1. 铁丝在氯气中燃烧 2. 工 业 上 制 取 漂 白 粉 2Cl 2+2Ca(OH)2 = CaCl2+Ca(ClO) 2+2H2O 3. 漂 白 粉 长 期 露 置 在 空 气 中 失 效 Ca(ClO) 2+CO2+H2O= CaCO3+2HClO 4. 氯气通入氢氧化钠溶液 Cl 2+2NaOH= NaCl+NaClO+H2O 5. 氯气通入水中 6. 次氯酸分解 7. 电解饱和食盐水 ( 二) 硅单质及其化合物相互转化 下载可编辑 .专业 .整理 . 8. 二氧化硅与氢氟酸反应 SiO 2+4HF= SiF 4↑+2H2O 9. 二 氧 化 硅 与 氢 氧 化 钠 溶 液 反 应 SiO2+2NaOH= Na2SiO3+H2O 10. 硅酸钠溶液与盐酸反应 Na 2SiO3+2HCl= H2SiO3 ↓+2NaCl 11. 硅 酸 钠溶 液中 通 入 二 氧 化 碳 Na2SiO3+CO2+H2O= H2SiO3↓+Na2CO3 12. 二氧化硅与焦炭在高温条件下反应 ( 三 ) 硫单质及含硫化合物相互转化 下载可编辑 .专业 .整理 . 13. 二氧化硫与氢氧化钠溶液反应 SO 2+2NaOH= Na2SO3+H2O 14. 二氧化硫与氧气反应 15. 酸 雨 的 形 成 2H2SO3+O2 = 2H2SO4 16. 浓硫酸与铜反应 17. 浓硫酸与碳反应 18. 亚硫酸钠被空气中氧气氧化 2Na 2SO3 + O2= 2Na2SO4 ( 四 ) 氮元素单质及其化合物相互转化: 19. 氮气与氢气反应 20. 氮气与氧气反应 21. 一氧化氮被氧化 2NO+O 2= 2NO2 下载可编辑 .专业 .整理 . 22. 二氧化氮与水反应 3NO 2+H2O = 2HNO3+NO 23. 氨气与氯化氢反应 NH 3+HCl= NH4Cl 24. 氨气催化氧化 25. 氯化铵与氢氧化钙反应制氨气 26. 浓 硝 酸 与 铜 反 应 Cu+4HNO3( 浓 ) = Cu(NO3) 2+2NO2↑+2H2O 27. 稀 硝 酸 与 铜 反 应 3Cu+8HNO3( 稀 ) = 3Cu(NO3) 2+2NO↑+4H2O ( 五 ) 钠元素单质及其化合物相互转化: 1. 金属钠在空气中燃烧 2. 一小块金属钠投入水中 2Na+2H 2O= 2NaOH+H2↑ 3. 氢氧化钠与二氧化碳反应 2NaOH+CO 2= Na2CO3+H2O 4. 碳酸钠溶液中通入二氧化碳气体 Na 2CO3+CO2+H2O==2NaHCO3 5. 碳酸氢钠受热分解 6. 过氧化钠和水反应 2Na 2O2+2H2O= 4NaOH+O2↑ 7. 过氧化钠与二氧化碳反应 2Na 2O2+2CO2= 2Na2CO3+O2 ( 六) 铝元素单质及其化合物相互转化: 下载可编辑 .专业 .整理 . 1. 铝溶于氢氧化钠溶液 2Al+2NaOH+2H 2O= 2NaAlO2+3H2↑ 2. 偏铝酸钠溶液中通入过量二氧化碳 NaAlO 2+CO2+2H2O= Al(OH) 3↓+NaHCO3 3. 氢氧化铝溶于氢氧化钠溶液 Al(OH) 3+NaOH= NaAlO2+2H2O 4. 氯化铝溶液中滴加氨水 AlCl 3+3NH3· H2O= Al(OH) 3↓+3NH4Cl 5. 氧 化 铝 溶 于氢 氧 化 钠 溶 液 Al 2O3+2NaOH= 2NaAlO2+H2O 6. 用氧化铝制金属铝 7. 氢氧化铝受热分解 8. 铝与氧化铁反应 下载可编辑 .专业 .整理 . ( 七) 铁单质及含铁化合物相互转化: 1. 氢氧化亚铁与氧气、水发生反应 4Fe(OH) 2+O2+2H2O= 4 Fe(OH)3 2. 氯化铁溶液中加入铁粉 2FeCl 3+Fe= 3FeCl 2 氯 化 铁 溶 液 中 加 入 铜 粉 2FeCl 3+Cu= 2FeCl 2+Cu 3. 氯化亚铁溶液中滴加氯水 2FeCl 2+Cl 2= 2FeCl 3 4. 铁和水蒸气在高温条件下反应 铁在氧气中燃烧 5. 铁在氯气中燃烧 下载可编辑 .专业 .整理 . 6. 铝与氧化铁反应 7. 四氧化三铁在加热条件下通入一氧化碳气体 8. 氢氧化铁受热分解 9. 氯化铁溶液中滴加氨水 FeCl 3+3NH3·H2O= Fe(OH)3↓+3NH4Cl 10. 氯化铁溶液中滴加硫氰化钾溶液 FeCl 3+3KSCN= Fe(SCN)3+3KCl 必修二主题 1 物质结构 元素周期律 1、(1)核素:把具有一定数目的质子和一定数目的中子的一 种原子称为核素。一种原子即为一种核素。 (2)同位素:质子数相同而中子数不同的同一元素的不同 原子互称为同位素。 或:同一种元素的不同核素间互称为同位素。 ①两同:质子数相同、同一元素 ②两不同:中子数不同、 质量数不同③属于同一种元素的不同种原子 (3)质量数 ( A) = 质子数 ( Z) + 中子数 ( N) (4)原子序数 = 核电核数 = 质子数 = 核外电 子数 例: 1)在 6 3Li 、 14 7 N、 23 11 Na、 24 12 Mg、 7 3 Li 、 14 6 C中: 6 3 Li 和 7 3 Li 互为 同位素。 2)写出质子数为 8、中子数为 10 的核素符号为: 2、原子核外电子的排布规律( 1~18 号元素) (1)每个电子层最多容纳的电子数是 2n2(n 表示电子层) (2)最外层电子数不超过 8 个(K 层是最外层时, 最多不超过 2 个); (3)电子总是尽先排布在能量最低的电子层,然后由里向外 依次排布(各电子层能量由低到高的顺序) 。 下载可编辑 .专业 .整理 . 3、画出下列元素的原子结构示意图: 4、元素周期表的第三周期元素,从左到右,原子半径逐渐减 小;元素的金属性逐渐减弱;非金属性逐渐增强。该周期 元素中,除稀有气体外,原子半径最大的是 钠 ;最高价 氧化物对应的水化物碱性最强的是 NaOH;最高价氧化物对 应的水化物呈两性的是 Al(OH) 3;最高价氧化物对应的水化 物酸性最强的是 HClO4。 最高正化合价=最外层电子数=主族序数 最高正 化合价+∣最低负化合价∣= 8 5、周期表的结构: 短周期(第 1、2、3 周期) (元素种类: 2、8、8) 周期: 7 个(共七个横行) 周期表 长周期(第 4、5、6、 7 周期) (元素种类: 18、18、32、26) 主族 7 个:Ⅰ A- ⅦA 副族 7 个: IB- ⅦB 族: 16 个(共 18 个纵行)第Ⅷ族 1 个( 3 个纵行) 零族( 1 个)稀有气体 元素 6、周期序数 = 核外电子层数 主族序数 = 最外 层电子数 7、同主族从上到下,随着核电核数的增加,电子层数逐渐增 多,原子核对最外层电子的引力逐渐减弱,原子失电子的 能力逐渐增强,得电子的能力减弱,即金属性逐渐增强, 非金属性逐渐减弱。 8、元素周期表和元素周期律的指导作用 ①在周期表中寻找新的农药:磷、硫、氯等非金属元素。 ②在周期表中寻找半导体材料:金属与非金属分界线附近。 ③在周期表中寻找催化剂和耐高温、耐腐蚀的合金材料:过 渡元素中。 9、化学键的概念:分子中相邻原子 ( 或离子 ) 之间强烈的相互 作用。 10、带相反电荷的两种离子通过静电作用结合在一起,这种带 相反电荷离子之间的相互作用称为离子键。 这种原子间通 过共用电子对所形成的相互作用称为共价键。 11、离子化合物: 由离子键构成的化合物叫做离子化合物。 如: KCl、MgCl2、CaCl2、ZnSO4、NaOH等 共价化合物: 通过共用电子对形成的化合物叫做共价化合 物。如: HCl、H2O、CO2 等 12、 活泼金属与活泼非金属形成的化合物。如 NaCl、Na2O、K2S 等 下载可编辑 .专业 .整理 . 离子键的存在 强碱:如 NaOH、KOH、 Ba(OH)2、 Ca(OH)2 等 离子化合物 大多数盐:如 Na2CO3、BaSO4 铵盐:如 NH4Cl 非金属单质: H2、X2 、N2 等(稀有气体除外) 共价键的存在 共价化合物: H2O、 CO2 、SiO2、 H 2S 等 复杂离子化合物:强碱、铵盐、含氧酸盐 判断: 1)离子化合物中一定含有离子键; 2 )共价化 合物中一定含有共价键; 3 )含有离子键的化合物一定是离子化合物 4 )含有共 价键的化合物一定是共价化合物 其中 1)2) 3)句话正确;第 4)句话错误。 13、在元素符号周围用小黑点 ( 或× ) 来表示原子的最外层电子 (价电子)的式子叫电子式。 ⑴原子的电子式:如: ⑵离子的电子式: ①阳离子:如 Na+、、Mg2+等 ② 阴 离 子: ⑶ 物 质 的 电子式: ①离子化合物:阴、阳离子的电子式结合即为离子化合物的 电子式。 如: ②某些非金属单质:如: 等 ③共价化合物:如: 必修二主题 2 化学物质及其变化 1、化学反应的两大基本特征:物质变化和能量变化。物质中 的原子之间是通过化学键相结合的,当物质发生化学反应 时,断开反应物中的化学键要吸收能量,而形成生成物中的 化学键要放出能量, 化学键的断裂和形成是化学反应中能量 变化的主要原因。 一个确定的化学反应完成后的结果究竟是吸收能量还是 放出能量,取决于反应物的总能量与生成物的总能量的相对 大小:当反应物的总能量大于生成物的总能量时,化学反应 释放能量; 当反应物的总能量 小于生成物的总能量 时,化学反应吸收能量。 2、化学反应中的能量变化,通常主要表现为热能的变化:吸 热或者放热,有些反应是吸热反应,指的是反应物的总热量 小于生成物的总热量;有些反应是放热反应,指的是反应物 的总热量大于生成物的总热量。 下载可编辑 .专业 .整理 . 3、氢氧化钡晶体与氯化铵晶体的反应、 C与 CO2 的反应、碳酸 钙高温分解的反应为吸热反应;酸碱中和反应、燃烧、活泼 金属与酸、生石灰与水的反应为放热反应。 判断: 1)放热反应均不需加热,吸热反应均需加热。错误 2)需持续加热的化学反应,则一定是吸热反应。正确 4、直接从自然界取得的能源称为一次能源。如风能、水能、 地热、石油等化石燃料;由一次能源经过加工,转换得到的 能源称为二次能源,如电能等。 5、把化学能转化为电能的装置叫做原电池,其中电子流出的 一极是负极,为较活泼的金属电极,发生氧化反应,电子流 入的一极是正极,发生还原反应,原电池的反应本质是氧化 还原反应。 Zn 片, Cu片和稀 H2SO4 组成的原电池装置中:负 极为 Zn,电极反应式 Zn-2e-=Zn2+,正极为 Cu,电极反应式 为 2H++2e-=H2↑,电子由负极经外电路流向正极,溶液中的 阳离子移向 正 极,随着反应的进行溶液的 pH 值将逐渐增 大。 6、 提高燃料的燃烧效率的措施可归纳为两个方面:尽可能使 燃料充分的燃烧,提高能量的转化率;尽可能充分的利用燃 料燃烧所释放的热能,提高热能的利用率。提高燃料的燃烧 效率实质上从多方面控制燃烧反应的条件。 铅蓄电池属于充电电池,又称为二次电池;笔记本电脑, 移动电话等主流电池为锂离子电池; 氢氧燃料电池优点: 1)可以持续供电; 2)产物无污染; 3)能量转化率高。 7、 一个具体的化学反应应用于实际时,要考虑两个方面的问 题:反应的快慢即化学反应的速率问题和反应进行的程度即 化学反应的限度问题。 影响化学反应速率的因素: 内因: 由反应物的本身性质决 定;外因有:当其他条件不变时,温度越高,化学反应速率 越大;使用催化剂一般能提高化学反应速率;反应体系中物 质的浓度越大,化学反应速率越大,固体的表面积越大,反 应物的颗粒越小,接触越充分,化学反应速率越大 。 8、任何可逆反应在给定条件下的进行都有一定的限度,只是 不同反应的限度不同。 9、在生产和生活中,人们希望利用有利的化学反应,控制有 害的化学反应如:工业上合成氨,采用高温、 高压、催化剂的条件以加快生成氨气的速率。食品在低温 下的保存,以减缓食物腐败的速率。 必修二主题 3 有机化合物 1、煤、石油、天然气不仅是能源,也是重要的化工原料。 2、甲烷的分子式为 CH4。甲烷是一种无色无味气体,密度比空 气小,不溶于水。 下载可编辑 .专业 .整理 . 3、甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。 在通常情况下,甲烷性质比较稳定,与高锰酸钾等强氧化剂不 反应,与强酸、强碱也不反应。但在特定条件下也能发生某些 反应。 (1)氧化反应(燃烧) :甲烷是一种优良的气体燃料, 燃烧时能放出大量的热,化学方程式为: CH4+2O2→CO2+2H2O ; 现象:淡蓝色火焰。 (2)取代反应:甲烷与氯气、溴蒸气在光 照条件下发生取代反应; 其中甲烷中的氢原子能被氯原子逐个 取代分别生成: CH3Cl 、CH2Cl 2、CHCl3 和 CCl4,它们都不溶于水。 甲烷主要用途:是一种清洁能源,也是一种重要的化工原料。 4、乙烯的分子结构: C2H4,结构简式为 CH2=CH2 ,含有碳碳双 键。 5、工业上通过石油裂解以制得乙烯,乙烯 的年产量可以作为 衡量一个国家的石油化工发展水平的标志。 通常情况下,乙 烯是一种无色、 稍有气味的气体, 不溶于水, 密度比空气略小。 乙烯的化学性质: (1)氧化反应: a:在空气中燃烧,火焰明 亮且伴有黑烟,同时放出大量热。 b:乙烯能使酸性高锰酸钾 溶液褪色, 利用这个反应可以鉴别甲烷和乙烯。 (2)加成反应: 乙烯能使溴的四氯化碳溶液或溴水褪色, 是因为乙烯与溴发生 了加成反应,乙烯还能与 H2、Cl 2、HCl、H2O等发生加成反应。 乙烯还能发生加聚反应生成聚乙烯。 乙烯的主要用途:是一种重要的化工原料,可以用于合成聚 乙烯等化工产品,也是一种植物生长调节剂。 6、苯的分子式为 C6H6 ,苯分子中六个碳碳键完全相同,且是 介于碳碳单键和碳碳双键之间的独特的键。 7、苯的来源:可以从煤中提取或从石油加工得到,通常情况 下,苯是无色、带有特殊气味的液体,有毒,不溶于水,密度 比水小。 苯的化学性质: (1)燃烧:在空气中燃烧时发出明亮的火焰 并伴有浓烟。但不能被酸性高锰酸钾溶液氧化。 (2)易发生取代反应:在铁或溴化铁的催化下与液溴发生取 代反应生成不溶于水的液体溴苯。也能在浓硫酸作用下,与浓 硝酸发生取代反应生成硝基苯; (3) 能发生加成反应:在催化 剂条件下与氢气反应生成环已烷。 苯的化学性质(概括) :易取代、能加成、难氧化。 8、乙醇的分子式为 C2H6O,结构简式为 CH3CH2OH,含有的官能 团的名称为羟基。化学性质: (1)氧化反应: a:在空气中燃 烧放出大量的热。 b:在铜或银催化下被氧气氧化生成乙醛 (CH3CHO)。c:乙醇还能被酸性高锰酸钾溶液或酸性重铬酸钾 溶液氧化,直接生成乙酸。 (2)与钠反应:钠与乙醇反应比与 水反应缓慢,生成乙醇钠和氢气。 ( 3)与乙酸在浓硫酸作催化 剂条件下发生酯化反应。用途:重要的有机溶剂。作为燃料。 75%的酒精溶液作为消毒剂。制白酒。是重要的化工原料。 9、乙酸的分子式为 C2H4O2,结构简式为 CH3COOH,含有官能团 名称为羧基。物理性质:具有强烈刺激性气味的无色液体,具 下载可编辑 .专业 .整理 . 有挥发性,易溶于水和酒精。化学性质: ( 1)具有酸的通性: 能与指示剂、 金属、 碱性氧化物、 碱、盐反应, 酸性比碳酸强, 能与碳酸钙发生反应。 (2)与乙醇发生酯化反应。用途:既是 调味品又是重要的化工原料。 10、认识糖类、油脂、蛋白质的组成、主要性质及其在日常生 活中的应用,糖类物质是绿色植物光合作用的产物,是动、植 物所需能量的重要来源。糖类含有 C、H、O三种元素,单糖中 葡萄糖、果糖的化学式为 C6H12O6,但结构不同。它们互为同分 异构体。 葡萄糖的特征反应:在碱性、水浴加热条件下,能与银氨溶液 反应得到银镜; 也可以与新制氢氧化铜悬浊液在加热条件下反 应产生砖红色沉淀。二糖:食用的白糖、冰糖就是蔗糖,蔗糖 的分子式为: C12H22O11 ,蔗糖在酸性条件下水解生成葡萄糖和 果糖 。多糖:淀粉的化学式为: (C6H10O5)n ,是天然高分子化 合物。淀粉的特征反应:在常温下淀粉遇碘水变蓝色。利用此 反应可以检验淀粉的存在。纤维素的化学式与淀粉同,是天然 高分子化合物,棉花的主要成分是纤维素。 油脂中含有 C、H、O三种元素,为高级脂肪酸甘油酯。油是 指植物油,通常为液态,是由于分子结构中含有不饱和的碳碳 双键。脂是指动物脂肪,通常为固态。油脂在酸、碱性条件下 都能发生水解,在酸性条件下生成高级脂肪酸和甘油,而在碱 性条件下生成高级脂肪酸盐和甘油。 高级脂肪酸盐是肥皂的主 要成分,所以油脂在碱性条件下的水解反应又称为皂化反应。 蛋白质含有元素有 C、H、O、N 等,羊毛、蚕丝的主要成分 都为蛋白质,蛋白质是天然高分子化合物。部分溶于水。蛋白 质水解的最终产物是氨基酸 必修二主题 4 化学与自然资源的开发利用 1、将金属矿物中的金属从其化合物中还原出来用于生产和制 造各种金属材料,这一过程在工业上称为金属的冶炼。 2、金属冶炼常见的化学方法有:电解法、热还原法、热分解 法。 3、很活泼的金属如钾、 钙、钠、镁、铝的冶炼方法是 电解法 。 4、较活泼的金属如锌、铁、铜,冶炼的方法是热还原法。 5、不活泼金属如汞、银,冶炼方法为 热分解法。 6、海水水资源的利用,主要包括海水的 淡化和直接利用海水 进行冷却、发电等。海水淡化的方法主要有:蒸馏法 ( 属于物 理方法 ) 等 7、所谓化石燃料就是指不可再生燃料,通常是指:石油、煤、 天然气 8、煤是由 无机物 和 有机物 组成的复杂混合物,其组成以 碳 为主。通过煤的 干馏、气化和 液化而获得洁净的燃料和 多种化工燃料。是目前实现煤的综合利用的主要途径。煤的干 馏是指将煤 加强热使之分解的过程, 煤 下载可编辑 .专业 .整理 . 的气化是将其转化为水煤气的过程。煤的干馏、气化、液化均 为化学变化。 9、天然气的主要成分是甲烷。 10、石油是由多种 烷烃、环烷烃、芳香烃 组成的混合物,利 用原油中各组分沸点的不同进行分离的过程叫做分馏; 分馏是 物理变化过程。石油经分馏后可以获得汽油、煤油、柴油、重 油等,催化裂化的目的是为了提高汽油等轻质油的产量和质 量。裂解的目的是:为了乙烯、丙烯等基础化工原料。催化裂 化和裂解均为化学变化。 11、我们熟悉的塑料、合成橡胶、合成纤维主要是以石油为原 料生产的。聚氯乙烯 。 12、形成酸雨的主要物质是 SO2、NO2;含磷的大量污水任意排 放会出现 赤潮、水华等水体污染问题。绿色化学的核心就是 利用化学方法从源头上消除工业生产对环境的污染, 按绿色化 学的原则,最理想的“原子经济”就是反应物的原子全部转化 为期望的最终产物,这时原子利用率为 100% 。符合绿色化学 要求的无机反应类型有化合反应; 有机反应类型有加成反应和 加聚反应 选修一主题 1 关注营养平衡 1、 (1) 生命的基础能源——蛋白质 ①糖类是绿色植物光合作用的产物,是人和大多数动物最 基本也是最廉价的能量来源。 ②糖类也叫碳水化合物,大多数通式为 Cn(H2O)m。 ③葡萄糖是人体内最重要的供能物质。 粮食中的糖类在人体 中转化成葡萄糖而被吸收,在体内有三条途径,即: a、 直接氧化供能; b、被肝脏肌肉等组织合成肝糖元而储存 起来; c 、转变为脂肪 。 ④葡萄糖的检验: a 、与新制 Cu(OH)2 悬浊液加热产生砖 红色沉淀 (Cu 2O); b、与银氨溶液水浴加热产生光亮的 Ag( 银镜反 应 ) 。 (2) 重要的体内能源—— 油脂 ①油脂是由多种高级脂肪酸与甘油生成的酯,油脂属于酯 类。天然油脂属于混合物。 ②油脂的密度比水小,不溶于水,易溶于有机溶剂。 ③油脂是热值最高的营养物质。 ④油脂在体内的变化: 油脂在小肠里受酶催化而发生水解反 应,主要生成高级脂肪酸和甘油,作为人体的营养。脂肪 中必需脂肪酸的含量越高,其营养价值越高。在必需脂肪 酸中亚油酸最重要。 (3) 生命的基础物质——蛋白质 蛋白质在人体内的消化过程: 进入人体的蛋白质在胃蛋 下载可编辑 .专业 .整理 . 白酶和胰蛋白酶的作用下,水解为氨基酸 。氨基酸被人体 吸收后,重新结合成人体所需的各种蛋白质,构成和修补人 体的各种组织。 (4) 维生素是参与生物生长发育和新陈代谢所必需的一类小 分子有机化合物。 2、人体新陈代谢过程中的几个生化反应: (1) 淀粉的化学性质: (C6H10O5) n+nH2O nC6H12O6 淀粉 葡萄糖 (2) 葡萄糖在人体内的氧化还原反应: C6H12O6 + 6 O 2 6 CO 2 + 6 H 2O (3) 油脂在体内的消化过程: (4) 蛋白质在体内的消化过程: 3、氨基酸、蛋白质的组成、结构及性质: (1) 蛋白质是生命的基础,没有蛋白质就没有生命。蛋白质是 一种相对分子质量很大的天然高分子化合物。有些蛋白 质能溶于水,有些蛋白质难溶于水。 (2) 氨基酸是蛋白质的基石,是蛋白质的基本结构单元。氨基 酸分子中含有碱性基——氨基 ( —NH2) 和酸性基——羧基 ( —COOH),氨基酸呈两性 。 (3) 蛋白质的性质: a 、两性:蛋白质分子中也含有碱性基——氨基和酸性基 ——羧基,所以具有两性。 b、水解:在酶或酸、碱的作用下能发生水解,最终转化 为氨基酸。 c、盐析:向蛋白质溶液中加入 Na2SO4 或 (NH4) 2SO4 等溶液, 会析出蛋白质沉淀, 这种作用叫做盐析, 具有可逆 性,属于物理变化。 d、变性:蛋白质在受热、紫外线、 X 射线、强酸、强碱, 铅铜汞等重金属的盐类和 甲醛、酒精等有机物的作用 下,发生的不可逆的凝固,叫做变性。蛋白质变性后, 不仅丧失了原有的可溶性,同时也失去了生命活性。 e、颜色反应:某些蛋白质遇到浓硝酸变黄色。可用于鉴别 某些蛋白质。 f 、将蛋白质灼烧,有烧焦羽毛的气味。可用于鉴别蛋白 水 高级脂肪酸甘油酯 水解 酶 高级脂肪酸 甘油 二氧化碳 + + + 热量 催化剂 ? 下载可编辑 .专业 .整理 . 质。 4、人体中共有 20 多种氨基酸,其中属于必需氨基酸的有 8 种。这种必需氨基酸与其他氨基酸不同之处在于,它们在 人体中不能自然合成,而必需从食物以及补品中获得。 5、鸡肉、猪肉等肉类食品、蛋类、奶类及豆制品等食物中富 含丰富的蛋白质。 6、脂溶性维生素和水溶性维生素的比较 脂溶性维生素 水溶性维生素 溶解性 难溶于水, 易溶于脂肪和 有机溶剂 易溶于水 包括种 类 维生素 A、D、E、 K 等 维生素 C和维生素 B 族 来源 动物肝脏 新鲜蔬菜和水果 7、维生素 C的组成、结构和重要性质 (1) 物理性质:无色晶体,易溶于水,溶液显酸性,有可口的 酸味。 (2) 化学性质:维生素 C是一种较强的还原剂,另外还具有酸 性和不稳定性。 (3) 存在:新鲜蔬菜和水果中。 (4) 重要功能:维生素 C也称为抗坏血酸,它参与人体内的氧 化还原反应,维持细胞间质的正常结构。 (5) 人体不能合成维生素 C,必须从食物中取得。生吃新鲜蔬 菜要比熟吃时维生素 C损失小。 8、人和动物体内生命元素分为常量元素和微量元素。常量元 素是指含量在 0.01%以上的元素,包括 C、H、O、N、P、S、 K、Ca、Na、Mg、Cl 等 11 种。 微量元素是指含量在 0.01%以下的元素, 如 Fe、Cu、Zn、Mn、 Co、Mo、Se、I 、Li 、等。 (1) 碘是人体必需的微量元素之一,有“智慧元素 ”之称。 缺碘易患地方性甲状腺肿或呆小症,碘过量易患甲亢;补 碘可吃加碘食盐 ( 含有 KIO 3) 、海带等。 (2) 铁是人体必需的微量元素中最多的一种, 缺铁会发生缺铁 性贫血。铁摄入过量易引起铁中毒。 (3) 钙是构成人体骨骼和牙齿的主要元素,缺钙易患佝偻病、 骨质疏松症等。 选修一主题 2 促进身心健康 1、合理选择饮食即平衡膳食要注意两点:第一,膳食中应该 有多样化的食物;第二,膳食中各种食物的比例要合理。 2、食品添加剂:①着色剂:食用天然色素和食用人工合成色 素,常见的着色剂有:胡萝卜素、胭脂红、柠檬黄、苋菜红 等。②调味剂:食醋、 酱油、味精、辣椒粉、香精、柠檬酸 等。③防腐剂: 苯甲酸、 苯甲酸钠 、山梨酸钾等。 ④疏松剂: 碳酸氢钠、碳酸氢铵等, 下载可编辑 .专业 .整理 . 3、药物: ①阿司匹林—解热镇痛药。 ②青霉素是重要的抗生素即抗菌消 炎药。 ③抗酸药是一类治疗的药物,能中和胃里过多的,缓解胃部 不适。抗酸药中通常含有一种或几种能中和盐酸的化学物 质,如 CaCO3、MgCO3、Al(OH) 3 等。分别写出 MgCO3、Al(OH) 3 和盐酸反应的离子方程式: MgCO3+2H+= Mg2++CO2↑+H2O;Al(OH) 3+3H+= Al 3++3H2O。 4、大部分药物都有毒副作用,应该在医生指导下使用。 OTC 表示非处方药。毒品是指由于非医疗目的而反复连续使用, 能够产生依赖性即成瘾性的药品。常见的毒品有海洛因、冰 毒等。 选修一主题 3 探索生活材料 1、居室装修中所用的材料,既有金属材料,又有硅酸盐材料; 既有天然材料,又有合成材料。地面多用复合地板、实木 地板或瓷砖,主要作用是装饰、防潮和耐磨等,会有甲醛 释放;墙面、顶棚多用涂料,主要作用是装修、保护墙面, 挥发性的有机溶剂,颜料中的重金属会对人体造成危害; 卫生间多用陶瓷(硅酸盐) ,用于装修、防水,可能产生放 射性; 厨房多用天然大理石 (碳酸钙)、PVC板(聚氯乙烯) , 大理石可能产生放射性;门窗主要是塑钢和玻璃等,装饰、 密封和透光等作用。 2、合金:由两种或两种以上金属(或金属与非金属)熔合而 成的具有金属特性的物质。合金与各成分金属相比,具有 许多的物理、化学或机械性能。如:合金的硬度较大,合 金的熔点比各组分金属的低。 3、我们经常使用的合金有铁合金、铝合金、铜合金和新型合 金。 ⑴生铁和钢是含碳量不同的的两种铁合金, 钢一般分为碳素 钢和合金钢两大类。 ⑵铝是地壳中含量最多的金属元素,纯铝的硬度和强度不 大,不适于制造机器零件 ⑶常见的铜合金有青铜和黄铜 4、⑴金属的腐蚀是指金属与周围接触到的化学物质发生化学 反应而腐蚀消耗的过程。 ⑵实质 : 金属原子失去电子而被氧化的过程。 ⑶分类及其比较 化学腐蚀 电化学腐蚀 含义 金 属 与 接 触 到 的 物 质 直 接 发 生 化 学 反 应 而 不纯的金属 (或合金) 与电 解质溶液接触时发生原电 下载可编辑 .专业 .整理 . 消耗的过程 池反应而消耗的过程 电子 得失 金 属 直 接 将 电 子 转 移 给具有氧化性的物质 活泼金属将电子间接转移 给氧化性较强的物质 电流 无电流产生 有微弱的电流产生 腐 蚀 对象 金属单质 较活泼的金属 实例 金属与 Cl 2、O2 等物质直 接反应 钢铁在潮湿的空气中被腐 蚀 ⑷钢铁腐蚀:负极 Fe-2e-=Fe 2+ 5、金属防腐的方法:制成不锈钢,在金属表面涂油漆,电化 学保护法 ( 船体嵌锌块 ) 6、常用的硅酸盐材料:水泥、玻璃和陶瓷 原 料 主要成分 陶瓷 黏土 硅酸盐 玻璃 纯碱、石灰石、石英 硅酸钙、硅酸钠、二氧化 硅 水泥 石灰石、黏土 硅酸三钙、硅酸二钙、铝 酸三钙 ⑴普通玻璃与钢化玻璃的关系: 普通玻璃通过加工得钢化玻 璃,两者成分相同。 ⑵水泥砂浆:水、水泥、砂子按一定比例的混合物。 7、⑴从高纯度的二氧化硅熔融体中,拉出的细丝传导光的能 力非常强,所以又称光导纤维,简称光纤。 ⑵随着科学技术的发展, 人们研制出了许多有特殊功能的陶 瓷,如超硬陶瓷、生物陶瓷等,使陶瓷的用途不断扩展。 8、⑴通常所说的三大合成材料是指塑料、合成纤维、合成橡 胶。 ⑵塑料的主要成分是合成树脂, 还含有增塑剂和防老化剂等 添加剂 . 热塑性塑料具有线型结构,如聚乙烯;热固性塑料 具有体形结构,如酚醛树脂。 ⑶天然纤维如棉花、羊毛、蚕丝、麻等,化学纤维包括: 人造纤维(成分仍然是纤维素)和合成纤维(如 “六 大纶”属于人工合成高分子化合物) 。 ⑷天然橡胶的化学组成是聚异戊二烯;工业上常用硫与橡胶 分子作用,使橡胶硫化,使橡胶具有较高的强度、良好的弹 性等。 ⑸复合材料是将两种或两种以上不同性质的材料组合起来, 取长补短。一种材料作为基体材料,另一 种作为增强材料, 玻璃纤维增强塑料 ( 玻璃钢 ) 就是合成树 脂和玻璃纤维组成的复合材料。 选修一主题 4 保护生存环境 1、防止水体污染,改善水质,最根本的措施是控制工业废水 下载可编辑 .专业 .整理 . 和生活污水的排放。处理污水的方法很多,一般可归纳为物理 法、 生物法、 化学法等。 其中化学法又可分为中和法、 沉淀法、 氧化还原法。 (1)混凝法: A、常用的混凝剂有明矾 [ KAl(SO 4) 2·12H2O ] 、可溶性 铝盐和铁盐等。 B 、 写 出 明 矾 净 水 的 原 理 离 子 方 程 式: 。 (2)中和法。 H+ + OH—= H 2O (3)沉淀法:利用沉淀反应是除去水中重金属离子常用的方 法。 2、大气污染物根据组成成分,空气质量日报中的首要污染物 包括: SO2、NO2、可吸收颗粒物 (PM2.5) 。大气污染产生的危害 是多方面的如产生的三大环境问题:酸雨、臭氧层空洞、温室 效应。 (1)正常雨水偏酸性, pH 约为 5.6 ,这是因为大气中的 CO2 溶于水的缘故。酸雨是指 pH 小于 5.6 的降水,主要是由于人 为排放的 SO2 和 NO2 等酸性气体转化而成的。 其 中 硫 酸 型 酸 雨 的 形 成 途 径 : 2H2SO3+O2= 2H2SO4 硝酸型酸雨的形成: 3NO 2+H2O= 2HNO3+NO (2)人类活动排入大气的某些化学物质如氟氯代烷和含溴的 卤代烷烃(灭火剂,商品名为哈龙)等与臭氧发生作用,使臭 氧层受到破坏。此外,喷气式飞机在高空飞行排出的氮氧化物 如 N2O、NO以及大气中的核爆炸产物也会破坏臭氧层。 (3)温室气体主要有: CO2、CH4、N2O、氟氯代烷。 3、如何减少或消除大气污染 (1)减少煤等化石燃料燃烧产生的污染。煤燃烧时,空气不 足不完全燃烧,会产生大量的 CO等气体;煤中所含的硫、氮 等元素在燃烧时会生成 SO2、NO和 NO2 等,也会对大气造成污 染,且是导致酸雨形成的主要原因之一。 主 要 措 施 : A 、 改 善 燃 煤 质 量 , 进 行 脱 硫 处 理: ;B、改 进燃烧装置和燃烧技术、改进排烟设备等; C、发展洁净煤技 术、开展煤的综合利用; D、调整和优化能源结构,降低燃煤 在能源结构中的比率, 加快开发和利用太阳能、 风能、 地热能、 核能和氢能等新能源。 (2)减少汽车等机动车尾气污染。汽车等机动车排出的一些 大气污染物如 CO、NO、NO2 和烃等易形成光化学烟雾。 主要措施: A、推广使用无铅汽油。 B、在催化转化器的前半部, CO 和 NO 在催化剂的作用下发生反应,写出其中化学方程 式 ;在转化器的后半部, 未燃烧的碳氢化合物和未反应的 CO在催化剂的作用下氧化, 生成 CO2 和 H2O。 下载可编辑 .专业 .整理 . 4、减少室内空气污染。室内主要污染物:家用燃料燃烧、烹 调和吸烟等产生的 CO、CO2、NO、NO2、SO2 和尼古丁等污染物是 造成室内空气污染的主要原因。另一方面,各种建筑材料和装 饰材料也带来各种挥发性有机物如甲醛( HCHO)、苯( C6H6)、 甲苯( C7H8),以及放射性元素( Rn)等污染物,它们成为室内 空气污染物的另一个重要来源。 5、由废弃塑料制品造成的污染叫“白色污染” 。白色污染物属 于有机物。 6、白色污染的危害: (1)大部分塑料在自然环境中不能被微 生物分解,埋在土里经久不烂,长此下去会破坏土壤结构,降 低土壤肥效, 污染地下水。 (2)焚烧废弃塑料会产生有害气体, 对大气造成污染。 (3)制备发泡塑料时,常常加入氟氯代烷作 为发泡剂,会破坏臭氧层和加剧温室效应。 (4)废弃塑料会危 害动物。 防治方法:从改进塑料的配方和生产工艺入手,研制成功了一 些在环境中可降解的塑料。目前治理“白色污染” ,主要还应 减少使用、加强回收。 8、生活垃圾处理的常用方法——封闭式焚烧、卫生填埋。废 旧电池集中回收处理。 医疗垃圾则采用封闭式焚烧法对其进行 处理。查看更多