- 2021-08-24 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氧化剂和还原剂(第2课时) 学案
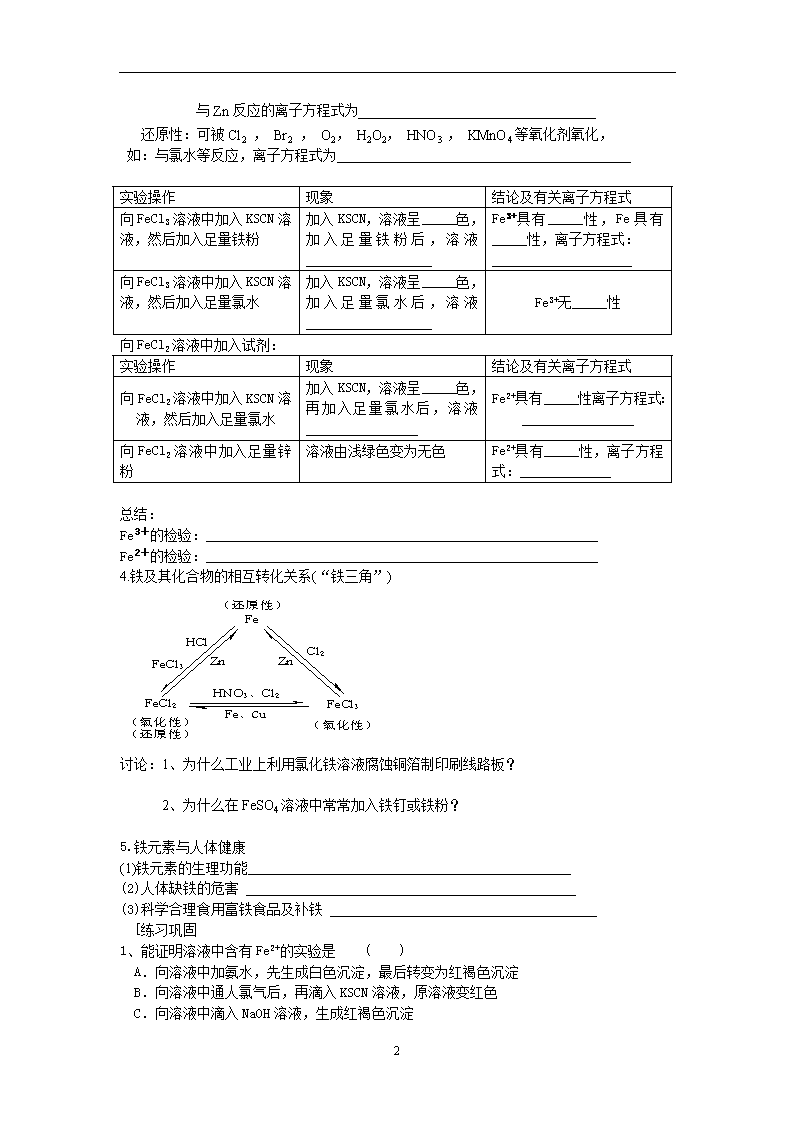
2.3 氧化剂和还原剂(第2课时) 【学习目标】 1.知道铁及其常见铁的化合物的物理性质(颜色、状态),了解Fe3+的检验方法。 2.掌握金属铁、氯化铁、氯化亚铁之间的相互转化关系。 3.通过金属铁、氯化铁、氯化亚铁的氧化性或还原性的探究实验,使学生学会“运用已知物质的性质验证未知物质的性质”的科学方法。 【重点难点】 金属铁、氯化铁、氯化亚铁之间的相互转化关系 [旧知回顾] 完成下列有铁元素参与的化学方程式: (1)Fe与稀硫酸的反应____________________________________ (2)Fe与CuSO4溶液的反应____________________________________ (3)三氧化二铁与CO的反应 (4)Fe在氯气中燃烧____________________________________ 从得失电子角度,以上反应均属于_________反应,表现出单质铁的_______性和高价铁的________性。 [新课预习] 三、探究铁及其化合物的氧化性和还原性 1.铁和铁的化合物的存在 (1)铁元素在地壳中的质量分数为 处于第 位,仅次于 、 、和 在自然界中有两种存在形态----- 和 ,游离态的铁存在于 中,而更多的是以 价和 价的化合态存在。 (2)铁的化合物在自然界中主要以 的形式存在,如 矿(主要成分是 )、 矿(主要成分是 )、 矿(主要成分是 2.铁的重要化合物 (1)铁的氧化物主要有 、 、 。铁的氢氧化物主要有 和 。 (2)硫酸亚铁与NaOH溶液反应生成 ,在空气中迅速变成 色,最后变成 色。因为Fe(OH)2 ,易被氧化成 反应方程式:4 Fe(OH)2+O2 + 2H2O = 4Fe(OH)3 3. 铁及其化合物的氧化性和还原性 预测:铁、氯化铁、氯化亚铁中只有氧化性的是 ;只有还原性的是 既有氧化性又有还原性的是 。 (1)、铁单质具有还原性,能将硫酸电离出的H+还原为氢气 离子方程式为________________________________________ (2)、含有Fe3+的化合物通常具有氧化性,可氧化Zn AI Fe Cu S2- I- SO2等还原性物质。如FeCl3遇铁,可将铁原子氧化为Fe2+,自身被还原为Fe2+,离子方程式为________________________________________; 此外,还可以氧化其它物质,如: 与铜反应,离子方程式为______________________________________ (3)、Fe2+既具有氧化性又具有还原性,其化合物既可做氧化剂又可做还原剂 氧化性:能与Zn、Al等活泼金属作用,表现氧化性,如: 3 与Zn反应的离子方程式为__________________________________ 还原性:可被Cl2 , Br2 , O2, H2O2, HNO3 , KMnO4等氧化剂氧化, 如:与氯水等反应,离子方程式为__________________________________________ 实验操作 现象 结论及有关离子方程式 向FeCl3溶液中加入KSCN溶液,然后加入足量铁粉 加入KSCN,溶液呈_____色,加入足量铁粉后,溶液__________________ Fe3+具有_____性,Fe具有_____性,离子方程式: ____________________ 向FeCl3溶液中加入KSCN溶液,然后加入足量氯水 加入KSCN,溶液呈_____色,加入足量氯水后,溶液__________________ Fe3+无_____性 向FeCl2溶液中加入试剂: 实验操作 现象 结论及有关离子方程式 向FeCl2溶液中加入KSCN溶液,然后加入足量氯水 加入KSCN,溶液呈_____色,再加入足量氯水后,溶液________________ Fe2+具有_____性离子方程式:________________ 向FeCl2溶液中加入足量锌粉 溶液由浅绿色变为无色 Fe2+具有_____性,离子方程式:_____________ 总结: Fe3+的检验:________________________________________________________ Fe2+的检验:________________________________________________________ 4.铁及其化合物的相互转化关系(“铁三角”) 讨论:1、为什么工业上利用氯化铁溶液腐蚀铜箔制印刷线路板? 2、为什么在FeSO4溶液中常常加入铁钉或铁粉? 5.铁元素与人体健康 (1)铁元素的生理功能 (2)人体缺铁的危害 (3)科学合理食用富铁食品及补铁 [练习巩固 1、能证明溶液中含有Fe2+的实验是 ( ) A.向溶液中加氨水,先生成白色沉淀,最后转变为红褐色沉淀 B.向溶液中通人氯气后,再滴入KSCN溶液,原溶液变红色 C.向溶液中滴入NaOH溶液,生成红褐色沉淀 3 D.向溶液中滴入KSCN溶液,溶液变红色 2.下列物质与铁反应后的生成物,能与KSCN溶液作用生成红色溶液的是 A、盐酸 B、氯气 C、CuSO4溶液 D、稀硫酸 3.在铁与硫酸铜溶液的反应中, A.铁被还原,该反应属于化合反应 B.铜被还原,该反应属于分解反应 C.铁被氧化,该反应属于置换反应 D.铜被氧化,该反应属于复分解反应 4、把铁、铜、氯化铁、氯化亚铁、氯化铜溶液放在一起,反应后铁有剩余,则溶液中含有的最多的阳离子是( ) A.Cu2+ B.Fe3+ C.Fe2+ D.H+ 5.如何除去杂质, 提纯下列各物质 混合物成分 试剂 离子方程式 (1)FeCl2中含少量FeCl3杂质 (2)FeCl3中含少量FeCl2杂质 (3)FeSO4中含少量CuSO4杂质 3查看更多