2018届二轮复习水的电离和溶液的酸碱性学案(全国通用)(1)
专题十 水的电离和溶液的酸碱性
考纲解读
考点
考纲内容
高考示例
预测热度
水的电离和水
的离子积常数
1.了解水的电离
2.了解离子积常数
2015广东理综,11,4分
2014山东理综,13,5分
★★
溶液的酸碱性和pH
酸碱中和滴定
1.了解溶液pH的含义
2.了解溶液pH的测定方法,能进行pH的简单计算
2017天津理综,9,18分
2015山东理综,31,19分
★★
分析解读 本专题内容为高考常考内容之一。备考时要重点关注外界条件对水的电离程度的影响,溶液显酸性、碱性的本质,水的离子积常数的应用,溶液pH的计算等内容,本专题常将上述考点与酸碱中和滴定曲线相结合,运用数学工具(图表)进行知识与能力的综合考查。
命题探究
五年高考
考点一 水的电离和水的离子积常数
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案 C
2.已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(N)=c(CH3COO-)
答案 D
3.下列有关电解质溶液的说法正确的是 ( )
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
答案 C
4.某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
答案 C
考点二 溶液的酸碱性和pH 酸碱中和滴定
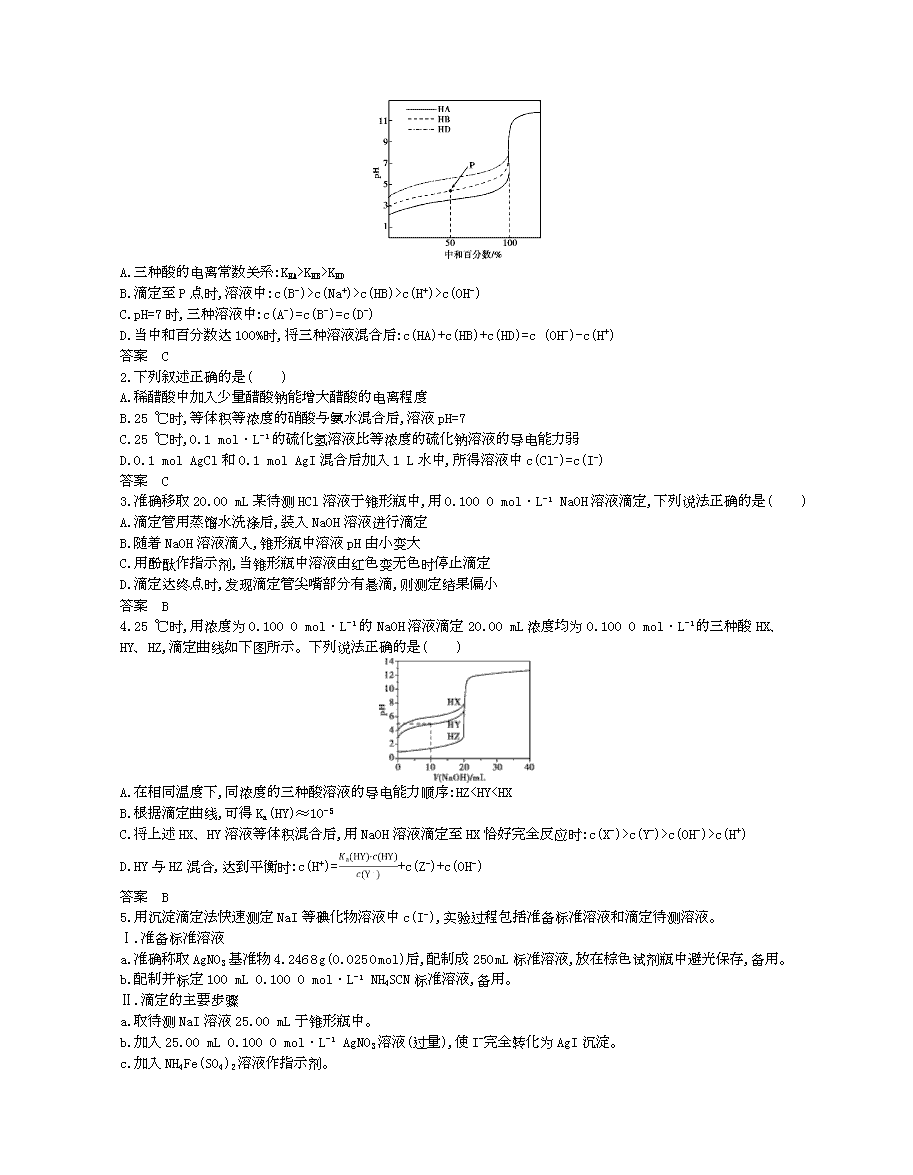
1.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c (OH-)-c(H+)
答案 C
2.下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)
答案 C
3.准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1 NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
答案 B
4.25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ
c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=+c(Z-)+c(OH-)
答案 B
5.用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.025 0 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号
1
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 。
(3)滴定应在pH<0.5的条件下进行,其原因是 。
(4)b和c两步操作是否可以颠倒 ,说明理由 。
(5)所消耗的NH4SCN标准溶液平均体积为 mL,测得c(I-)= mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为 。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果 。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果 。
答案 (18分)(1)250 mL(棕色)容量瓶、胶头滴管
(2)避免AgNO3见光分解
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能) 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点
(5)10.00 0.060 0
(6)用NH4SCN标准溶液进行润洗
(7)偏高 偏高
6.毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3·H2O调pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2Cr+2H+ Cr2+H2O Ba2++Cr BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
答案 (1)增大接触面积从而使反应速率加快 a、c
(2)Fe3+ Mg(OH) 2、Ca(OH)2 H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少
(3)上方 偏大
教师用书专用(7—12)
7.下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(C)>c(HC)>c(OH-)
B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(N)+c(OH-)
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
答案 B
8.下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)×c(OH-)=KW
B.M区域内任意点均有c(H+)40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为: g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施 。
答案 (1)冷凝管或冷凝器 b
(2)SO2+H2O2 H2SO4
(3)③ 酚酞 ④
(4)0.24
(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响
12.硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.335 0 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2- NiY2-+2H+),消耗EDTA标准溶液31.25 mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将 (填“偏高”“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
答案 (12分)(1)偏高
(2)湿润的红色石蕊试纸 试纸颜色由红变蓝
(3)n(Ni2+)=0.040 00 mol·L-1×31.25 mL×10-3L·mL-1=1.250×10-3 mol
n(N)==2.500×10-3 mol
n(S)===2.500×10-3 mol
m(Ni2+)=59 g·mol-1×1.250×10-3 mol=0.073 75 g
m(N)=18 g·mol-1×2.500×10-3 mol=0.045 00 g
m(S)=96 g·mol-1×2.500×10-3 mol=0.240 0 g
n(H2O)==
1.250×10-2 mol
x∶y∶m∶n=n(N)∶n(Ni2+)∶n(S)∶n(H2O)=2∶1∶2∶10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
三年模拟
A组 2016—2018年模拟·基础题组
考点一 水的电离和水的离子积常数
1.(人教选4,三-2-1,变式)①0.1 mol/L盐酸 ②0.1 mol/L H2SO4溶液 ③0.1 mol/L NaOH溶液 ④0.1 mol/L CH3COOH溶液。相同条件下,有关上述溶液的说法正确的是( )
A.溶液中水的电离程度:④>①>③>②
B.相同体积的①和④,与NaOH溶液中和时,消耗NaOH的物质的量①>④
C.相同体积的③和④混合后,二者恰好反应,所得溶液显中性
D.四种溶液的pH由小到大的顺序是:②<①<④<③
答案 D
2.(2018宁夏大学附中月考,13)T ℃时,某浓度醋酸钠溶液的pH=10,下列说法一定正确的是( )
A.溶液中由水电离出的c(OH-)=1×10-10 mol·L-1
B.溶液中存在:c(H+)·c(OH-)=1×10-14
C.溶液中存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH)
D.溶液中存在:c(CH3COOH)+c(CH3COO-)=c(Na+)
答案 D
3.(2017河南南阳等六市联考,13)某温度下,向一定体积0.1 mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH [pOH=-lgc(OH-)]与pH的变化关系如图所示。下列说法不正确的是( )
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(N)+c(NH3·H2O)=c(Cl-)
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,变小
答案 B
4.(2017山东省实验中学一诊,14)下列叙述正确的是( )
A.常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大
B.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b
C.若将适量CO2通入0.1 mol·L-1 Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化):2c(C)+c(HC)=0.1 mol·L-1
D.常温下,已知醋酸的电离平衡常数为Ka,醋酸根离子的水解平衡常数为Kh,水的离子积为KW,则有Ka·Kh=KW
答案 D
5.(2016河南顶级名校调研,9)在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法中正确的是( )
A.a点对应的溶液中能大量存在:Fe3+、Na+、Cl-、S
B.b点对应的溶液中能大量存在:N、Ba2+、OH-、I-
C.c点对应的溶液中能大量存在:Na+、Ba2+、Cl-、C
D.d点对应的溶液中能大量存在:Na+、K+、S、Cl-
答案 D
考点二 溶液的酸碱性和pH 酸碱中和滴定
6.(2018湖北部分重点中学联考,7)常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是( )
A.滴定过程的任何时刻都存在:c(H+)+c(Na+)=c(OH-)+c(Cl-)
B.曲线b是氢氧化钠溶液滴定盐酸的滴定曲线
C.氢氧化钠溶液的物质的量浓度为0.1 mol·L-1
D.P点时恰好完全中和,溶液呈中性
答案 B
7.[2018陕西渭南质量检测(Ⅰ),12]下列说法中不正确的是( )
A.常温下用pH=3的某酸溶液与pH=11的某碱溶液等体积混合,若混合溶液的pH=4,则反应生成的盐可能为强碱弱酸盐
B.石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),恒温条件下,向石灰乳悬浊液中加入少量生石灰时,pH增大
C.常温下pH=4的NH4Cl溶液和盐酸,由水电离的氢离子的浓度的比值为106∶1
D.常温下将0.1 mol·L-1的醋酸溶液加水稀释,溶液中c(CH3COO-)/c(CH3COOH)的值增大
答案 B
8.(2017江西红色七校一联,3)用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
答案 C
9.(2017湖南衡阳联考一,13)氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25 ℃时电离常数Kb=4.0×10-5。现用0.050 0 mol/L的稀硫酸滴定10 mL 0.100 0 mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是 ( )
A.甲胺在水中的电离方程式为:CH3NH2·H2O CH3N+OH-
B.A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C.C点溶液中=2.5×10-5
D.B点溶液中存在c(CH3NH2·H2O)>c(CH3N)>c(H+)>c(OH-)
答案 C
10.(2016河北衡水中学五调,7)常温下,在pH为3的FeCl3溶液、pH为11的Na2CO3溶液和pH为3的盐酸中水的电离程度分别为a1、a2、a3,则它们之间的关系是( )
A.a1a3
C.a1>a2>a3 D.无法判断
答案 B
B组 2016—2018年模拟·提升题组
(满分65分 时间:30分钟)
一、选择题(每小题6分,共36分)
1.(人教选4,三-2-4,变式)下列有关体积相同、pH相同的盐酸和CH3COOH溶液的说法正确的是( )
A.盐酸中水的电离程度更小
B.与足量镁粉反应时,CH3COOH溶液中放出的H2更多
C.与NaOH溶液中和时,盐酸消耗的NaOH更多
D.同倍稀释后两溶液的pH仍相同
答案 B
2.(2018江西西路片七校一联,9)下列叙述正确的是( )
A.某溶液的pH=7,则该溶液为中性溶液
B.一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小
C.常温下,反应X(s)+Y(l) 2Z(g)不能自发进行,则该反应的ΔH>0
D.常温下,0.01 mol·L-1的NaOH溶液中由水电离的c(H+)=1.0×10-2 mol·L-1
答案 C
3.(2017湖北四地七校联盟一联,6)常温下,下列说法中不正确的是 ( )
A.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1∶10
B.0.1 mol·L-1的CH3COOH溶液中,由水电离出的c(H+)为1×10-13 mol·L-1
C.pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合后所得溶液的pH<7
D.pH=2的H2SO4溶液和pH=2的CH3COOH溶液等体积混合后所得溶液的pH=2
答案 B
4.(2017江西九江十校第二次联考,13)25 ℃时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。下列说法错误的是( )
A.a点时溶液的pH<1
B.a点到b点的过程中,溶液的导电能力减弱
C.ab段上的点(不包括a点)均满足关系式:c(N)+c(Na+)<2c(S)
D.b点时离子浓度大小顺序为:c(Na+)>c(S)>c(N)> c(H+)> c(OH-)
答案 D
5.(2017湖南邵阳第二次联考,12)0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的关系如曲线Ⅰ所示,下列说法中正确的是( )
A.0.1 mol·L-1NH4Al(SO4)2溶液中c(N)大于等浓度的NH4HSO4溶液中c(N)
B.向100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中逐滴滴加80 mL 0.05 mol·L-1NaOH 溶液时,溶液pH的变化如曲线Ⅱ所示
C.升高温度,NH4Al(SO4)2溶液的pH减小,是因为升温促进了NH4Al(SO4)2的电离
D.20 ℃时,0.1 mol·L-1NH4Al(SO4)2溶液中:2c(S)-c(N)-3c(Al3+)=10-3mol·L-1
答案 B
6.(2016浙江台州中学期中,12)下列溶液中微粒的物质的量浓度关系不正确的是( )
A.若将适量CO2通入0.1 mol·L-1 Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化):2c(C)+c(HC)=0.1 mol·L-1
B.在25 ℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1 NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02)
C.常温下,将相同体积的pH=3的硫酸和pH=11的一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前c(C)>c(N)>c(NH4C)>c(N)
8.(2017福建四地六校一联,19)(15分)某化学兴趣小组设计实验测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数。
甲方案:
实验步骤为:①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为B g;③加热;④冷却;⑤称量坩埚和残余物的质量为C g;⑥重复③至⑤操作,直至恒重,质量为D g。
(1)坩埚中发生反应的化学方程式为 。
(2)计算Na2CO3质量分数必须用到的测定数据为 。
乙方案:
在天平上准确称取0.300 0 g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.100 0 mol/L的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3,即HCl+Na2CO3 NaHCO3+NaCl。重复上述操作两次。
(3)配制上述盐酸标准溶液100 mL,若用2.0 mol/L 盐酸进行配制,需用量筒量取该盐酸 mL;定容时俯视刻度线,将导致配制的溶液浓度 (填“偏高”“偏低”或“没有影响”)。
(4)根据下表数据,样品中ω(Na2CO3)= 。(用百分数表示,保留一位小数)
滴定次数
样品的质量/g
稀盐酸的体积
滴定前刻度/mL
滴定后刻度/mL
1
0.300 0
1.02
21.03
2
0.300 0
2.00
21.99
3
0.300 0
0.20
20.20
丙方案:
称取m g样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡胶管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气? (填“漏气”“不漏气”或“无法确定”)。实验时,装置A中c的作用是 , 。
(6)为了提高测定的准确性,应选用装置A和 (填写字母标号)进行实验。
答案 (1)2NaHCO3 Na2CO3+CO2↑+H2O↑(2分,条件没写扣1分)
(2)A、B和D(2分,多选、漏选均不给分)
(3)5.0(2分,填5不给分) 偏高(2分,填偏大、增大、变大均不给分)
(4)70.7%(2分,不是用百分数表示的不给分)
(5)无法确定(2分) 平衡气压,有利于液体流出(1分)
减小由于液体流下引起的体积误差(1分)
(6)C(1分)
C组 2016—2018年模拟·方法题组
方法 溶液pH的计算方法
1.(2018湖北鄂南高中等八校联考,13)室温时,下列各溶液的有关叙述中正确的是( )
A.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B.已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)b
D.0.1 mol·L-1 CH3COONa溶液中通入HCl至溶液pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)
答案 D
2.(2018陕西西安长安区一中六检,15)某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11,下列说法错误的是( )
A.该温度下水的离子积常数KW=10-13
B.该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,所得溶液为中性,若a=12,b=2,则Va∶Vb=1∶10
C.该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,所得溶液为中性,若a+b=12,则Va∶Vb=10∶1
D.该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,所得溶液为中性,若Va∶Vb=100∶1,则a+b=10
答案 D
3.(2017山东师大附中三模,13)常温下,下列叙述正确的是( )
A.pH=a的氨水,稀释至10倍后,其pH=b,则a=b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl溶液至恰好无色,则此时溶液的pH<7
C.向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,将减小
D.向10 mL pH=11的氨水中加入10 mL pH=3的H2SO4溶液,所得混合液的pH=7
答案 C
4.(2017黑龙江哈六中月考,10)在25 ℃时,向V mL pH=m的HNO3溶液中滴加pH=n的KOH溶液10V mL时,溶液中N的物质的量恰好等于加入的K+的物质的量,则m+n的值为( )
A.13 B.14 C.15 D.不能确定
答案 A
5.(2016黑龙江双鸭山一中月考,18)将pH=1的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为(忽略混合后溶液体积变化)( )
A.9 B.10 C.11 D.12
答案 C
6.(2016河北衡水中学五调,20)下列叙述正确的是( )
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.常温下,在滴有酚酞的氨水里,加入NH4Cl至溶液恰好呈无色,则此时溶液的pH<7
C.常温下,1.0×10-3 mol·L-1的盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0
D.常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
答案 D