- 2021-08-24 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省佛山市顺德区2019-2020学年高一下学期普通高中期末教学质量检测化学试题 Word版含答案
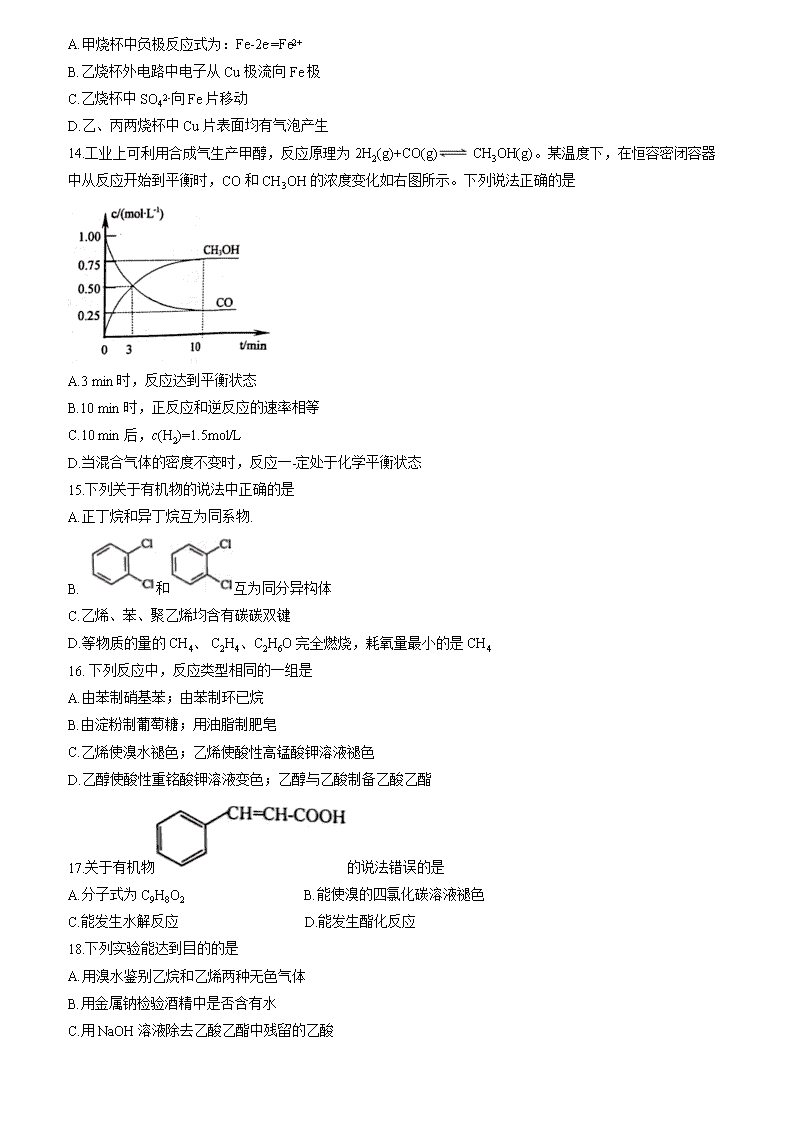
广东省佛山市顺德区2019-2020学年高一下学期普通高中期末教学 质量检测化学试题 说明: 1.本试卷包括两部分,第I部分为选择题共25小题50分,第II部分为非选择题共50分,全卷100分;考试时间90分钟。 2.请将第I部分答案用2B铅笔规范填涂在答题卡上,第II部分用钢笔或黑色签字笔在答题卡上作答,交卷时只交答题卡。 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Br 80 Sn 119 第I部分 (选择题共50分) 本部分包括25小题,每小题2分,共50分。每小题只有一个选项符合 题意。 1. 下列四种元素中,金属性最强的是 A.钾 B.镁 C.铝 D.钠 2.化学 与环境密切相关,下列说法错误的是 A. CO2、NO2、SO2都会导致酸雨的形成 B. NO、NO2等氮氧化物是光化学烟雾的主要污染物 C.生石灰能与SO2反应,可作煤燃烧时的脱硫剂 D.汽车排气系统中的三元催化器可减少尾气(CO、 NOx、碳氢化合物)污染 3.化学与生活、生产紧密相连,下列说法正确的是 A.油脂都不能使溴水褪色 B.可以用灼烧法鉴别棉织品和丝织品 C.淀粉和纤维素都可在人体内转化为葡萄糖 D.煤经过气化和液化等物理变化可以转化为清洁燃料 4.人工合成的18F在衰变过程中会生成稳定的不具放射性的18O。下列说法正确的是 A.18O核内中子数为8 B.18F 和18O互为同位素 C. 18F 和18O电子数相同而中子数不同 D.18F与19F最外层电子数相等 5.利用元素周期律判断,下列比较中正确的是 A.还原性:Li>Na>K B.原子半径:Cl>S>Na C.酸性:HClO4>H3PO4>H2CO3 D.热稳定性:H2O>CH4>NH3 6.化学键类 型完全相同的一组化合物是 A. CCl4 和NH4Cl B. CaCl2 和Na2S C. H2O2 和Na2O2 D. CO2和CaO 7.短周期元素W、X、Y、Z在周期表中的相对位置如图所示,其中Z元素原子的最外层电子数是其K层电子数的3倍。下列说法不正确的是 A.原子半径W<Y<X B. W的氧化物均难溶于水 C.简单氢化物的沸点:W>Y D.最高价氧化物对应的水化物的酸性:W>X 8.下列叙述正确的是 A.Li、Na、K、Rb四种单质中,Rb的熔点最高 B.氯化钙的电子式为 C.离子化合物一定只含离子键 D. HF的热稳定性强于HCl,说明非金属性:F>Cl 9. CH4-CO2 催化重整的反应为CH4+ CO22CO+ 2H2,该反应不仅可以得到合成气,还对温室气体的减排具有重要意义。设NA为阿伏加德罗常数的值,下列叙述错误的是 A.标准状况下, 2.24 LCH4中共价键的数目为0.4NA B.常温常压下,23 g 14CO2中含有的电子数目为11NA C.0.1 mol CH4和0.1 mol CO2在一定条件下充分反应,生成气体分子总数为0.4NA D.可在过渡元素中为CH4-CO2催化重整反应寻找合适的催化剂 10.下列反应符合右图所示能量变化的是 A.家庭中用天然气炒菜做饭 B.实验室用生石灰干燥氨气 C.葡萄糖在人体内氧化分解 D.绿色植物通过光合作用合成葡萄糖 11.下列生活和生产中的做法或事实,与调控反应速率无关的是 A.牛奶放在冰箱中冷藏 B.使用加酶洗衣粉洗涤衣物 C.汽车的橡胶轮胎中要添加抑制剂 D.工业合成氨时,及时将氨气液化分离 12.可逆反应2A(g)+B(g)3C(g)+4D(g),在不同条件下反应速率最快的是 A. v(A)=0.5 mol/(L·min) B. v(B)=0.3 mol/(L·min) C. v(C)=0.8 mol/(L·min) D. v(D)=1.0 mol/(L·min) 13.甲、乙丙三烧杯中均盛有相同物质的量浓度的稀硫酸,下列说法正确的是 A.甲烧杯中负极反应式为:Fe-2e-=Fe2+ B.乙烧杯外电路中电子从Cu极流向Fe极 C.乙烧杯中SO42-向Fe片移动 D.乙、丙两烧杯中Cu片表面均有气泡产生 14.工业上可利用合成气生产甲醇,反应原理为2H2(g)+CO(g) CH3OH(g)。某温度下,在恒容密闭容器中从反应开始到平衡时,CO和CH3OH的浓度变化如右图所示。下列说法正确的是 A.3 min 时,反应达到平衡状态 B.10 min 时,正反应和逆反应的速率相等 C.10 min 后,c(H2)=1.5mol/L D.当混合气体的密度不变时,反应一-定处于化学平衡状态 15.下列关于有机物的说法中正确的是 A.正丁烷和异丁烷互为同系物. B. 和互为同分异构体 C.乙烯、苯、聚乙烯均含有碳碳双键 D.等物质的量的CH4、 C2H4、C2H6O完全燃烧,耗氧量最小的是CH4 16. 下列反应中,反应类型相同的一组是 A.由苯制硝基苯;由苯制环已烷 B.由淀粉制葡萄糖;用油脂制肥皂 C.乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 D.乙醇使酸性重铭酸钾溶液变色;乙醇与乙酸制备乙酸乙酯 17.关于有机物的说法错误的是 A.分子式为C9H8O2 B.能使溴的四氯化碳溶液褪色 C.能发生水解反应 D.能发生酯化反应 18.下列实验能达到目的的是 A.用溴水鉴别乙烷和乙烯两种无色气体 B.用金属钠检验酒精中是否含有水 C.用NaOH溶液除去乙酸乙酯中残留的乙酸 D.用等物质的量的甲烷和氯气在光照条件下反应,制取纯净的CH3Cl 19.下列关于基本营养物质的说法不正确的是 A.蔗糖和麦芽糖均为双糖 B.植物油氢化过程中发生了加成反应 C.可用淀粉溶液检验食盐中是否加碘 D.葡萄糖能与新制氢氧化铜悬浊液反应产生砖红色沉淀 20.海水中溴元素的含量一般为0.067 g/L,晒盐后的苦卤中含有较高浓度的溴离子,向其中通入氯气可制得单质溴。下列说法不正确的是 A.向苦卤中通入氯气发生反应的离子方程式为:2Br~+Cl2=2Cl-+Br2 B.向苦卤中通入氯气时,溴元素化合价升高,氯气作氧化剂 C.将单质溴从溴水中分离出来,可用裂化汽油进行萃取 D.从海水中提取溴,一般要经过浓缩、氧化、提取三个步骤 21.下列关于金属冶炼的说法不正确的是 A.金属冶炼的方法选择是由金属的活泼性决定的 B.工业上常用电解熔融氯化物的方法米冶炼钠、镁、铝 C.热还原法冶炼金属常用的还原剂有焦炭、一氧化碳和氢气 D.金属冶炼的本质是找到合适的还原剂(或还原手段)将金属属从其化合物中还原出来 22.下列实验装置能达到实验目的的是 A.图1装置实现化学能转化为电能 B.图2比较不同催化剂对化学反应速率的影响 C.图3验证钠和水的反应为放热反应 D.图4可用于比较非金属性: Cl>C>Si 23.下列叙述I和II均正确且有因果关系系的是 选项 叙述I 叙述II A NO难溶于水、易被O2氧化 收集NO只能采用排水法 B SO2能使溴水褪色 SO2具有漂白性 C 浓硫酸具有强氧化性 不能用浓硫酸干燥SO2 D 煤中含有苯、甲苯等芳香烃 通过煤的干馏可获得苯、甲苯等芳香烃 24.下列有关石油和天然气的叙述不正确的是 A.石油和天然气都是一次能源 B.石油的分馏、裂化和裂解都是化学变化 C.可燃冰是一种清洁能源,其成分是甲烷水合物 D.天然气作为化工原料,常用于合成氨和生产甲醇 25.下列装置所示的实验中,能达到实验目的是 A B C D 除去CH4中的乙烯 收集NO2气体 制取SO2并检验其漂白性 实验室制取NH3 第II部分 (非选择题 共50分) 26. (10 分) (1)从能量的角度看,形成生成物中的化学键要______(填“吸收”或"放出”,下同)能量;已知石墨比金刚石稳定,所以石墨转化为金刚石的反应要____热量。 (2)现有甲、乙丙三种金属片:①把甲、乙用导线连接后同时浸入稀硫酸中;Z上有气泡产生,则___ (填“甲”或“乙”) 发生氧化反应;②将乙、丙用导线连接后局时浸入稀硫酸中,电子的流动方向为乙→导线→丙。则三种金属的活动性由强到弱的顺序是_________________。 (3)短周期元素X的最高价氧化物的水化物化学式为HXO4,则其气态氢化物的化学式为______;在周期表中第_____周期第_____族。 27.(11分)1869年门捷列夫发表了第一张元素周期表,150 多年里科学家根据元素间的规律创造了各式各样的元素周期表。以下为螺旋式元素周期表的部分结构,请根据表中信息回答下列相关问题。 (1)元素①~⑧中,化学性质最不活泼的元素是______ (写元素符号), 元素①的氢化物中具有正四面体结构的是_______(写化学式)。 (2)②与⑤组成的化合物属于__________(填“离子化合物”或“共价化合物”)。 (3)②、③、④的简单离子半径由大到小的顺序为____________(用离子符号表示)。 (4)③的单质能与①的最高价氧化物反应,生成①的单质,反应的化学方程式为_________________。 (5)门捷列夫在绘制元素周期表时,预言了一种当时未被发现的元素“类硅”,后来被德国化学家文克勒发现,并命名为“锗(Ge)”。图中①~⑧中,表示锗元素的是___,非金属性Si_Ge (用“>”或“<”表示)。 (6)关于螺旋式元素周期表,下列说法不正确的是_______________。 a.元素⑧的原子结构示意图为 b.①~⑧所形成的最高价氧化物的水化物中, ⑥的酸性最强 c.图中灰色部分为第四周期过渡金属区域 d.螺旋式元素周期表解决了矩形周期表中部分原子序数相邻元素间距离远的问题 28. (8分)海洋植物如海带、海藻中含有丰丰富的碘元素,碘元素以碘离子的形式存在。实.验室里从海带中提取碘的流程如图。 (1)操作①为分液,若试剂a为苯,则有机溶液需从分液漏斗______(填“上口倒出”或“下口放出”)。 (2)加入双氧水的作用是__________,操作③的名称是___________。 (3)I-和IO3-在酸性条件下生成I2的离子方程式是_______________。 (4)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是_______________。 29. (11 分)已知D是一种厨房常用的调味品,E是具有果香气味的油状液体,F是一-种塑料的主要成分。相关物质的转化关系如下图所示,回答下列问题: (1)①的反应类型为_______;③的反应条件是__________;F的结构简式为___________ 。 (2)B和D中官能团的名称分别是___________和__________。 (3)仿照反应固,写出CH3COOH与HOCH2CH2OH按物质的量之比为2:1反应的化学方程式______________。 (4)写出含有-COOH的B的所有同分异构体的结构简式__________________。 (5)下列有关A~F的说法正确的是____________。 a.A中所有原子共平面, b.B中有3种氢原子, c. B、c、D均能与钠反应放出氢气;d. E难溶于水且密度比水大; e. F在自然界中易降解 30. (10分)诺贝尔化学奖特别青睐合成氨相关研究,曾3次颁奖于该领域研究成果。当前,氨的合成与应用仍然受到广大化学家的重点关注。回答下列问题: I.研究发现,一定温度和压强下,在催化剂表面,反应N2(g)+3H2 (g) 2NH3(g)的相关能量(E) 变化如下图所示: (1)每生成2 mol NH3时_______(填放出”或“吸收”)______kJ的能量。 (2)在恒容密闭容器中发生上述反应,能说明该反应达到平衡状态的是___________。 a.容器内混合气体的质量不再变化 b. c(N2):c(H2) :c(NH3)=1:3:2 c.容器内NH3的浓度不再变化 d.容器内混合气体的物质的量不再变化 (3)一定温度下,在体积为2 L的密团容器中,充入1 mol N2和3 mol H2模拟工业合成氨的反应。10 min 时,测得容器中气体的总物质的量是起始时的0.8倍,用NH3的浓度变化表示的化学反应速率为______。 II.某氨-空气燃料电池的工作原理是氨气与氧(生成一种常见的无毒气体和水,其装置如下图所示: (4)溶液c最好选择_________(填“酸性”、“碱性” 或“中性”)溶液。 (5)正极的电极反应式为______________。查看更多