- 2021-08-23 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习非选择必考题标准练4含解析
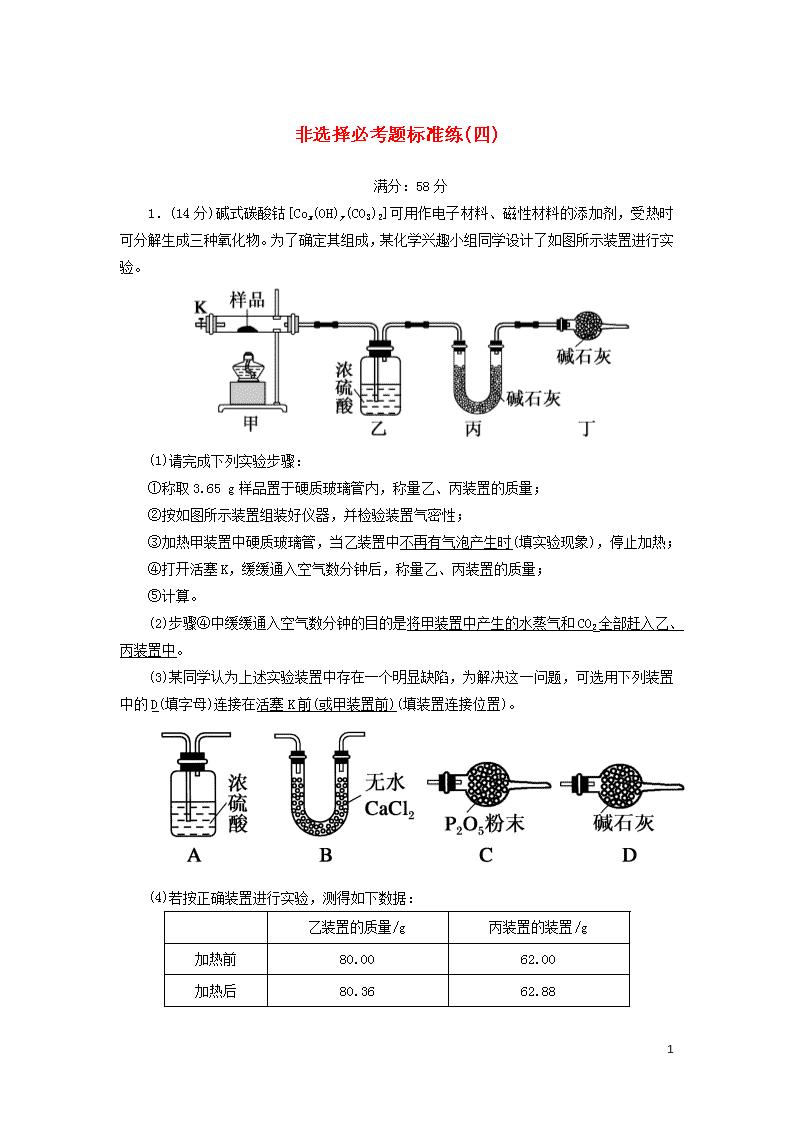
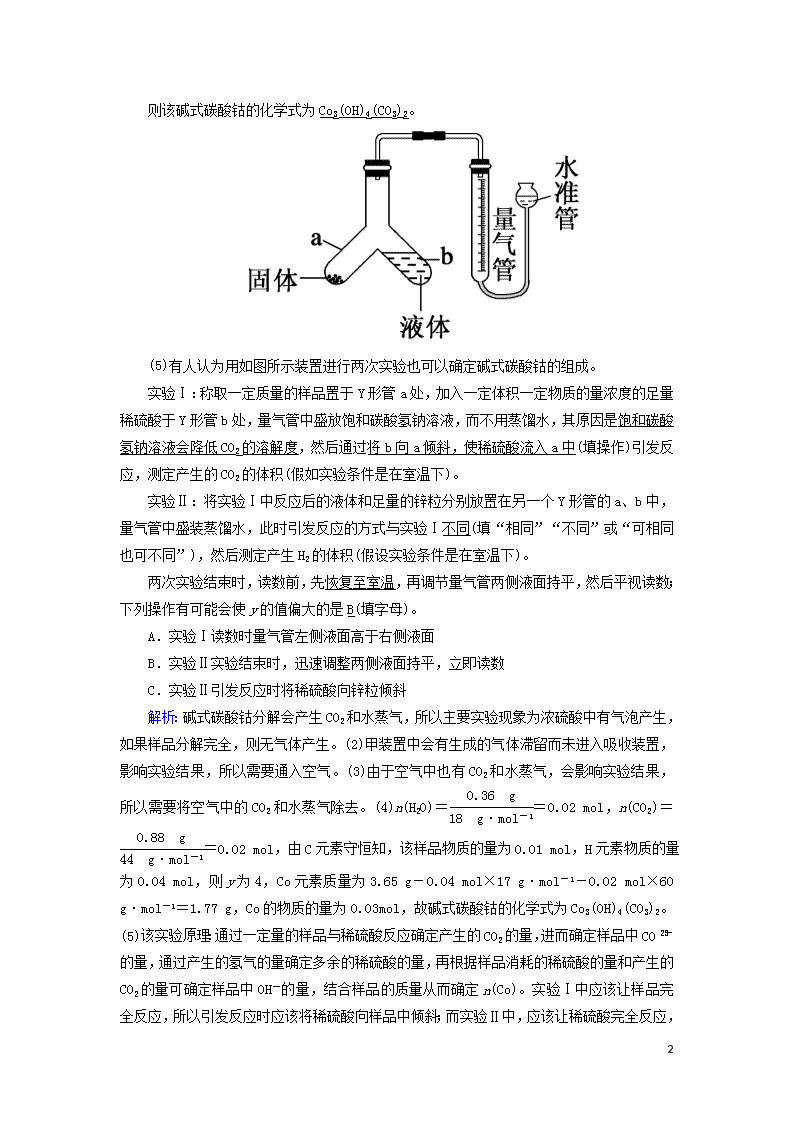
非选择必考题标准练(四) 满分:58分 1.(14分)碱式碳酸钴[Cox(OH)y(CO3)2]可用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。 (1)请完成下列实验步骤: ①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量; ②按如图所示装置组装好仪器,并检验装置气密性; ③加热甲装置中硬质玻璃管,当乙装置中不再有气泡产生时(填实验现象),停止加热; ④打开活塞K,缓缓通入空气数分钟后,称量乙、丙装置的质量; ⑤计算。 (2)步骤④中缓缓通入空气数分钟的目的是将甲装置中产生的水蒸气和CO2全部赶入乙、丙装置中。 (3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的D(填字母)连接在活塞K前(或甲装置前)(填装置连接位置)。 (4)若按正确装置进行实验,测得如下数据: 乙装置的质量/g 丙装置的装置/g 加热前 80.00 62.00 加热后 80.36 62.88 9 则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2。 (5)有人认为用如图所示装置进行两次实验也可以确定碱式碳酸钴的组成。 实验Ⅰ:称取一定质量的样品置于Y形管a处,加入一定体积一定物质的量浓度的足量稀硫酸于Y形管b处,量气管中盛放饱和碳酸氢钠溶液,而不用蒸馏水,其原因是饱和碳酸氢钠溶液会降低CO2的溶解度,然后通过将b向a倾斜,使稀硫酸流入a中(填操作)引发反应,测定产生的CO2的体积(假如实验条件是在室温下)。 实验Ⅱ:将实验Ⅰ中反应后的液体和足量的锌粒分别放置在另一个Y形管的a、b中,量气管中盛装蒸馏水,此时引发反应的方式与实验Ⅰ不同(填“相同”“不同”或“可相同也可不同”),然后测定产生H2的体积(假设实验条件是在室温下)。 两次实验结束时,读数前,先恢复至室温,再调节量气管两侧液面持平,然后平视读数;下列操作有可能会使y的值偏大的是B(填字母)。 A.实验Ⅰ读数时量气管左侧液面高于右侧液面 B.实验Ⅱ实验结束时,迅速调整两侧液面持平,立即读数 C.实验Ⅱ引发反应时将稀硫酸向锌粒倾斜 解析:碱式碳酸钴分解会产生CO2和水蒸气,所以主要实验现象为浓硫酸中有气泡产生,如果样品分解完全,则无气体产生。(2)甲装置中会有生成的气体滞留而未进入吸收装置,影响实验结果,所以需要通入空气。(3)由于空气中也有CO2和水蒸气,会影响实验结果,所以需要将空气中的CO2和水蒸气除去。(4)n(H2O)==0.02 mol,n(CO2)==0.02 mol,由C元素守恒知,该样品物质的量为0.01 mol,H元素物质的量为0.04 mol,则y为4,Co元素质量为3.65 g-0.04 mol×17 g·mol-1-0.02 mol×60 g·mol-1=1.77 g,Co的物质的量为0.03mol,故碱式碳酸钴的化学式为Co3(OH)4(CO3)2。(5)该实验原理:通过一定量的样品与稀硫酸反应确定产生的CO2的量,进而确定样品中CO的量,通过产生的氢气的量确定多余的稀硫酸的量,再根据样品消耗的稀硫酸的量和产生的CO2的量可确定样品中OH-的量,结合样品的质量从而确定n 9 (Co)。实验Ⅰ中应该让样品完全反应,所以引发反应时应该将稀硫酸向样品中倾斜;而实验Ⅱ中,应该让稀硫酸完全反应,所以引发反应时应该将锌粒向稀硫酸中倾斜;测定CO2体积时,由于CO2能溶于水,所以可用饱和碳酸氢钠溶液来降低CO2的溶解度;而且测量气体体积时应该注意三点:先恢复至室温、再调节液面持平、然后平视读数。 2.(14分)V2O5是接触法制硫酸的催化剂。工业上用钒炉渣(主要含有V2O3·FeO,还含少量SiO2、P2O5等杂质)提取V2O5的流程如下: (1)焙烧常采用“加压”的方法,其目的是增大空气浓度,提高反应速率。 X是偏钒酸铵分解生成五氧化二钒的副产物且X在常温常压下呈气态,X的电子式为。 (2)“焙烧”的目的是将V2O3·FeO转化成可溶性的NaVO3和Fe2O3,写出化学方程式4V2O3·FeO+5O2+4Na2CO38NaVO3+4CO2+2Fe2O3。 (3)写出“沉钒”的离子方程式NH+VO===NH4VO3↓。 (4)工业上利用铝热反应冶炼钒,5.4 t铝理论上可以冶炼1.2×105 mol V。 (5)用硫酸镁溶液除去硅、磷时,滤渣的主要成分是MgSiO3、Mg3(PO4)2,它们的溶解度随温度的变化忽略不计。 已知:常温下,Ksp(MgSiO3)=2.4×10-5,Ksp[Mg3(PO4)2]=2.7×10-27。 ①如果滤液中c(SiO)=0.08 mol·L-1,则c(PO)=1.0×10-8 mol·L-1。 ②硅、磷去除率与温度的关系如图所示。 除杂时,随着温度升高,硅元素的去除率升高,其原因是随着温度升高,SiO水解程度增大,生成的硅酸增多; 磷的去除率降低,其原因是随着温度升高,Mg2+水解程度增大,生成的磷酸镁减少。 9 解析:(1)联系压强对化学反应速率的影响,对于有空气、氧气等气体参与的化工反应,都可以采用“加压”的方法提高气体浓度,从而加快化学反应速率。分析题意可知,偏钒酸铵分解,反应前后各元素化合价没有变化,根据原子守恒知,副产物为氨气、水,常温常压下,水为液体,故X为氨气。(2)V2O3·FeO被氧化,氧气被还原,生成物为NaVO3、氧化铁、二氧化碳。(3)“沉钒”说明偏钒酸铵难溶于水。(4)n(Al)==2.0×105 mol,利用铝热反应冶炼钒的化学方程式为3V2O5+10Al5Al2O3+6V,则n(V)===1.2×105 mol。(5)c(Mg2+)= mol·L-1=3.0×10-4 mol·L-1,则c(PO)= mol·L-1=1.0×10-8 mol·L-1。②Mg2+、SiO是能水解的离子,且水解反应是吸热反应,故升高温度,硅酸根离子水解程度增大,生成的硅酸增多,硅的去除率升高,而升高温度,镁离子水解程度增大,生成的磷酸镁减少,磷的去除率降低。 3.(15分)氮及其化合物的转化对工农业生产及环境保护有重要的意义。 (1)下面是氮的氧化物在几种不同情况下的转化: ①已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1 2NO(g)+O2(g)2NO2(g) ΔH=-113.0 kJ·mol-1 则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为SO2(g)+NO2(g)NO(g)+SO3(g) ΔH=-41.8 kJ·mol-1。 ②a.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使其反应达到平衡,正反应速率随时间变化的示意图如图1所示。反应在c点未到(填“达到”或“未到”)平衡状态。 b.开始时,分别在该容器中加入Ⅰ:2 mol SO2(g)和2 mol NO2(g);Ⅱ:2 mol SO3(g)和2 mol NO(g)。则反应达到平衡时,平衡常数:Ⅰ<(填“>”“=”或“<”)Ⅱ。 (2)常温下,向浓度为0.1 mol·L-1体积为V 9 L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸体积的变化曲线如图2所示,d点处两种溶液恰好完全反应。根据图2回答下列问题。 ①b、c、d三点对应的溶液中,水电离的c(OH-)由大到小的顺序为d>c>b。 ②滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有cd。 a. b. c. d. ③该温度时氨水的电离平衡常数K=10-5。 (3)氮的氧化物易污染环境,可用氢氧化钠溶液吸收。发生的反应为: 2NaOH+NO+NO2===2NaNO2+H2O、 2NaOH+2NO2===NaNO3+NaNO2+H2O。 将反应混合液和氢氧化钠溶液分别加到如图3所示的电解槽中进行电解,A室产生N2。 ①电极Ⅱ是阳极,B室产生的气体是O2。 ②A室NO发生的电极反应是2NO+6e-+4H2O===8OH-+N2↑。 解析:(1)①已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1 a,2NO(g)+O2(g)2NO2(g) ΔH=-113.0 kJ·mol-1 b,根据盖斯定律,由-可得,SO2(g)+NO2(g)NO(g)+SO3(g) ΔH=-=-41.8 kJ·mol-1。②a.反应达到平衡的标志是v正=v逆,且不再变化,而c点对应的v正 9 还在改变,故反应在c点未到平衡状态。b.若容器恒温恒容,则平衡常数:Ⅰ=Ⅱ,而实际上容器恒容绝热,SO2(g)+NO2(g)NO(g)+SO3(g) ΔH<0,若在该容器中加入2 mol SO2(g)和2 mol NO2(g),则反应放出热量;若在容器中加入2 mol SO3(g)和2 mol NO(g),则反应吸收热量,据此分析平衡常数:Ⅰ<Ⅱ。 (2)①在b点对应的溶液中,溶质为一水合氨和氯化铵,且二者浓度相等,由题图2可知,溶液呈碱性,则一水合氨的电离程度大于氯化铵的水解程度,此时水的电离受到抑制,在c点对应的溶液中,溶质仍为一水合氨和氯化铵,但二者浓度不相等,由题图2知,c点溶液呈中性,则此时一水合氨的电离程度等于氯化铵的水解程度,水的电离不受影响,在d点对应的溶液中,溶质为氯化铵,氯化铵发生水解,溶液呈酸性,对水的电离起促进作用,所以b、c、d三点对应的溶液中,水电离的c(OH-)大小顺序为d>c>b。②滴定时,由b点到c点的过程中,溶液碱性减弱,酸性增强。=,由b点到c点的过程中,c(OH-)不断减小,故该值增大,a不符合题意,由b点到c点的过程中,c(H+)不断增大,c(OH-)不断减小,的值逐渐增大,故b不符合题意;为一水合氨的电离平衡常数,因Kb(NH3·H2O)只与温度有关,滴定过程中温度不变,则的值不变,故c符合题意;的值等于铵根离子的水解平衡常数,b点到c点过程中不变,故d符合题意。③未加盐酸时,氨水浓度为0.1 mol·L-1,溶液的pH=11,则溶液中c(OH-)= mol·L-1=0.001 mol·L-1,水的电离程度较小,溶液中c(OH-)≈c(NH),又一水合氨的电离程度较小,则c(NH3·H2O)≈0.1 mol·L-1,氨水的电离平衡常数K===10-5。(3)由A室产生N2,可知A室的电解质溶液为NaNO3和NaNO2的混合溶液,NO在电极Ⅰ上放电生成N2,则电极Ⅰ为阴极,电极Ⅱ为阳极,B室的电解质溶液为NaOH溶液,OH-在电极Ⅱ上放电生成O2。 4.(15分)己二酸环酯类化合物是一种重要的化工试剂。其一种合成路线如下: 9 已知:生成试剂Ⅰ的反应为 回答下列问题: (1)按系统命名法,CH2(COOC2H5)2的名称为丙二酸二乙酯。 (2)A生成B的反应类型为加成反应,化合物E中含氧官能团的名称为酯基,F的分子式为C9H14O4。 9 (4)芳香族化合物G为E的同分异构体,符合下列要求的G的构体有10种(不考虑立体异构)。 Ⅰ.1 mol G可与2 mol Na2CO3反应 Ⅱ.含有官能团—NH2 Ⅲ.苯环上有三个取代基,且苯环上有两种等效氢 其中核磁共振氢谱有五组峰,峰面积之比为6∶2∶2∶2∶1的结构简式为。 (5)写出用甲醛、乙醛和CH2(COOC2H5)2为原料制备化合物的合成路线(其他试剂任选)。 答案: 解析: 9 (1)该酯的名称为丙二酸二乙酯。(2)A生成B的反应类型为加成反应。E中含氧官能团的名称为酯基。F的分子式为C9H14O4。(3)通过观察可知,D生成E为酯化反应,因而化学方程式为 +H2O。(4)根据芳香族化合物G为E的同分异构体,1 mol G可与2 molNa2CO3反应可知,G的苯环上有两个酚羟基,又其苯环上有三个取代基,且苯环上有两种等效氢,则—C3H8N为苯环上的一个取代基且G为对称结构。两个酚羟基处于邻位和对位时都不符合要求,当两个酚羟基处于间位时,—C3H8N在苯环上的位置有2种,又因含有—NH2,故—C3H8N的结构有—CH2CH2CH2NH2、—CH(NH2)CH2CH3、—CH(CH3)CH2NH2、 —CH2CH(CH3)NH2、, 共5种,故符合条件的构体有10种;其中核磁共振氢谱有五组峰,且峰面积之比为6∶2∶2∶2∶1的结构简式有,2种。 9查看更多