- 2021-07-06 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习非选择必考题标准练9含解析
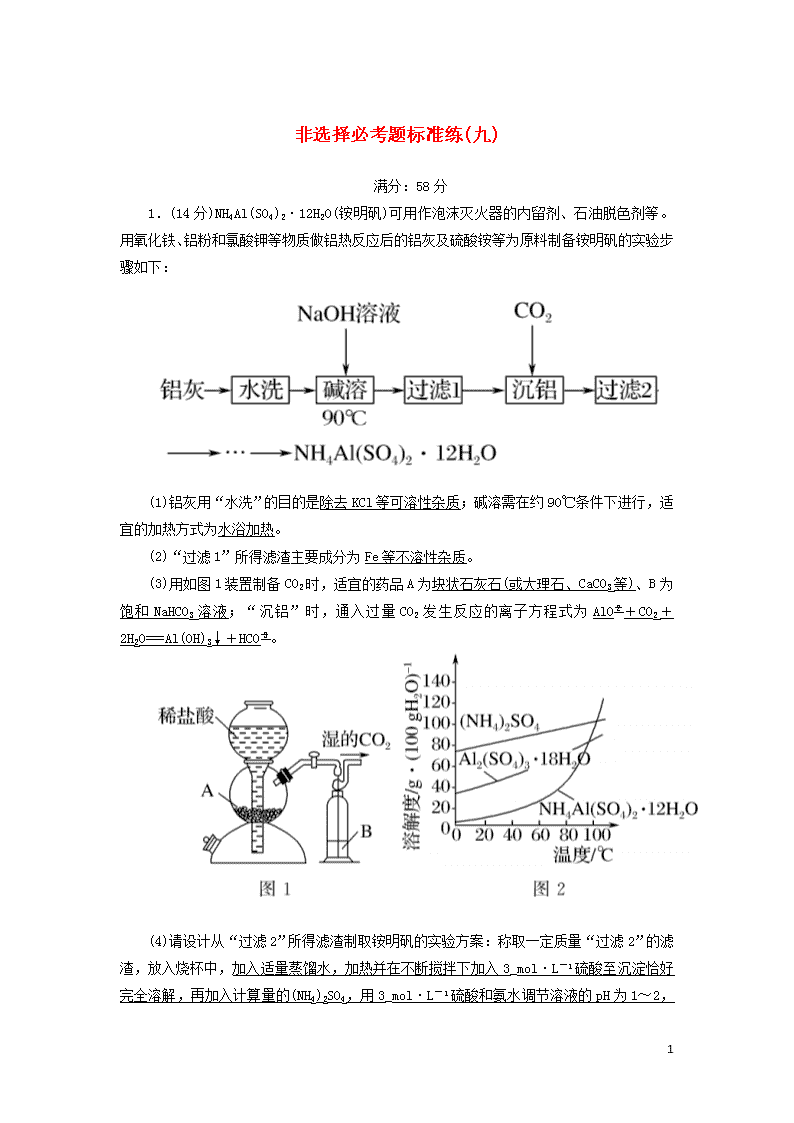
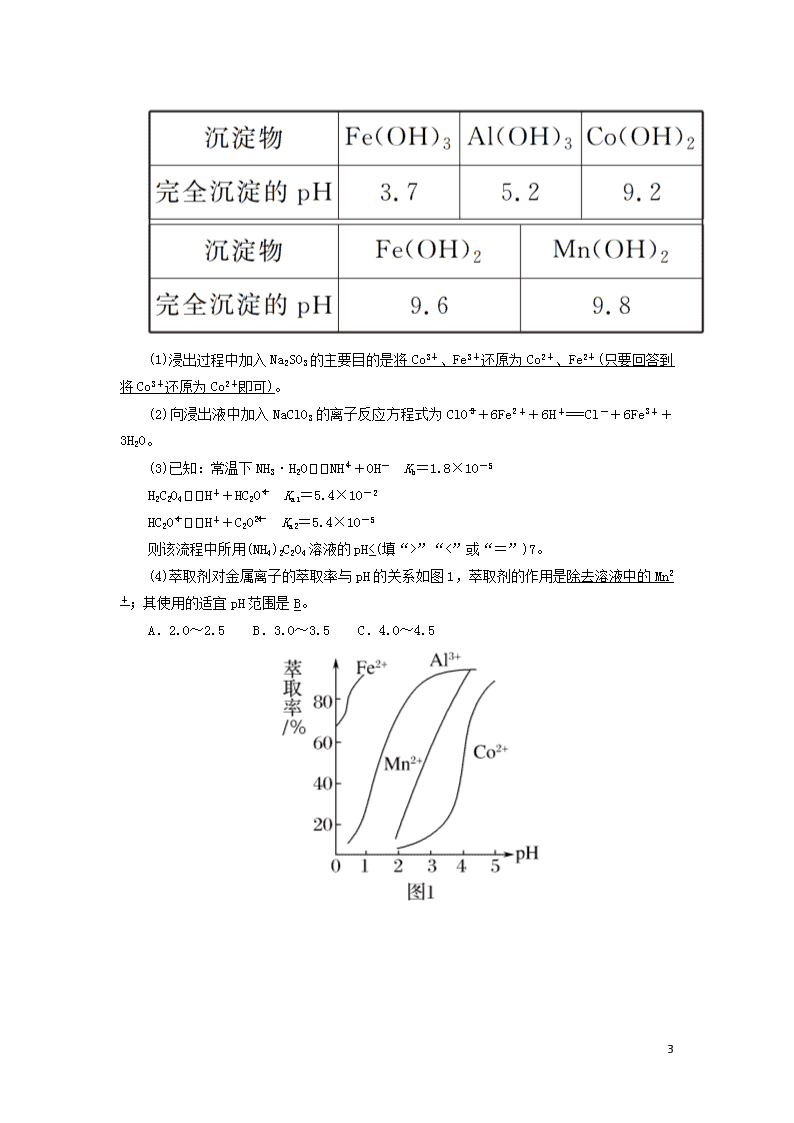
非选择必考题标准练(九) 满分:58分 1.(14分)NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。用氧化铁、铝粉和氯酸钾等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验步骤如下: (1)铝灰用“水洗”的目的是除去KCl等可溶性杂质;碱溶需在约90 ℃条件下进行,适宜的加热方式为水浴加热。 (2)“过滤1”所得滤渣主要成分为Fe等不溶性杂质。 (3)用如图1装置制备CO2时,适宜的药品A为块状石灰石(或大理石、CaCO3等)、B为饱和NaHCO3溶液;“沉铝”时,通入过量CO2发生反应的离子方程式为AlO+CO2+2H2O===Al(OH)3↓+HCO。 (4)请设计从“过滤2”所得滤渣制取铵明矾的实验方案:称取一定质量“过滤2”的滤渣,放入烧杯中,加入适量蒸馏水,加热并在不断搅拌下加入3_mol·L-1硫酸至沉淀恰好完全溶解,再加入计算量的(NH4)2SO4,用3_mol·L-1 13 硫酸和氨水调节溶液的pH为1~2,蒸发浓缩,冷却结晶,静置,过滤、洗涤、晾干,得到铵明矾。 [实验中须使用到3 mol·L-1硫酸、(NH4)2SO4、蒸馏水、氨水、pH试纸;已知:NH4Al(SO4)2饱和溶液的pH约为1.5,几种物质的溶解度曲线见图2]。 解析:铝灰水洗的目的是洗去表面可溶性杂质,在90 ℃水浴条件下,用NaOH溶液进行溶解,Al2O3+2OH-===2AlO+H2O,过滤除去铁等不溶性杂质,向滤液中通入CO2,AlO+CO2+2H2O===Al(OH)3↓+HCO,提纯得到较纯的Al(OH)3,再制备NH4Al(SO4)2。 (1)铝灰用“水洗”的目的是除去KCl等可溶性杂质,碱溶时,需在约90 ℃条件下进行,适宜的加热方式为90 ℃水浴加热。(2)“过滤1”所得滤渣主要成分为铁等不溶杂质。(3)制备CO2时,适宜的药品A为块状石灰石(或大理石、CaCO3等)、B为饱和NaHCO3溶液除去挥发出来的HCl;“沉铝”时,通入过量CO2发生反应的离子方程式为AlO+CO2+2H2O===Al(OH)3↓+HCO。(4)称取一定质量“过滤2”的滤渣放入烧杯中,主要成分为Al(OH)3,加入适量蒸馏水,加热并在不断搅拌下加入3 mol·L-1硫酸至沉淀恰好完全溶解,再加入计算量的(NH4)2SO4,用3 mol·L-1硫酸和氨水调节溶液的pH为1~2,蒸发浓缩,冷却结晶,静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O。 2.(14分)草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2杂质)制取CoC2O4·2H2O的工艺流程如下: 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+; ②酸性条件下,ClO不会氧化Co2+,ClO转化为Cl-; ③部分阳离子以氢氧化物形式沉淀时溶液的pH见表: 13 (1)浸出过程中加入Na2SO3的主要目的是将Co3+、Fe3+还原为Co2+、Fe2+(只要回答到将Co3+还原为Co2+即可)。 (2)向浸出液中加入NaClO3的离子反应方程式为ClO+6Fe2++6H+===Cl-+6Fe3++3H2O。 (3)已知:常温下NH3·H2ONH+OH- Kb=1.8×10-5 H2C2O4H++HC2O Ka1=5.4×10-2 HC2OH++C2O Ka2=5.4×10-5 则该流程中所用(NH4)2C2O4溶液的pH<(填“>”“<”或“=”)7。 (4)萃取剂对金属离子的萃取率与pH的关系如图1,萃取剂的作用是除去溶液中的Mn2+;其使用的适宜pH范围是B。 A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 13 (5)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600 ℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是Co3O4。 解析:(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,还原为Fe2+、Co2+。(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO+6Fe2++6H+===6Fe3++Cl-+3H2O。(3)盐类水解,谁强显谁性,NH3·H2ONH+OH- Kb=1.8×10-5,HC2OH++C2O Ka2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解程度大于草酸根离子水解程度,溶液呈酸性,即pH<7。(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液pH在3.0~3.5,可使Mn2+被尽量多地萃取,同时又防止Co2+被萃取,故选B。(5)由图可知,C点钴氧化物质量为8.03 g,0.1 mol 钴元素质量为5.9 g,氧化物中氧元素质量为8.03 g-5.9 g=2.13 g,则氧化物中钴原子与氧原子物质的量之比为0.1 mol∶≈3∶4,故C点所示产物化学式为Co3O4。 3.(15分)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。 (1)催化剂常具有较强的选择性。已知: 反应Ⅰ:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH1=-905 kJ·mol-1 反应Ⅱ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH2=-1 266.6 kJ·mol-1 写出NO分解生成N2与O2的热化学方程式:2NO(g)N2(g)+O2(g) ΔH=-180.8 kJ·mol-1。 13 (2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按下表相应量充入气体,发生2N2O(g)2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O平衡转化率如图1所示。 13 ①该反应的ΔH>(填“>”“=”或“<”)0。 ②图中A、B、C三点处容器内的总压强,由大到小的顺序是p(C)>p(B)>p(A)(或C>B>A)。 ③容器Ⅳ在470 ℃进行反应时,起始速率:v正(N2O)>(填“>”“=”或“<”)v逆(N2O)。 (3)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,在20 L密闭容器中充入1 mol NH3和2 mol O2,测得一定时间内有关物质的量关系如图2: ①该催化剂在低温时选择反应Ⅱ(填“Ⅰ”或“Ⅱ”)。 ②C点比B点所产生的NO的物质的量少的原因可能是 该反应为放热反应,温度升高,平衡向逆反应方向移动或催化剂活性降低。 解析:(1)NO分解生成N2与O2的方程式为2NO(g)N2(g)+O2(g),根据已知的反应Ⅰ和反应Ⅱ,要得到该方程,则,即ΔH== kJ·mol-1=-180.8 kJ·mol-1。 (2)①根据图象,温度升高,转化率增大,则平衡向右移动,说明正反应方向吸热,则反应的ΔH>0。 ②A、B、C三点中N2O的转化率相同,则容器中反应物、生成物的量均相同,则容器的压强取决于容器的体积,根据图象,相同温度时:转化率大小为:Ⅰ>Ⅱ>Ⅲ,则反应正向进行的程度为:Ⅰ>Ⅱ>Ⅲ,且该反应为气体分子数增加的反应,增大容器体积,减小压强平衡向右移动,则说明容器体积大小为:Ⅰ>Ⅱ>Ⅲ,A、B、C三点温度:C>B>A,故A、B、C三点处容器内的总压强由大到小的顺序是p(C)>p(B)>p(A)。 ③Ⅱ中在470 ℃下达到平衡时N2O的转化率是0.6,则该反应在470 ℃下平衡常数是=0.067 5,容器Ⅳ在470 ℃进行反应时,浓度商==0.04<0.067 5,所以反应向正反应方向进行,则起始速率:v正(N2O)>v逆(N2O)。 (3)①根据图象,在低温时,N2的量相对多一些,而N2 13 是反应Ⅱ的生成物,故该催化剂在低温时选择反应Ⅱ。 ②C点比B点所产生的NO的物质的量少的原因可能是平衡的逆向移动等原因。根据图象,该催化剂在高温时选择反应Ⅰ,而反应Ⅰ为放热反应,达到平衡后,温度升高平衡向左移动,使得C点比B点所产生的NO的物质的量少;或者可能是由于温度升高催化剂失去了活性等原因。 4.(15分)有机物F是一种香料,其合成路线如图所示: 13 (1)C的名称为苯甲醇,试剂X的结构简式为CH3CHClCOOH,步骤Ⅵ的反应类型为取代(或酯化)反应。 (2)步骤Ⅰ的反应条件为Cl2、光照。 (4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有15种,其中核磁共振氢谱峰面积比为6∶2∶2∶1∶1的分子的结构简式为。 13 解析: 13 13 13 13 13查看更多